胰蛋白酶激活条件优化及其在细胞培养中的应用
2018-01-18李明生靳冬武冯玉萍马忠仁
李明生 , 靳冬武 , 张 健 , 冯玉萍 ,郑 荣 , 张 磊 , 李 倬 , 马忠仁 ,3
(1.西北民族大学 生物工程与技术国家民委重点实验室,甘肃 兰州730030;2.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;3.甘肃省动物细胞工程技术研究中心,甘肃 兰州 730030)
从猪、牛或羊胰脏中提取的蛋白质分解酶胰蛋白酶[1]是丝氨酸蛋白酶家族中特有的成员,属于肽链内切酶,特异性的水解碱性的精氨酸和赖氨酸羧基所组成的肽键[2]。广泛应用于动物细胞培养、食品、洗涤剂、皮革、医药等领域中[3-4],尤其是在动物细胞培养领域中应用极为广泛[5-6]。目前国内外几乎所有科研与生产用户细胞培养用胰蛋白酶都依赖美国Gibco和Hyclone两家公司,国内生产几乎为空白。这是因为在胰蛋白酶制备过程中酶原激活条件的重要性。这种酶在哺乳动物的胰腺中以无活性的胰蛋白酶原的形式合成和储存,同时也包含有另一种相似的结构和功能特性的丝氨酸蛋白酶糜蛋白酶[7],在酶原激活过程中,胰蛋白酶和糜蛋白酶在一定的条件下相互转化。而在体内胰蛋白酶原是由胰脏中胰腺细胞合成并分泌到十二指肠,并在肠激酶的催化下将胰蛋白酶原激活为有活性的胰蛋白酶[8-9],激活的胰蛋白酶能够催化许多胰腺来源的无活性的酶原,例如胰蛋白酶原、胰凝乳蛋白酶原、弹性蛋白酶原和羧肽酶,而蛋白酶活化受体直接或间接控制肠道消化效率[10]。因此,作者以猪胰脏为原料,酶活力为衡量指标,在单因素试验基础上通过正交试验对胰蛋白酶原体外激活条件进行研究,采用离子交换层析对激活后的粗制胰蛋白酶进行纯化,得到细胞培养用胰蛋白酶单品,最后探讨该单品对BHK-21和Vero两种贴壁依赖性细胞的消化效果,为细胞培养用胰蛋白酶的进一步研究和国产化奠定理论基础。
1 材料与方法
1.1 材料与试剂
猪胰脏:由青海省乐都县屠宰场提供;细胞培养用胰蛋白酶:购自美国Hyclone和Gibco公司;苯甲酰-L-精氨酸乙酯 (BAEE):购自Sigma公司;DEAE Sepharose FF:购自美国GE公司;蛋白质相对分子质量预染marker:购自Bio-Rad公司;BHK-21细胞和Vero细胞:由甘肃省动物细胞工程技术研究中心提供;DMEM培养基:购自兰州百灵生物技术有限公司;新生牛血清:购自兰州民海生物工程有限公司;其它试剂均为分析纯。
1.2 仪器与设备
OA2000型实验室数显定时搅拌器:上海殴河机械设备有限公司;SG2型pH计:梅特勒-托利多仪器有限公司;DYY-12型电泳仪:北京市六一仪器厂;KjeltecTM 8200型凯氏定氮仪:丹麦Foss公司;LGJ--200F真空冷冻干燥机:北京松源兴科技发展有限公司;Biomate 5型紫外分光光度计:美国Thermo公司;超滤仪:PALL公司;AKTA Purifier快速纯化液相色谱系统:美国GE公司;CKX41型倒置生物显微镜:OLYMPUS。
1.3 试验方法
1.3.1 工艺路线 新鲜胰脏预处理→提取→盐析制备胰蛋白酶原→酶原的激活→超滤脱盐→离子交换层析→冷冻干燥
1.3.2 单因素试验 根据工艺路线,取胰脏2 kg,加入3倍体积pH 3.0的纯化水搅拌提取24 h后,加入硫酸铵至0.75饱和度盐析制备胰蛋白酶原。以激活激活剂浓度、激活时间、pH值、温度4个因素进行单因素实验,做平行实验3次,确定影响胰蛋白酶活力的最佳单因素条件。
1)激活剂浓度对酶活力的影响:酶原的激活过程中,胰蛋白酶为诱导剂,控制体系的激活时间1.5 h、pH 8.0、温度16℃,激活剂氯化钙的终浓度分别设置为 0.1、0.15、0.2、0.25、0.3 mol/L。
2)激活时间对酶活力的影响:酶原的激活过程中,胰蛋白酶为诱导剂,控制体系的激活pH 8.0、温度16℃,激活剂氯化钙的终浓度0.2 mol/L。激活时间分别设置为 0.5、1.0、1.5、2.0、2.5 h。
3)激活pH对酶活力的影响:酶原的激活过程中,胰蛋白酶为诱导剂,控制体系的激活时间1.5 h、温度16℃,激活剂氯化钙的终浓度0.2 mol/L,激活pH 值分别设置为 7.0、7.5、8.0、8.5、9.0。
4)激活温度对酶活力的影响:酶原的激活过程中,胰蛋白酶为诱导剂,控制体系的激活时间1.5 h、pH 8.0,激活剂氯化钙的终浓度为0.2 mol/L,激活温度分别设置为 4、8、12、16、20 ℃。
1.3.3 正交试验的设计 选择激活剂的浓度、激活时间、pH值和温度4个因素,根据单因素试验得出的结果,选择合适的水平采用L9(34)正交试验确定胰酶提取的最佳工艺参数,正交试验L9(34)因素水平设计见表1。
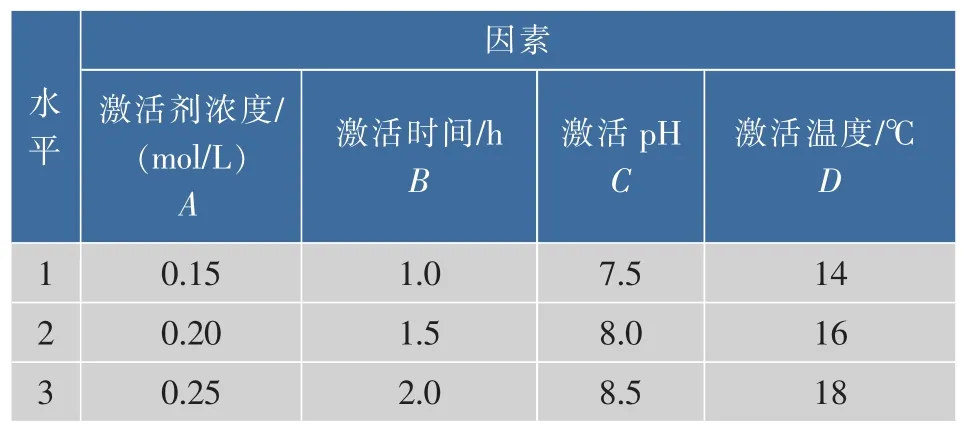
表1 正交试验L9(34)因素水平Table 1 Factors and levels for L9(34) orthogonal test
1.3.4 胰蛋白酶的纯化 采用AKTA层析进行纯化,具体洗脱条件为:DEAE Sepharose FF为介质的层析柱;A 液:10 mmol/L pH 9.0的 Tris-HCl;B 液:10 mmol/L pH 9.0的 Tris-HCl和 0.2 mol/L NaCl组成;上样液:蛋白质质量浓度在20~30 mg/mL;流速:1 mL/min。
1.3.5 胰蛋白酶活力和总蛋白质质量浓度的检测胰蛋白酶活力按照中华人民共和国药典2010版二部胰蛋白酶效价测定法进行检测;蛋白质质量浓度按照中华人民共和国药典2010版二部附录ⅦM第一法凯氏定氮法检测[1]。
1.3.6 SDS-PAGE分析 采用SDS-PAGE对胰蛋白酶纯化效果进行鉴定,电泳条件:5 g/dL pH 6.8的浓缩胶,12 g/dL pH 8.8的分离胶;样品中加入等量的 2×SDS上样缓冲液,95 ℃变性 5 min,15 μL 上样。80 V电泳2 h后将胶用考马斯亮蓝染色。
1.3.7 胰蛋白酶在细胞培养中的应用 将胰蛋白酶配制成0.25%活力为1∶250的胰蛋白酶液,选择BHK-21和Vero两种传代细胞进行消化试验,连续消化培养10代,记录消化时间并进行细胞计数,显微镜观察细胞形态并拍照。同时用Gibco和Hyclone的胰蛋白酶作为对照组。
1.3.8 数据处理 每组实验平行3次,实验数据采用SPSS 19.0进行统计分析,最后结果用均数±标准差(X±S)表示。
2 结果与分析
2.1 单因素试验结果
2.1.1 激活剂浓度对酶活力的影响 Ca2+是细胞内调节各种细胞活动的关键离子,诸如从胰腺腺泡细胞中酶原的分泌[11-12]。胰腺分泌的消化酶是由Ca2+浓度、神经递质和激素对胰腺腺泡细胞的受体结合调控来实现[13]。作者以CaCl2为激活剂,对Ca2+的浓度进行研究。由图1可以看出,随着激活剂浓度的提高,酶活力呈先升高后降低的趋势。在激活剂浓度为0.1~0.15 mol/L范围内,胰蛋白酶活力急剧增加(p<0.05),在激活剂浓度为 0.2 mol/L 时,酶活力达到最大值,为1 896.69±6.79,当激活剂浓度提高至0.25 mol/L时,酶活力与最高值没有明显的差异(p>0.05),随后急剧下降(p<0.05)。 因此,激活剂的浓度以0.2 mol/L为最佳。
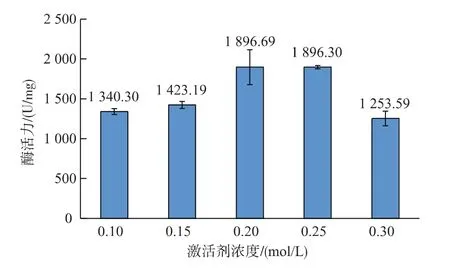
图1 激活剂浓度对酶活力的影响Fig.1 Effect of activation concentration on trypsin activity
2.1.2 激活时间对酶活力的影响 选择最佳激活时间,既能使胰蛋白酶充分激活,又能避免活化后的胰蛋白酶自身降解,是把握激活时间的关键[14]。作者对胰蛋白酶的激活时间进行了研究,结果见图2。由图2可以看出,随着激活时间的增加,酶活力呈先升高后降低的趋势,不同时间的酶活力差异极其显著(p>0.01)。 在 0.5~1.5 h 范围内,胰蛋白酶活力急剧增加(p<0.01),在1.5 h时酶活力达到最高值,为2 522.77±219.55,随后随着时间的延长酶活力急剧下降(p<0.01),说明激活时间对胰蛋白活力尤为重要。因此激活时间1.5 h为最佳。
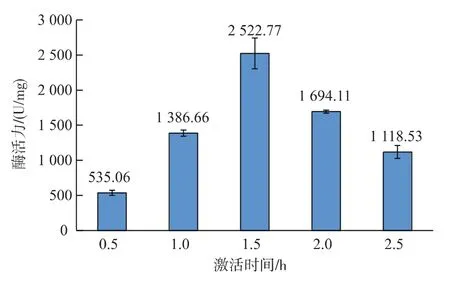
图2 激活时间对酶活力的影响Fig.2 Effect of activation time on trypsin activity
2.1.3 激活pH对酶活力的 由图3可以看出,随着激活pH的增加酶活力呈先升高后降低的趋势。在7.0~8.0 h范围内,胰蛋白酶活力差异明显 (p<0.01),在pH 8.0时酶活力达到最高值,为2 660.10±49.94。随后随着pH的变化,酶活力逐渐下降(p>0.05),因此激活pH 8.0为最佳。Khandagale AS等[15]人从印度马鲛鱼中分离纯化了胰蛋白酶,并对胰蛋白酶的特性进行了研究。Senphan T等[16]人从太平洋白虾的肝胰腺中分离纯化了胰蛋白酶,Liu CH等[17]人从斜带石斑鱼中分离纯化了胰蛋白酶。其激活的pH为均为8.0。这与本研究的激活pH相一致。
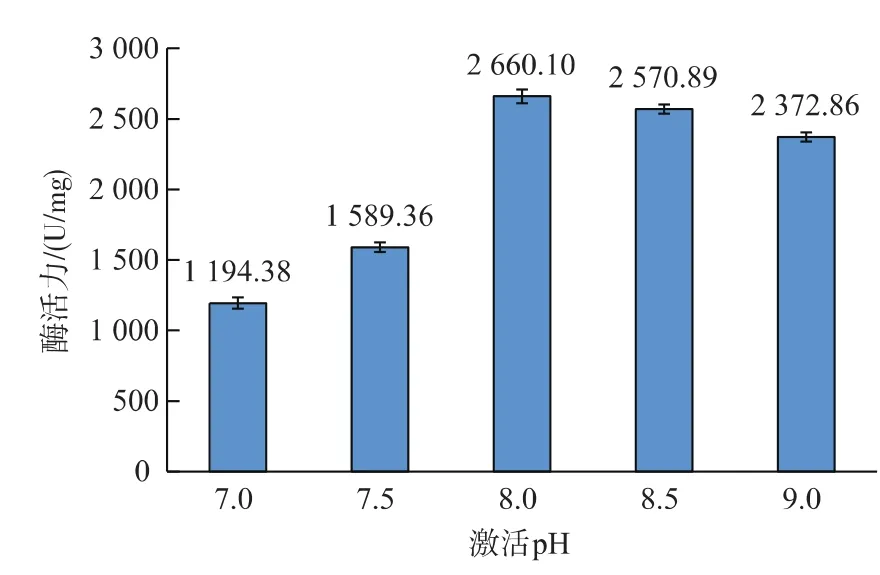
图3 激活pH对酶活力的影响Fig.3 Effect of activation pH on trypsin activity
2.1.4 激活温度对酶活力的影响 由图4可以看出,随着激活温度的增加,酶活力呈先升高后降低的趋势。不同温度下酶活力差异极为显著(p<0.01)。在4~16℃范围内,胰蛋白酶活力差异明显 (p<0.01),16℃时酶活力达到最高值,为 2 845.21±49.45,当激活温度提高至20℃时,酶活力明显下降(p<0.05),这可能是因为在胰蛋白酶提取液中含有大量的糜蛋白酶,在激活过程中胰蛋白酶与糜蛋白酶相互转化,而激活温度过高,胰蛋白酶急剧转化为糜蛋白酶。因此,激活温度以16℃为最佳。
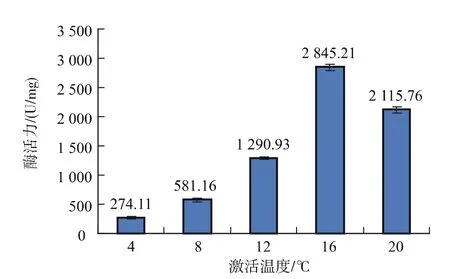
图4 激活温度对酶活力的影响Fig.4 Effect of activation temperature on trypsin activity
2.2 正交试验结果
根据单因素试验结果,确定影响酶活力的4个因素(激活剂浓度、激活时间、pH值、温度)的主要水平。通过L9(34)正交试验确定胰蛋白酶原激活的最佳条件,其结果见表2。
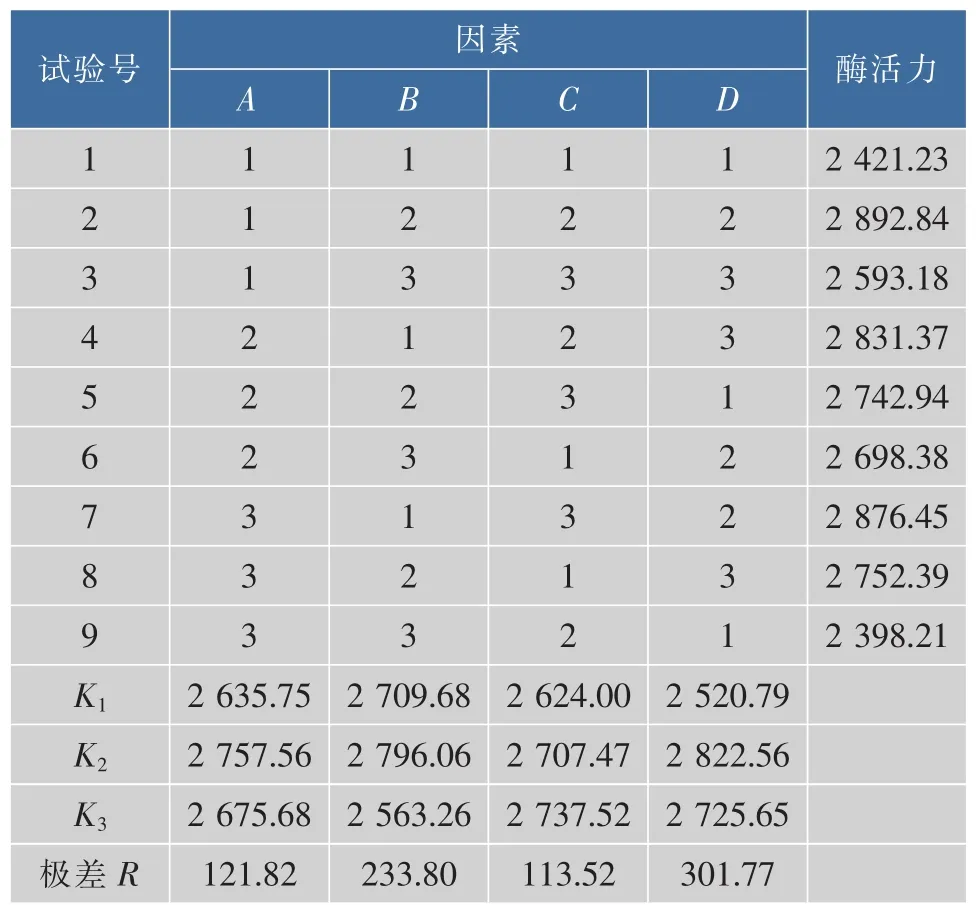
表2 正交试验结果Table 2 Results of orthogonal test
由表2的K值可得胰蛋白酶激活的最优组合为A2B2C3D2,即激活剂的浓度为0.2 mol/L,激活时间为1.5 h,激活pH为8.5,激活温度为16℃,在此条件下通过验证可得酶活力达到2 953.68 U/mg,优于表2中实验号为2的结果(2 892.84 U/mg),因此确定最优激活组合为A2B2C3D2。由极差R可以看出,影响胰蛋白酶活力的四因素的主次顺序为D(激活温度)>B (激活时间)>C (激活 pH)>A (激活剂浓度)。
2.3 胰蛋白酶的纯化
激活后粗品胰蛋白酶液经超滤浓缩至蛋白质质量浓度在20~30 mg/mL范围内,电导500 us/cm以下,调pH至9.0后采用0.45 μm膜过滤后直接上样于已平衡好的DEAE Sepharose FF层析柱,然后采用100%10 mmol/L pH 9.0的Tris-HCl洗脱并收集洗脱峰,超滤浓缩后冻干,纯化过程的参数详见表3。可以看出,在提取过程中胰蛋白酶经纯化后其总蛋白质质量为137.4 g,回收率为36.52%;酶活力为3 980 U/mg,纯化倍数达到2.26。
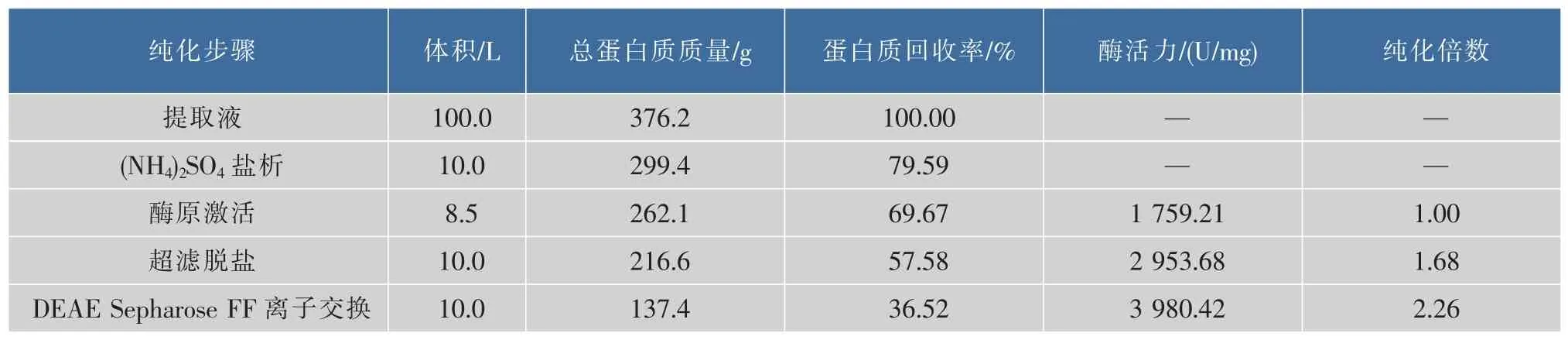
表3 胰蛋白酶分离纯化过程参数Table 3 Summary of purification process for trypsin
李明生等[6]采用了CM-Sepharose-FF层析纯化了胰蛋白酶,我们采用DEAE Sepharose FF层析纯化进行分离。从图5可以看出,图中总共有4条峰。经SDS-PAGE进行纯度检测,图中泳带M为Marker,0为激活后未纯化的粗品胰蛋白酶,1为层析图谱中的Peak 1,H为Hyclone的胰蛋白酶,经对比发现峰1为胰蛋白酶,相对分子质量在23 000左右,其纯度高于Hyclone胰蛋白酶。峰2、3为其他杂蛋白质,峰4为经100%B液洗脱后所得峰,经酶活力检测发现该酶为糜蛋白酶(数据未显示)。
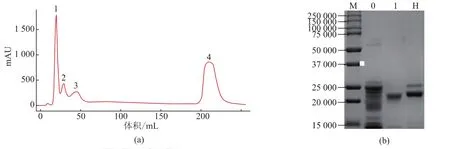
图5 胰蛋白酶离子交换层析图谱和电泳图谱Fig.5 Elution curve of ion exchange chromatography and electrophoretic pattern on trypsin
2.4 胰蛋白酶在BHK-21和Vero细胞中的应用
采用已纯化的自制胰蛋白酶消化BHK-21和Vero两种贴壁细胞,同时以Hyclone和Gibco两种胰蛋白酶为对照。连续消化传代细胞10代次,从图6可以看出,BHK-21和Vero细胞生长良好,形态正常,自制胰蛋白酶与Hyclone和Gibco胰蛋白酶没有明显的差异。
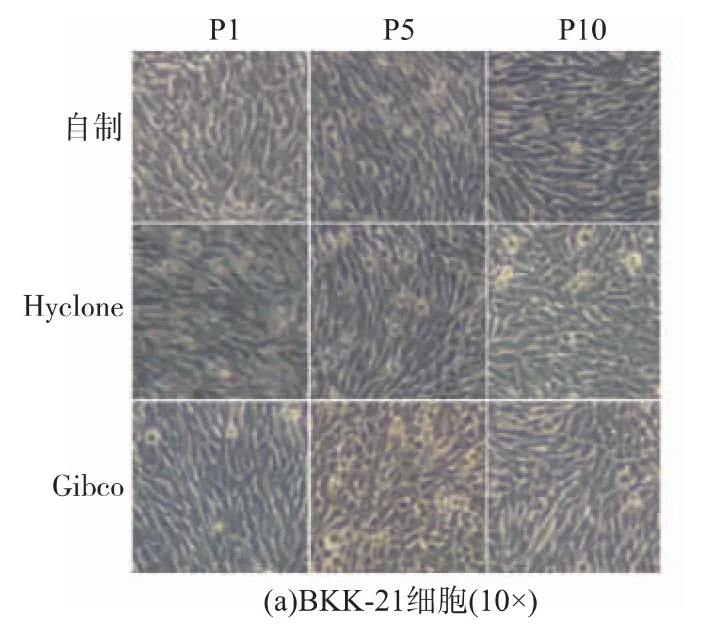
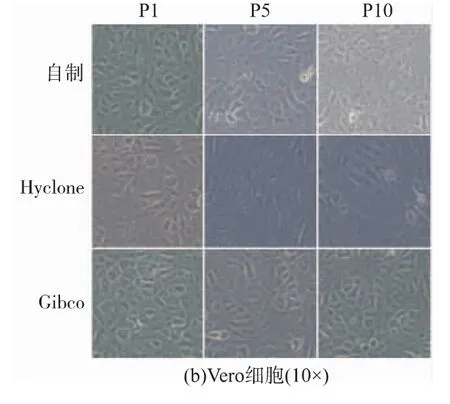
图6 BHK-21和Vero细胞形态图Fig.6 BHK-21 and Vero cells morphology
BHK-21和Vero细胞按1.5×106/瓶浓度接种,每代细胞采用自制胰蛋白酶消化传代,并记录消化时间和细胞计数,同时以Hyclone和Gibco两种胰蛋白酶为对照,连续消化传代10代,结果见图7。从图7可以看出,用自制、Hyclone和Gibco胰蛋白酶消化BHK-21细胞,消化时间分别为3.257、3.076、3.197 min,差异不显著(p>0.05),细胞浓度分别达到7.61×106、7.66×106、7.49×106个/瓶,差异不显著(p>0.05);用自制、Hyclone和Gibco胰蛋白酶消化Vero细胞,消化时间分别为 3.397、3.261、3.291 min,差异不显著(p>0.05),细胞浓度分别达到 6.72×106、6.65×106、7.11×106个/瓶,差异不显著(p>0.05)。 说明自制胰蛋白酶对BHK-21和Vero细胞没有显著的影响。
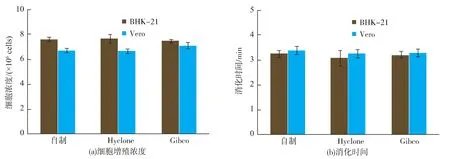
图7 BHK-21和Vero细胞细胞生长密度和消化时间Fig.7 Cell proliferation concentration and digestion time for BHK-21 and Vero cells
3 结语
胰蛋白酶原的最佳激活条件为激活剂的浓度0.2 mol/L,pH 8.5,温度 16 ℃,激活时间 1.5 h,在该条件下激活后胰蛋白酶的活力达到2 954 U/mg。激活后粗胰蛋白酶经DEAE Sepharose FF纯化后其酶活力为3 980 U/mg,酶活力的纯化倍数达到2.26。
自制胰蛋白酶对BHK-21和Vero两种细胞没有明显的影响,其细胞形态、细胞生长浓度和消化时间与Hyclone和Gibco胰蛋白酶没有明显的差异,这为细胞培养用胰蛋白酶的进一步研究和国产化奠定理论基础。
[1]中华人民共和国药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:847-848.
[2]SHU M,SHEN W,WANG X J,et al.Expression,activation and characterization of porcine trypsin in Pichia pastoris GS115[J].Protein Expression and Purification,2015,114:149-155.
[3]WOODARD S L,MAYOR J M,BAILEY M R,et al.Maize (Zea mays)-derived bovine trypsin:characterization of the first large-scale,commercial protein product from transgenic plants[J].Biotechnol Appl Biochem, 2003,38(2):123-130.
[4]CHEN Jian,LIU Long,DU Guocheng.Current status and prospects of enzyme preparation industry in China[J].Journal of Food Science and Biotechnology,2012,31(1).(in Chinese)
[5]WICHT O,LI W T,WILLEMS L,et al.Proteolytic activation of the porcine epidemic diarrhea coronavirus spike fusion protein by trypsin in cell culture[J].J Virol,2014,88(14):7952-7961.
[6]LI Mingsheng,LI Zhuo,QIAO Zilin,et al.Preparation and trypsin in cell culture applied research[J].Nat Prod Res Dev,2009,21:1011-1014.(in Chinese)
[7]PEREZ R L,LOUREIRO D B,NERLI B B,et al.Optimization of pancreatic trypsin extraction in PEG/citrate aqueous two-phase systems[J].Protein Expr Purif,2015,106:66-71.
[8]OGAWA H,KUSUMI I,OGATA A,et al.Autoactivation of pancreatic trypsinogen is controlled by carbohydrate-specific interaction[J].FEBS Lett,2015,589(5):569-575.
[9]GORELICK F S,MODLIN I M,LEACH S D,et al.Intracellular proteolysis of Pancreatic zymogens[J].Yale J Biol Med,1992,65(5):407-420,437-440.
[10]CHEN J M,FEREC C.Genes,cloned cDNAs,and proteins of human trypsinogens and pancreatitis-associated cationic trypsinogen mutations[J].Pancreas,2000,21(1):57-62.
[11]GORELICK F S,MODLIN I M,LEACH S D,et al.Intracellular proteolysis of Pancreatic zymogens[J].Yale J Biol Med,1992,65(5):407-420,437-440.
[12]RARATY M,WARD J,ERDEMLI G,et al.Calcium dependent enzyme activation and vacuole formation in the apical granular region of Pancreatic acinar cells[J].Proc Natl Acad Sci USA,2000,97(24):13126-13131.
[13]PAREKH A B.Calcium signaling and acute pancreatitis:specific response to a Promiscuous messenger[J].Proc Natl Acad Sci U S A,2000,97(24):12933-12934.
[14]LI Junlan,YU Qunli,ZHANG Li,et al.Optimization of ovine pancreatin preparation by uniform design method[J].Food and Fermentation Industries,2011,6(37):120-125.(in Chinese)
[15]KHANDAGALE A S,SAROJINI B K,KUMARI S N,et al.Isolation,purification and biochemical characterization of trypsin from Indian mackerel (Rastralliger kanagurta)[J].Journal of Aquatic Food Prod Tech,2015,DOI:10.1080/10498850.2013.777864.
[16]SENPHAN T,BENJAKUL S,KISHIMURA H,et al.Purification and characterization of trypsin from hepatopancreas of Pacific white shrimp:trypsin from Pacific white shrimp[J].Journal of Food Biochemistry,2015,4(39):388-397.
[17]LIU C H,SHIU Y L,HSU J L,et al.Purification and characterization of trypsin from the pyloric ceca of orange-spotted grouper,Epinephelus coioides[J].Fish Physiol Biochem, 2012,38(3):837-848.
