重组β-半乳糖苷酶的制备及转化条件优化
2018-01-18胡树兵段绪果
胡树兵 , 段绪果 , 吴 敬 *
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
低聚半乳糖(galacto-oligosaccharide,GOS)是在乳糖分子的半乳糖基一侧连接上1-4个半乳糖基生成的低聚糖类。 半乳糖之间以 β(1-3)、β(1-4)或β(1-6)键连接,其中以 β(1-4)键为主,是由葡萄糖和半乳糖组成的杂低聚糖[1]。低聚半乳糖是目前各类功能性低聚糖品种中惟一源自动物乳汁中的一类,并且在提高双歧杆菌数量、降低梭菌数量、产生较多短链脂肪酸、产生较少气体等方面具有突出的优点[2]。研究证明,GOS可以作为肠道内双歧杆菌增殖因子,具有良好的保健作用。由于在酸性和高温条件下具有极好的稳定性,低聚半乳糖被广泛地应用于糖果、果酱、烘焙食品、清凉饮料、保健食品等。随着研究的深入,其应用范围越来越广,产品种类繁多[3-4]。
以乳糖为底物,利用微生物β-D-半乳糖苷酶催化是工业化生产低聚半乳糖的主要途径[5]。β-半乳糖苷酶 (EC3.2.1.23),全称为β-D-半乳糖苷半乳糖水解酶,又名乳糖酶,是一种广泛存在于动植物及微生物中的多功能酶。它不但能够水解乳糖,还具有半乳糖苷转移活性[6]。该酶可以从多种微生物中得到,例如真菌和细菌。不同来源的酶表现出不同的转糖基活性,从而导致其合成GOS的水平和组成各不相同。Prenosil等认为来源于真菌、米曲霉的β-半乳糖苷酶与产自黑曲霉、乳酸克鲁维酵母和脆壁克鲁维酵母的酶相比,可以合成更高浓度的GOS[7]。吴玉飞等将来源于硫矿硫化叶菌的一种突变体F441Y分别在大肠杆菌BL21(DE3)和毕赤酵母中进行了重组表达,优化了酶转化条件,最高GOS转化率分别达到61%和59.9%[8-9]。环状芽孢杆菌Bacillus circulans β-半乳糖苷酶具有较强的转糖基活性,能够高效转化乳糖生产低聚半乳糖。而且该酶制备的GOS主要由β-1-4糖苷键连接而成,产品应用效果明显、稳定性良好,在欧洲被长期应用于功能食品及保健品中,已经被证明安全可靠。
前期我们构建了一种新的重组大肠杆菌E.coli BL21(DE3)/pET-20b-lac,并对重组酶的酶学性质进行了初步研究。作者以前期构建的重组大肠杆菌为菌种,在摇瓶中进行培养,得到了重组β-半乳糖苷酶粗酶液。在参考该重组酶酶学性质研究结果的基础上,对酶转化工艺进行优化,以获得高效生产低聚半乳糖的最优方法。
1 材料与方法
1.1 菌株
带有源自环状芽孢杆菌B.circulans β-半乳糖苷酶基因β-lac的重组菌E.coli BL21(DE3)/pET-20b-lac为作者所在实验室保藏。
1.2 培养基
1.2.1 LB种子培养基(g/L) 蛋白胨10,酵母粉5,NaCl 10;氨苄霉素的终质量浓度为100 μg/mL。
1.2.2 TB发酵培养基 (g/L) 蛋白胨12,酵母粉24,甘油5,磷酸氢二钾 12.54,磷酸二氢钾 2.31,甘氨酸0.75%;氨苄霉素终质量浓度为100 μg/mL。
1.3 主要试剂
蛋白胨、酵母粉:购自英国Oxoid公司;邻硝基苯β-D-半乳吡喃糖苷(oNPG):购于美国的Sigma公司;α-乳糖等国产分析纯试剂:购于国药集团化学试剂有限公司。
1.4 摇瓶发酵产β-半乳糖苷酶
将保存在-80℃冰箱中的菌种以2%的接种体积分数接种至LB培养基,37℃、200 r/min培养8 h。然后以5%接种体积分数转接至已加入甘氨酸的TB培养基,37℃、200 r/min培养至OD600=2时,加入2 mmol/L IPTG诱导,继续培养30 h。将发酵液离心取上清液,即为β-半乳糖苷酶粗酶液。
1.5 β-半乳糖苷酶oNPG水解活力的测定
配置0.1 mol/L、pH 6.5的磷酸钠缓冲液,取1.8 mL置于5 mL离心管中,加入100 μL稀释后的粗酶液,置于50℃水浴锅中预热10 min,再加入10 μL 20 mmol/L的oNPG作为底物[10]。反应10 min后加入1 mL 1 mol/L冰预冷的Na2CO3溶液终止反应,420 nm光吸收下测定吸光值。在上述条件下,每分钟转化生成1 μmol oNPG所需的酶量为一个酶活力单位。
1.6 β-半乳糖苷酶制备低聚半乳糖工艺优化
1.6.1 反应初始pH对GOS转化率的影响 分别用 pH 值为 4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0 的磷酸缓冲液溶解300 g/L的乳糖作为底物,加入终浓度为3 U/mL的粗酶液后置于水浴摇床中进行酶转化。设置水浴摇床温度为40℃,转速150 r/min,反应24 h后煮沸样品终止反应,产物用高效液相色谱(HPLC)进行检测。
1.6.2 反应温度对GOS转化率的影响 用pH 6.5的磷酸缓冲液溶解300 g/L乳糖作为底物,加入3 U/mL的粗酶液后置于水浴摇床中进行酶转化实验。水浴摇床温度分别控制在 40、45、50、55、60、65、70℃,转速设定为150 r/min,反应24 h后煮沸样品终止反应,产物用HPLC进行检测。
1.6.3 乳糖浓度对GOS转化率的影响 用pH 6.5的50 mmol/L磷酸缓冲液分别配制质量浓度为300、400、500、600、700、800 g/L 的反应底物乳糖溶液,分别加入3 U/mL的粗酶液,在55℃、转速为150 r/min的回转式水浴摇床中反应24 h,反应结束后煮沸样品终止反应,用HPLC检测生成的产物。
1.6.4 加酶量和反应时间对GOS转化率的影响用pH 6.5的50 mmol/L磷酸缓冲液配制反应底物乳糖溶液(700 g/L),加酶量分别控制为 1、3、5、8、15 U/mL,设置水浴摇床温度为55℃、转速150 r/min,从第4小时开始每隔4 h取样煮沸终止反应,直至反应达到平衡,产物用HPLC进行检测。
1.7 低聚半乳糖测定方法
产物中的转移二糖含量采用HPLC检测[11]。色谱条件为:安捷伦1200 HPLC色谱仪,安捷伦自动进样器,色谱柱 Thermo Aps-2 HYPERSIL(4.6 mm×250 mm),示差检测器为安捷伦2410;流动相采用体积分数75%乙腈和水的混合溶液,流速为 0.8 mL/min,柱温设定为40℃。
低聚半乳糖产物中的四糖、三糖以及乳糖和单糖的量采用HPLC来确定[12]。色谱条件为:安捷伦1200 HPLC色谱仪,安捷伦自动进样器,色谱柱Bio-radAminex HPX-87H (7.8 mm×300 mm),示差检测器安捷伦2410;流动相为5 mmol/L稀硫酸溶液,流速设定为0.6 mL/min,柱温控制40℃。
1.8 低聚半乳糖产率的计算

其中 GOS(%)=TD(%)+三糖(%)+四糖(%)其中TD为转移二糖
2 结果与讨论
2.1 重组β-半乳糖苷酶的摇瓶发酵制备
将菌种以2%的接种体积分数从甘油管接种至LB培养基,培养8 h转接至已加入甘氨酸的TB培养基,当OD600=2时,加入2 mmol/L IPTG诱导,每隔6 h取样测酶活,将酶活随着时间变化的曲线绘制成图,结果见图1。随着时间的推移,重组β-半乳糖苷酶酶活不断增加,诱导24 h达到最高酶活15 U/mL,继续增加诱导时间,胞外酶活有下降的趋势。
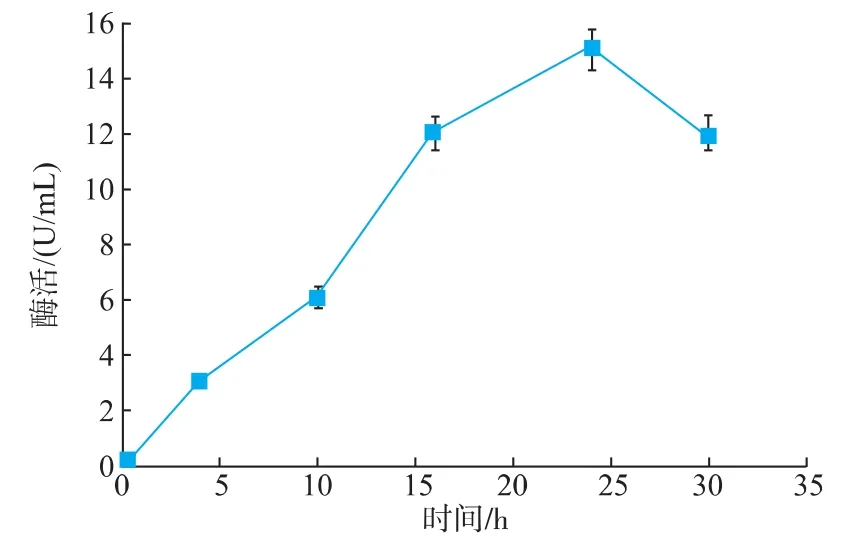
图1 重组菌在摇瓶发酵中的产酶曲线Fig.1 Fermentation process of the recombinant E.coli BL21(DE3) in shake flask
2.2 初始pH对GOS转化率的影响
pH的改变可以影响酶活性中心基团的解离程度,同时可以影响辅酶和底物的解离程度,进而影响酶分子与底物分子的结合。只有在合适的pH下,底物分子和酶与辅酶的解离状态才能达到最佳,从而更有利于它们互相结合,发生催化作用,使酶反应速率达到最高[13]。
为了探究不同pH对GOS转化率的影响,用磷酸氢二钠/磷酸二氢钠缓冲液溶解30%的乳糖,加酶量为3 U/mL,40℃下进行酶转化实验,结果见图2。在pH 4.0条件下,GOS转化率只有30%;随着pH的增加,GOS转化率逐渐升高,当反应体系的pH为6.5时,GOS转化率为38%,是所有pH条件下的最高水平。pH范围在5.5~7.0之间时,GOS转化率维持在相对较高的水平。这可能是由于在pH 4.0的条件下,整个反应体系偏酸性,导致酶严重失活,从而导致转化率降低。而在pH 5.5~7.0范围内,β-半乳糖苷酶相对稳定,从而使转化率维持在较高水平。
2.3 反应温度对GOS转化率的影响
文献报道显示,反应温度对GOS转化率的影响较为明显[14]。如图3所示,55℃下GOS转化率达到最大值43%,随着温度的升高或下降,GOS转化率下降。70℃下GOS转化率只有32%。从图中也可以看出,在一定的范围内,随着温度的升高,GOS转化率逐渐升高,这可能是因为温度影响了反应过程中分子间相互作用的速度、活化能以及酶和底物的热稳定性,从而改变了GOS的产率[9]。一般来说,在不影响酶活力的前提下,温度越高,反应速率可能越快,同时高温可以增加底物的溶解度,有利于提高生产效率。综合以上因素,选用55℃为后续研究的反应温度。

图2 pH对低聚半乳糖转化率的影响Fig.2 Effect ofpH on the yield of galactooligosaccharides

图3 温度对低聚半乳糖转化率的影响Fig.3 Effect of temperature on the yield of galactooligosaccharides
2.4 底物质量浓度对GOS转化率的影响
除了温度和pH两个因素之外,底物质量浓度也对GOS转化率有很大的影响[15]。如图4所示,乳糖质量浓度为300 g/L时,GOS转化率只有42%。随着乳糖质量浓度的增加,GOS转化率也逐渐提高,当乳糖质量浓度为700 g/L时,GOS转化率达到最高,为53%。继续增加乳糖质量浓度,GOS转化率显著下降,当乳糖质量浓度增大到800 g/L时,GOS转化率下降到47%。
从β-半乳糖苷酶转化乳糖制备GOS的反应过程来分析,产生这种现象的原因可能是β-半乳糖苷酶同时具有转苷活性和水解活性,它的催化反应是一个可逆的过程。由化学平衡可知,提高底物乳糖质量浓度,可推动转苷反应朝正向进行,促进低聚半乳糖的生成。此外,提高乳糖质量浓度还可以降低水活度,从而降低酶水解活性、提高其转苷活性。因而当乳糖质量浓度小于等于700 g/L时,GOS转化率随着底物质量浓度的增加不断升高。但是当乳糖质量浓度过高时,低聚半乳糖转化率降低,这可能是因为过高的底物质量浓度会使体系的水分活度过低,同时增加了反应体系的传质传热难度,对酶反应产生了一定的抑制作用[7],因此选用700 g/L的起始乳糖质量浓度为最佳。
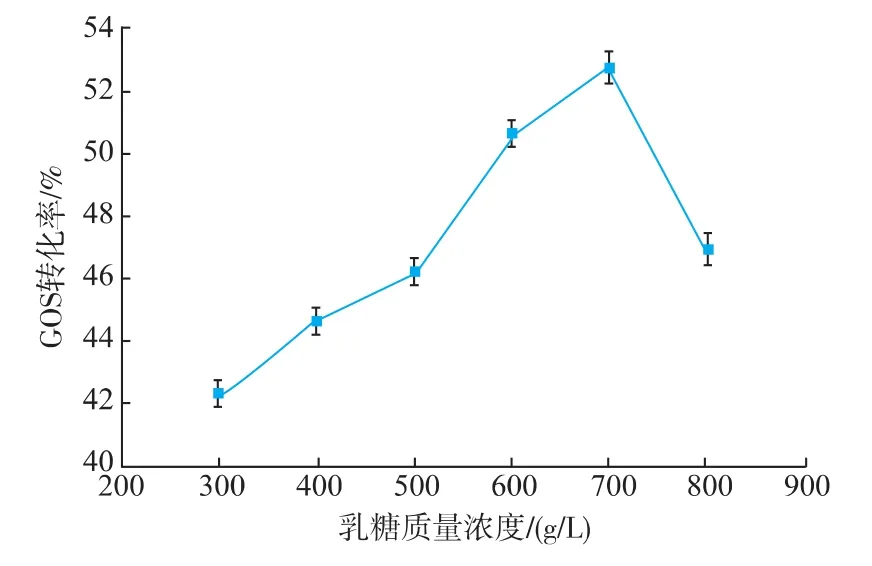
图4 乳糖质量浓度对低聚半乳糖转化率的影响Fig.4 Effect of lactose concentrations on the yield of galactooligosaccharides
2.5 加酶量和反应时间对GOS转化率的影响
加酶量不仅影响最终的GOS产量,还会影响反应达到平衡的时间。作者从反应过程的不同反应时间节点进行取样,测定反应体系中GOS转化率,并且绘制反应过程GOS转化率随时间变化的曲线,以考察不同加酶量和反应时间对GOS转化率的影响,结果见图5。
加酶量为1 U/mL时,反应进行30 h达到平衡,GOS转化率仍未达到最大值。当加酶量为3 U/mL和5 U/mL时,反应20 h GOS转化率分别达到最大值53.6%和54.8%。当加酶量增加到8 U/mL时,达到最大GOS转化率的时间明显缩短,16 h GOS最高转化率为57%,为几种加酶量下的最高转化率。当继续增大加酶量到15 U/mL时,转化率很快达到最大值52.2%,但随着反应时间的推移,转化率有下降的趋势。
分析产生上述现象的原因,可能是由于加酶量过低时,其催化能力不足,酶反应速率较低。而加酶量过高时,生成的产物又容易被过量加入的酶水解掉,从而降低GOS的最终转化率。因此,为了在尽可能短的反应时间内达到最高的转化率,选用8 U/mL的加酶量为最佳。
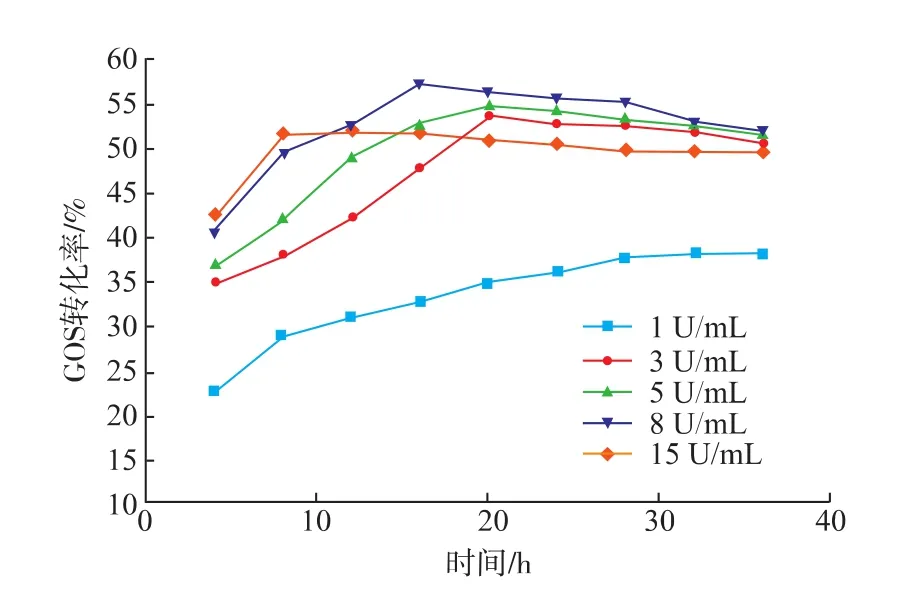
图5 加酶量和反应时间对低聚半乳糖转化率的影响Fig.5 Effect of enzyme concentration and reaction timeon the yield of galactooligosaccharides
3 结 语
本研究中重组 E.coli BL21(DE3)/pET-20b-lac菌株能够高效分泌表达β-半乳糖苷酶,摇瓶发酵初步研究得到胞外上清酶活为15 U/mL。对该重组β-半乳糖苷酶转化乳糖制备低聚半乳糖转化条件进行了优化。结果表明,最优反应条件为:底物质量浓度700 g/L,反应初始pH 6.5,温度55℃,加酶量8 U/mL,在该条件下转化16 h,低聚半乳糖最大转化率达到57%。在后续的研究中,我们计划将该酶在食品安全宿主枯草芽孢杆菌Bacillus subtilis中进行表达,获取酶液以制备低聚半乳糖。
[1]JIA Jianping,QIU Juanping.Advance in the research of galactooligosaccharides[J].China Dairy Industry,2003,31(1):23-25.(in Chinese)
[2]CRITTENDEN R G,PLAYNE M J.Production,properties and applications of food-grade oligosaccharides[J].Trends in Food Science&Technology,1996,7(11):353-361.
[3]PRENOSIL J E,STUKER E,BOURNE J R.Formation of oligosaccharides during enzymatic lactose:Part I:State of art[J].Biotechnology and Bioengineering,1987,30(9):1019-1025.
[4]QIN Yan,NING Zhengxiang,HU Xinyu.Advance of application and research in β-galactoxidase[J].Journal of Shenyang Agricultural University,2000,31(6):595-59.(in Chinese)
[5]SHIN H J,PARK J M,YANG J W.Continuous production of galacto-oligosaccharides from lactose by Bullera singularis β-galactosidase immobilized in chitosan beads[J].Process Biochemistry,1998,33(8):787-792.
[6]PETZELBAUER I,NIDETZKY B,HALTRICH D,et al.Development of an ultra-high-temperature process for the enzymatic hydrolysis of lactose.I.The properties of two thermostable β-glycosidases[J].Biotechnology and Bioengineering,1999,65(6):677-677.
[7]PRENOSIL J E,STUKER E,BOURNE J R.Formation of oligosaccharides during enzymatic lactose hydrolysis and their importance in a whey hydrolysis process:Part II:Experimental[J].Biotechnology and Bioengineering,1987,30(9):1026-1031.
[8]WU Y F,YUAN S,CHEN S,et al.Enhancing the production of galacto-oligosaccharides by mutagenesis of sulfolobus solfataricus β-galactosidase[J].Food Chemistry,2013,138(2):1588-1595.
[9]DUAN Xuguo,SUN Xiaojun,WU Jing.Studies on optimization of production of galacto-oligosaccharides using whole cells of a recombinant Pichia pastoris as catalyst[J].Food and Fermentation Industries,2011(6):391-393.(in Chinese)
[10]SUN X,DUAN X,WU D,et al.Characterization of Sulfolobus solfataricus β-galactosidase mutant F441Y expressed in Pichia pastoris[J].Journal of the Science of Food and Agriculture,2014,94(7):1359-1365.
[11]LI Jingfang,ZHANG Suwen,PENG Meichun,et al.Determination of fructose,glucose,sucrose and lactose indairy products by high performance liquid chromatography[J].Food and Fermentation Industries,2011(6):391-393.(in Chinese)
[12]WANG X M,ZHANG R L,LV Z H,et al.Determination of glucosamine and lactose in milk-based formulae by high-performance liquid chromatography[J].Journal of Food Composition and Analysis,2008,21(3):255-258.
[13]WANG Ning,WU Dan,CHEN Sheng,et al.Preparation of α-cyclodextrin by mutation Y89D of cyclodextrin glycosyltransferase from Paenibacillus macerans[J].Food Science,2011,32(3):165-170.(in Chinese)
[14]LU Lili,LI Zhengyi,XIAO Min.Recent progress on galacto-oligosaccharides synthesis by microbial β-galactosidase[J].Acta Microbiologica Sinica,2008,48(7):980-985.
[15]OTIENO D O.Synthesisofβ-galactooligosaccharidesfrom lactose usingmicrobial β-galactosidases[J].Comprehensive Reviews in Food Science and Food Safety,2010,9(5):471-482.
