酿酒酵母静息细胞转化合成2-苯乙醇
2018-01-19黄筱萍黄国昌金丹凤熊大维
黄筱萍, 黄国昌, 金丹凤, 刘 兰, 熊大维
(江西省科学院 微生物研究所,江西 南昌330029)
2-苯乙醇(2-Phenylethanol,2-PE)是一种具有玫瑰香味的芳香醇,亦是芳香族化合物中最重要的香料品种之一,广泛应用于食品香精、化妆品和日化产品中。天然2-PE是从植物(主要是玫瑰花)中提取,由于其含量太低、成本高,无法满足大规模工业化生产[1]。利用微生物转化L-苯丙氨酸生成2-PE是取代天然2-PE产品的有效途径,酵母菌通过Ehrlich途径转化培养基中的L-苯丙氨酸 (L-Phe)为2-PE可大幅度提高2-PE的产量[2]。酵母在自身生长代谢过程中会产生大量的乙醇,乙醇和2-PE联合作用对菌体产生的毒性是生物转化法生产2-PE中产物浓度不高的主要原因,也是制约生物法生产天然2-PE的技术关键[2-4]。目前采用两相萃取技术原位转移2-PE可一定程度解决产物抑制效应[5-7],但分离纯化困难,提取精制收率低。利用树脂吸附技术原位转移2-PE亦可提高2-苯乙醇产量[8-9]。本研究所采用的酵母静息细胞转化合成2-PE的方法是利用已经培养好的酵母细胞,重新悬浮于缓冲溶液中催化L-Phe转化成2-PE。以菌体细胞作为酶的载体,根据酶的特性添加促进Ehrlich途径中酶活的离子和辅酶NADH再生辅助底物,在单因子试验基础上,利用SAS软件进一步优化转化条件,探讨各因素的交互效应,得到较优条件组合。酵母静息细胞催化反应专一性强,底物转化率高,生成的副产物少,细胞可以重复利用,无需在无菌条件下进行操作[10-11]。在静息细胞转化过程中添加大孔树脂进行原位产物吸附可显著提高2-PE的产率,并使下游提取精制易于实施。目前静息细胞的研究在许多领域已经展开,如天然化合物的生物合成、药物前体化合物转化、乳酸、乙酸的生产等领域[12-15]。
1 材料与方法
1.1 材料与设备
菌种Saccharomyces cerevisiae SH003:由作者所在实验室筛选获得,现保存于江西省科学院微生物研究所;斜面培养基(麦芽汁琼脂培养基g/L):葡萄糖 30,蛋白胨 5,酵母粉 3,麦芽汁 3,pH自然;细胞增殖培养基(g/L):葡萄糖 30,蛋白胨 5,酵母粉3,麦芽汁 3,pH 5.8~6.2;L-苯丙氨酸:河北冀海生物科技有限公司,纯度99.5%;2-苯乙醇标准品:Sigma公司,纯度98.5%;甲醇:色谱纯;超纯水自制,其他试剂均为国产分析纯;SHIMADZU LC-20A高效液相色谱仪;Agilent HC-C18反相色谱柱(250 mm×4.6 mm,5 μm);Sartorius practum 224-1CN 分析天平,湖南湘仪高速冷冻离心机H2500R-2。
1.2 实验方法
1.2.1 静息细胞制备 从斜面挑取1~2环菌苔至30 mL细胞增殖培养液中,于28℃、180 r/min培养18 h,再以2%的接种体积分数接种于细胞增殖培养液中,于28℃、180 r/min培养24 h,进行细胞扩增培养,冷冻离心(8 000 r/min,15 min),用 0.1 mol/L的磷酸钠缓冲液(pH 6.8)洗涤细胞两次,将菌体重悬于0.1 mol/L的磷酸钠缓冲液中,4℃冰箱保存备用。
1.2.2 静息细胞转化方法 用0.1 mol/L的磷酸钾缓冲液配制不同浓度的静息细胞液,加入底物L-苯丙氨酸和辅助底物,于28℃、200 r/min反应24 h,10 000 r/min离心10 min,上清液采用高效液相色谱法检测L-苯丙氨酸和2-苯乙醇质量浓度。
1.2.3 静息细胞转化条件优化方法
1)单因素优化:取不同培养时间的酵母菌体离心,制成静息细胞进行转化合成2-苯乙醇,对制备静息细胞的菌体菌齡进行优化,测定静息细胞浓度和不同的缓冲液体系对合成转化2-苯乙醇的影响。
2)静息细胞辅酶辅助底物再生体系的构建:通过添加不同的辅助底物还原糖(如葡萄糖、蔗糖、D-甘露糖、D-木糖、阿拉伯糖等)或醇类(如甲醇、乙醇、丙醇)进行还原型辅酶NADH再生。
3)Plackett-Burman试验设计筛选影响静息细胞转化的关键因子:采用SAS软件中多因素二水平试验设计,以2-苯乙醇产量作为响应用值Y,对影响转化的因子如细胞浓度、底物质量浓度、糖质量浓度、pH、温度、转化时间进行全面考察,筛选出主要影响因子。
4)Box-Benhnken试验设计结合响应面法分析筛选显著因子的最优水平:以Plackett-Burman设计结果为基础,选择影响转化2-苯乙醇的显著因子为自变量,以苯乙醇产量为响应值,进行三因素三水平试验,采用SAS软件对所得数据进行回归和图形分析,得出优化组合条件,再进行验证实验,检验模型的可行性。
5)静息细胞重复利用:将首次转化结束的静息细胞离心,洗涤,重新悬浮,加入底物和辅助底物,在相同的条件下进行转化,验证静息细胞催化稳定性。
1.2.4 大孔树脂HZ816对2-苯乙醇和L-苯丙氨酸的静态吸附率与解吸率测定 准确量取4 g/L L-苯丙氨酸和2 g/L 2-苯乙醇混合溶液100 mL加入具塞磨口三角瓶中,加入1 g预处理好的树脂,于25℃、100 r/min振荡3 h,真空抽滤,滤液测定2-苯乙醇和L-苯丙氨酸质量浓度。计算树脂的吸附率(mg/g)。收集吸附饱和的树脂,用滤纸吸干表面水,加入具塞磨口三角瓶中,准确量取10 mL 95%乙醇,于25℃、100 r/min振荡4 h,计算树脂解吸率(%)。
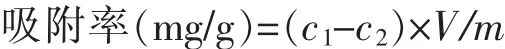
式中,c1为吸附前质量浓度(mg/mL),c2为吸附后质量浓度(mg/mL),V 为溶液体积(mL),m 为树脂质量(g)。
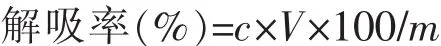
式中,c为解吸液质量浓度 (mg/mL),V为解吸液体积(mL),m 为吸附质量(mg)。
1.2.5 转化液中加入大孔树脂吸附2-苯乙醇试验准确称取3 g树脂加入30 mL静息细胞转化液中,加入底物L-苯丙氨酸和辅助底物,于26℃、200 r/min反应40 h,真空抽滤,滤液10 000 r/min离心5 min后检测得L-苯丙氨酸和2-苯乙醇质量浓度。树脂加入具塞磨口三角瓶中,加入30 mL 95%的乙醇,于25℃、100 r/min振荡4 h,5 000 r/min离心5 min,上清液检测得L-苯丙氨酸和2-苯乙醇质量浓度。
1.2.6 反相高效液相色谱法测定L-苯丙氨酸和2-苯乙醇含量[16]发酵液经10 000 r/min离心10 min,取上清液,稀释,用0.22 μm聚醚水性滤膜过滤后 HPLC 分析。 流动相为 v(甲醇)∶v(水)=50%∶50%,流速为 1.0 mL/min,检测波长 260 nm,柱温30 ℃,进样量 10 μL。
2 结果与讨论
2.1 菌龄对静息细胞转化的影响
静息细胞的转化依赖胞内酶的活性,菌体在不同的生长阶段相应酶表达活性相差较大,考察了细胞不同生长阶段的转化能力。转化条件:分别取在扩增培养液中生长不同时间的菌体,用0.1 mol/L的磷酸钠缓冲液(pH 5.5)配制成10%的菌体浓度,加入8 g/L L-苯丙氨酸,辅助底物20 g/L葡萄糖进行转化,结果见图1。
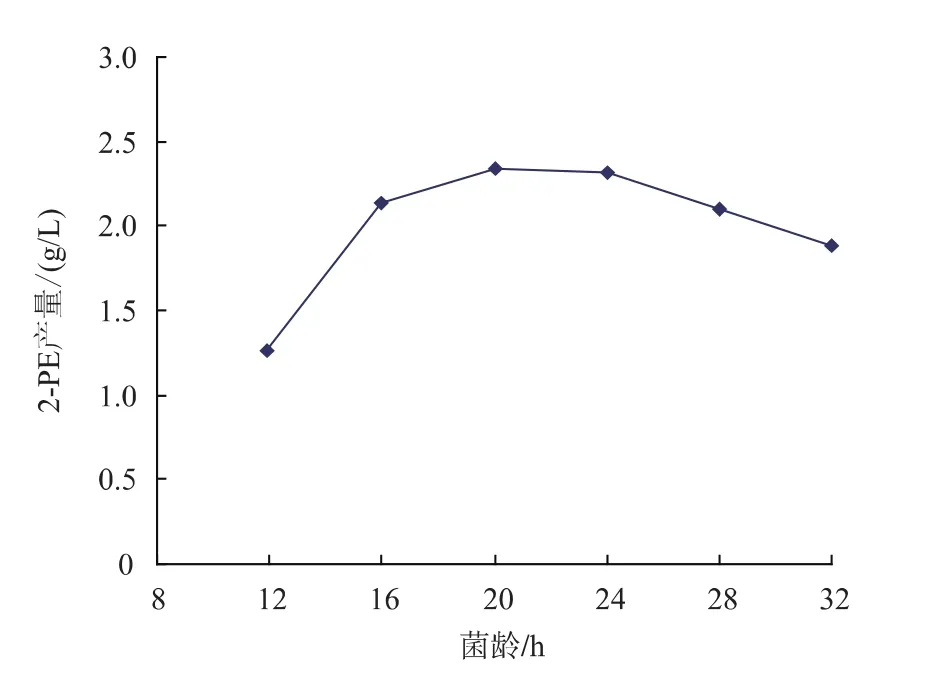
图1 菌龄对静息细胞转化2-苯乙醇的影响Fig.1 Effect of incubation time on 2-phenylethanol production by resting cell
随着菌体培养时间的增加,2-苯乙醇产量也逐渐增加,当菌龄达16 h时,2-苯乙醇的增加渐缓,20 h产量达到最高,达2.34 g/L,随后逐渐降低。这可能与菌体衰老自溶,胞内酶释放和活性降低有关,因此选用菌龄为20 h的菌体制备静息细胞进行转化实验。
2.2 细胞浓度对转化合成2-苯乙醇的影响
利用酵母细胞静息细胞转化合成2-苯乙醇,真正起作用的是细胞内艾氏反应途径的酶系,菌体量直接影响参与反应的酶量,进而影响其催化转化的反应速率和转化率。用pH 5.5、0.1 mol/L的磷酸钠缓冲液配制不同的细胞浓度,加入L-苯丙氨酸8 g/L,辅助底物葡萄糖20 g/L进行转化反应,结果见图2。当细胞浓度为10%时,2-苯乙醇产量达到最高,继续提高细胞浓度不能增加2-苯乙醇的产量,这可能是由于过多的菌体导致溶氧供应不足,同时影响溶液的传质效率,不利于转化进行,因此在转化过程中细胞浓度控制在10%比较合适。
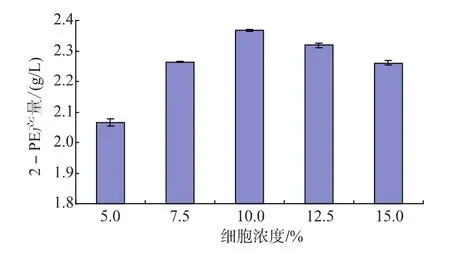
图2 细胞浓度对转化合成2-苯乙醇合成的影响Fig.2 Effect of cell concentration on 2-phenylethanol production by bioconversion
2.3 缓冲液体系对酵母静息细胞转化合成2-苯乙醇的影响
分别配制pH 5.5的0.1 mol/L磷酸钠缓冲液,0.1 mol/L磷酸钾缓冲液和0.1 mol/L磷酸钠与磷酸钾混合缓冲液,在细胞浓度为10%、L-苯丙氨酸为6 g/L、辅助底物葡萄糖为10 g/L进行转化,考察不同配比的缓冲液对静息细胞转化合成2-苯乙醇的影响,结果见图3。
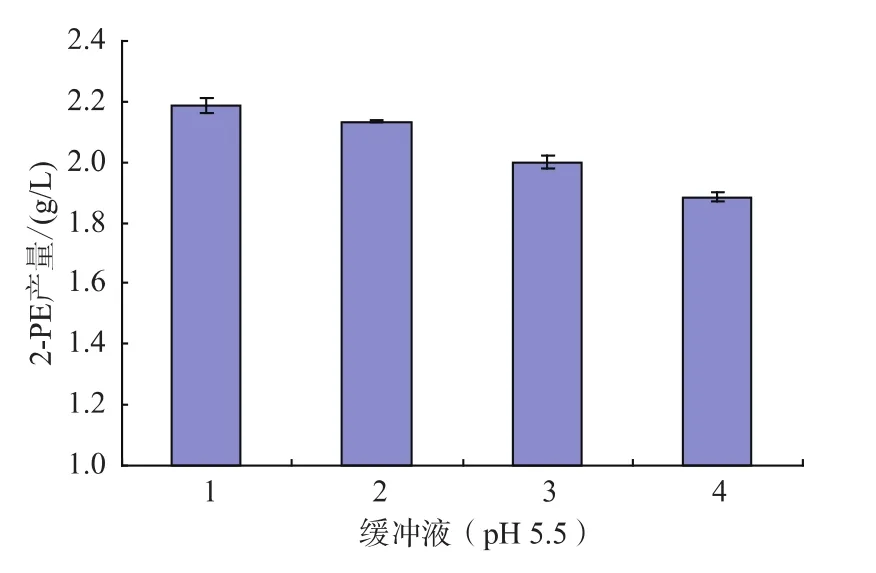
图3 不同缓冲液对转化合成2-苯乙醇的影响Fig.3 Effect of buffer solution on 2-phenylethanol production by bioconversion
PO43+对细胞内电子传递和还原性辅酶氧化起着重要调节作用,静息细胞在K+浓度较高的缓冲液中转化合成2-苯乙醇能力较高,转化合成2-苯乙醇的质量浓度高10%左右,这表明K+也可能对艾氏代谢途径的酶活具有一定的调节作用,有利于细胞的转化合成。
2.4 静息细胞辅酶再生辅助底物筛选
酵母菌通过艾氏途径转化合成2-苯乙醇发生了氧化还原反应,即苯乙醛在脱氢酶的作用下生成了2-苯乙醇,由于细胞中脱氢酶在还原苯乙醛时要不断消耗作为电子供体的还原型辅酶NADH,活性细胞需要不断再生NADH以保持细胞内正常的氧化还原状态[17-18]。静息细胞自身没有再生辅酶能力,在转化液中直接添加辅酶NADH可提高脱氢酶活性,但其价格昂贵。因此添加辅助底物构建与细胞自身代谢耦合的辅酶再生系统是实现静息细胞转化合成2-苯乙醇和重复利用的必要手段。
实验设计在转化液通过添加辅助底物如还原糖和醇类进行还原型辅酶再生。在细胞浓度为10%,L-苯丙氨酸为8 g/L,辅助底物质量浓度20 g/L条件下进行转化,表1为添加不同辅助底物对转化合成2-苯乙醇的影响,对照为不添加辅助底物。
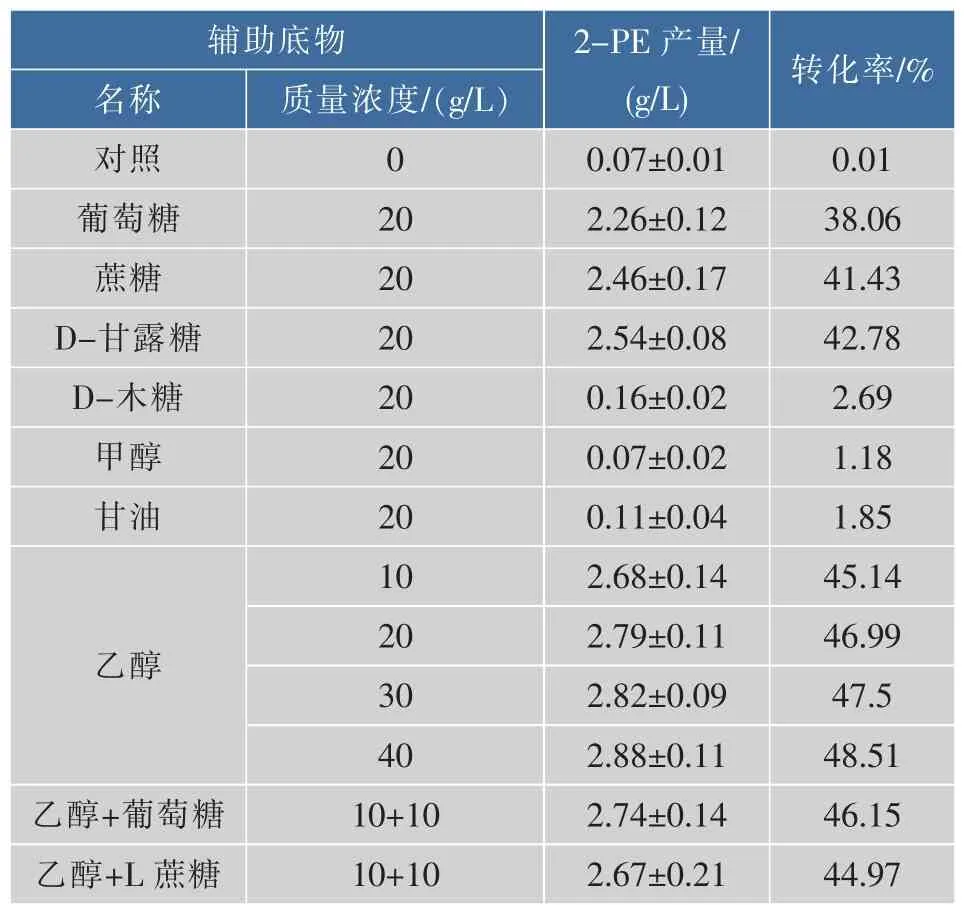
表1 不同辅助底物对转化合成2-苯乙醇的影响Table 1 Effect of co-substrates on 2-phenylethanol production by resting cells
从表1可以看出,在不添加辅助底物时,基本上没有2-苯乙醇的产生,这表明静息细胞内的NADH质量浓度极低,制约了乙醇脱氢酶的活性。不同的辅助底物对合成2-苯乙醇的影响很大,乙醇、D-甘露糖、蔗糖和葡萄糖对转化合成2-苯乙醇有明显的促进作用,而木糖、甲醇和丙醇没有促进作用,其中乙醇的促进作用最为显著,乙醇+葡萄糖、乙醇+蔗糖混合辅助底物的效果与乙醇相似,增加乙醇质量浓度至40 g/L,2-苯乙醇产量无明显增长。
高质量浓度的2-苯乙醇对生长细胞有一定的毒性,可能是影响了原生质膜的通透性,扰乱跨膜质子电势及糖类和氨基酸的运输系统,乙醇和2-苯乙醇的联合作用产生的毒性比它们各自产生的毒性累加作用要高[17-18],而在静息细胞中添加高质量浓度的乙醇对产物的合成没有抑制作用,这也表明了静息细胞转化L-苯丙氨酸为2-苯乙醇主要依赖艾氏途径的酶活性。
2.5 Plackett-Burman试验设计筛选影响静息细胞转化的关键因子
Plackett-Burman法是一种近饱和的二水平试验设计方法,选用实验次数N=12的实验设计,对静息细胞细胞浓度、底物质量浓度、糖质量浓度、转化液pH、温度、转化时间进行全面考察,另设3个虚拟变量用于估计误差,每个因素取高(1),低(-1)两个水平,应用SAS(V9版)软件分别计算各因素的效应值,响应值Y为2-苯乙醇产量,实验设计见表2,各因素主效应分析结果见表3。
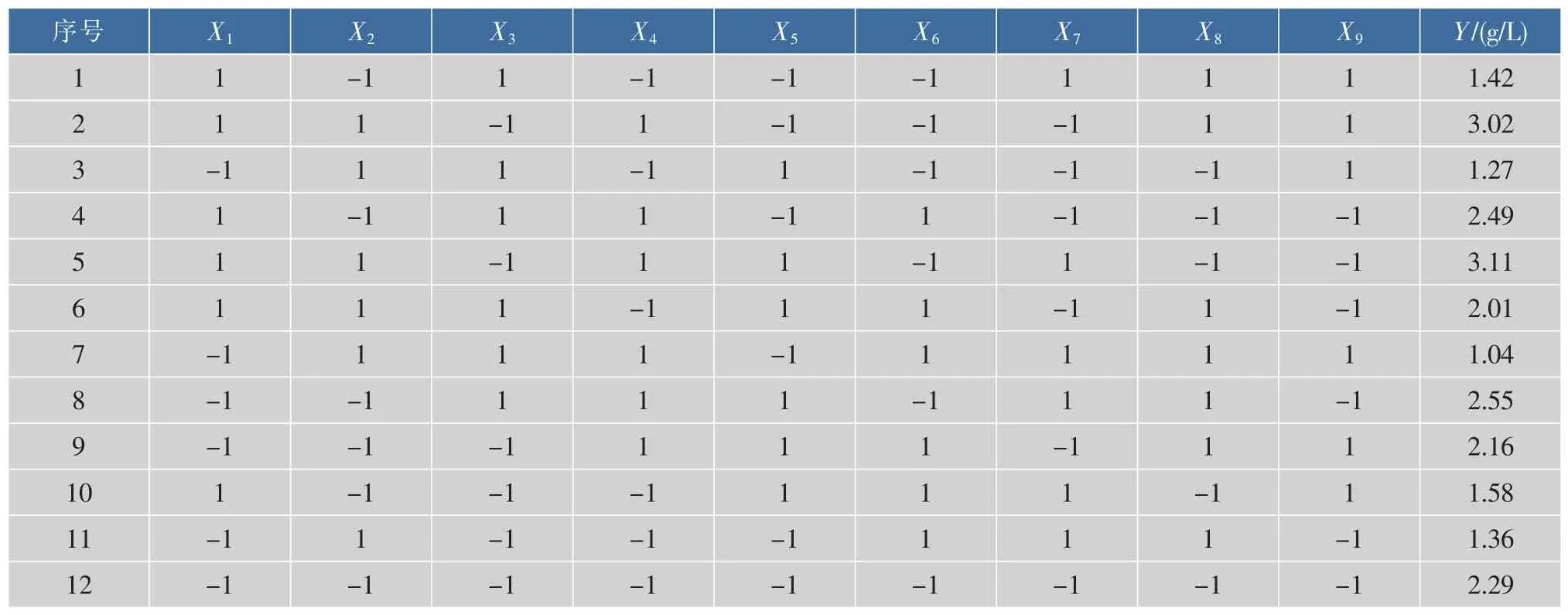
表2 N=12的Plackett-Burman实验设计与水平Table 2 N=12 Plackett-Burman experimental design and response value
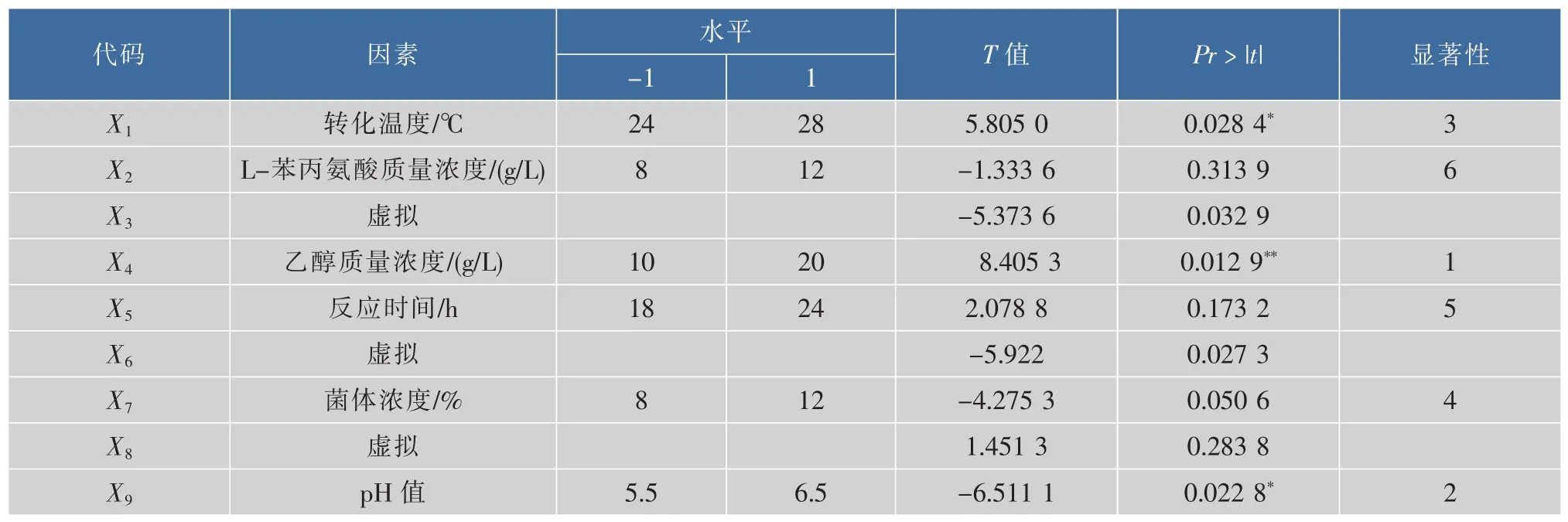
表3 N=12 Plackett-Burman实验因素水平及各因素的主要效应分析Table 3 N=12 Plackett-Burman experimental factors levels and main effect of various factors
从表3可以看出,6个因素对转化效率的影响的主要因素主次关系依次为 X4>X9>X1>X7>X5>X2,乙醇质量浓度、pH和转化温度对2-苯乙醇产量影响显著,细胞浓度对2-苯乙醇产量有一定影响,反应时间和L-苯丙氨酸浓度影响不显著,系数R2=0.972 7,表明拟合程度良好。选择乙醇质量浓度、pH和转化温度3个因素作进一步响应面分析,其他因素正效应取较高水平,负效应取较低水平,即L-苯丙氨酸为8 g/L,反应时间为24 h,菌体浓度为10%。
2.6 响应面设计与分析
根据Plackett-Burman实验确定的实验因素与水平,设计了三因素三水平的响应面分析实验,共有15个实验点,12个分析因子,3个为零点,零点实验重复3次估计误差,以2-苯乙醇产量为响应变量,实验设计和分析结果见表4-5。
二次模型中回归系数的显著性检验表明:因素X1和X2对产2-苯乙醇效果的线效应极显著,因素X3对产2-苯乙醇效果的线效应显著;因素X12、X22对产2-苯乙醇效果的曲面效应用极显著,因素X32对产2-苯乙醇效果的曲面效应用显著;因素X1X2、X1X3和X2X3对产2-苯乙醇效果的交互影响不显著。对试验数据进行多次拟合回归,以2-苯乙醇产量(Y)为因变量,乙醇质量浓度(X1)、转化温度(X2)、pH(X3)为自变量,建立回归方程模型为:Y1=3.458+0.145 8X1-0.222X2-0.095X3-0.195X12-0.233X22-0.157X32。
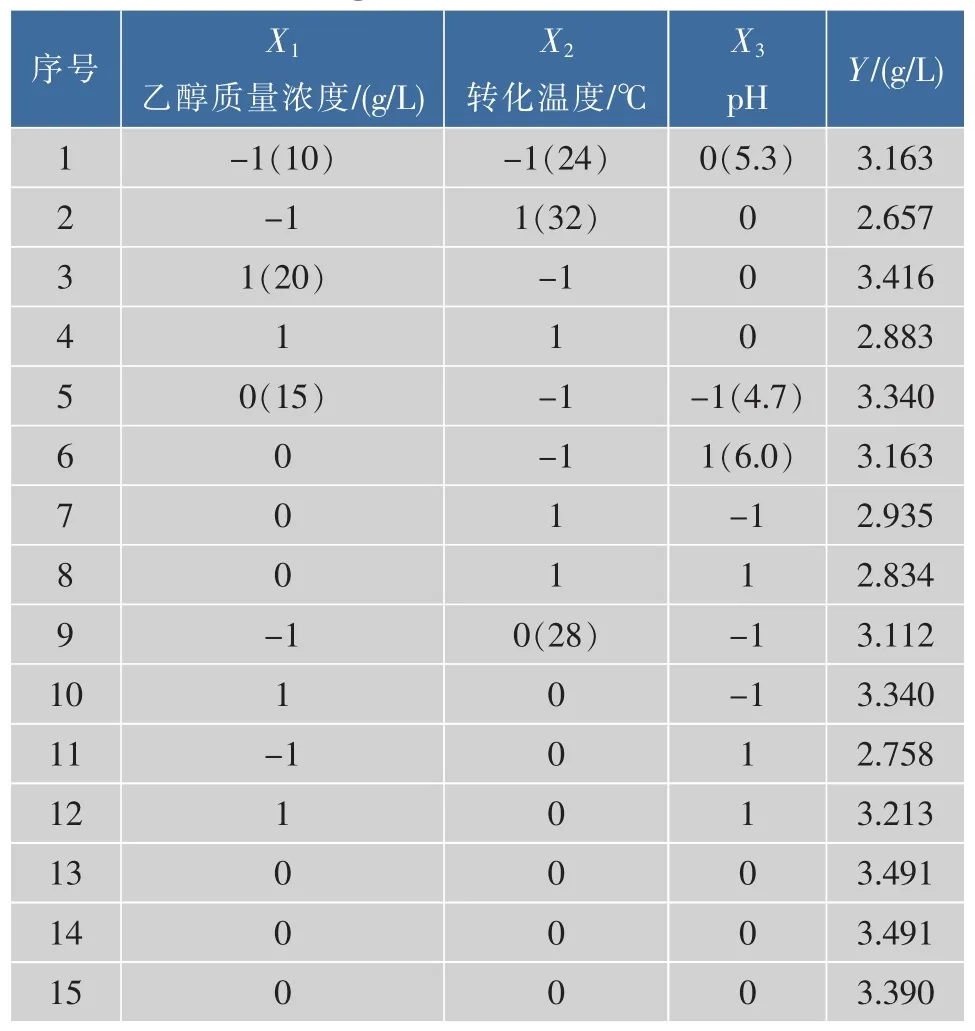
表4 中心组合试验方案与结果Table 4 Design and results of Box-Behnken
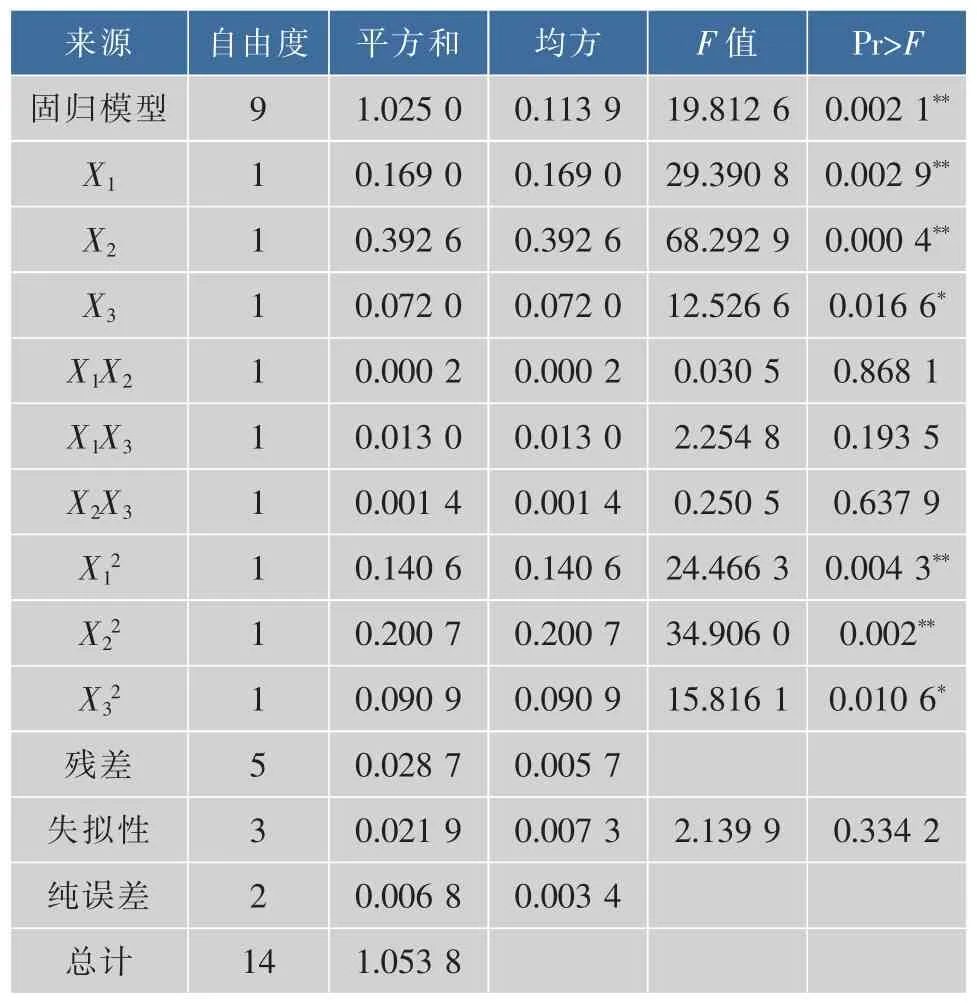
表5 回归与方差分析结果Table 5 Results of regression and variance analysis
试验各因素对2-苯乙醇产量影响显著程度大小依次为:转化温度>乙醇质量浓度>pH,模型回归F 值为 19.812 6,P=0.002 1(P<0.01),表明该模型极显著;多元相关系数R2=0.972 7,表明模型对试验实际情况拟合较好,通过软件求出回归模型的极值点,即最佳转化条件为转化温度为26.04℃,乙醇质量浓度为16.71 g/L,pH 5.11,产2-苯乙醇的理论最大值为3.55 g/L。为检验响应面法的可靠性,在最佳转化条件下进行验证试验,考虑到实际操作的方便,调整最佳培养条件为:转化温度为26℃,乙醇质量浓度为17 g/L,pH 5.1,在此条件下进行3次平行试验,2-苯乙醇平均产量达3.54 g/L,与理论预测值相近,说明响应用面法优化酿酒酵母静息细胞转化合成2-苯乙醇的转化条件是可行的。
2.7 静息细胞重复利用实验
与生长细胞相比,采用静息细胞转化最大的特点就是在于菌体细胞可以重复使用,在上述优化的转化条件下进行菌体重复利用实验,结果见图4。
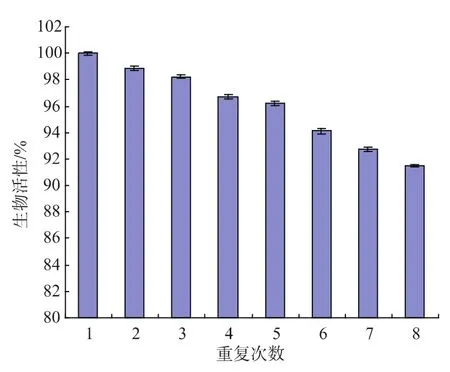
图4 静息细胞作为生物催化剂的重复利用Fig.4 Repeated utilization of resting cell as biocatalyst
静息细胞第1次平均转化合成2-苯乙醇产量为3.54 g/L,以第1次转化静息细胞的生物活性为100%计,前3次重复利用试验中,静息细胞的生物活性变化很小,均保持在98%以上,细胞重复使用第4次其活性开始下降,随后静息细胞的生物活性保持较平稳的状态,重复利用第8次,其生物活性仍达91.6%,表明在优化的转化条件下,静息细胞可以多次重复使用,2-苯乙醇产率无明显下降。
2.8 树脂对底物L-苯丙氨酸和产物2-苯乙醇的吸咐特征
从多种树脂(数据未列出)中筛选出对产物吸附容量较大,对底物吸附容量低的大孔树脂HZ816,表6为该树脂对底物和产物的吸附率。
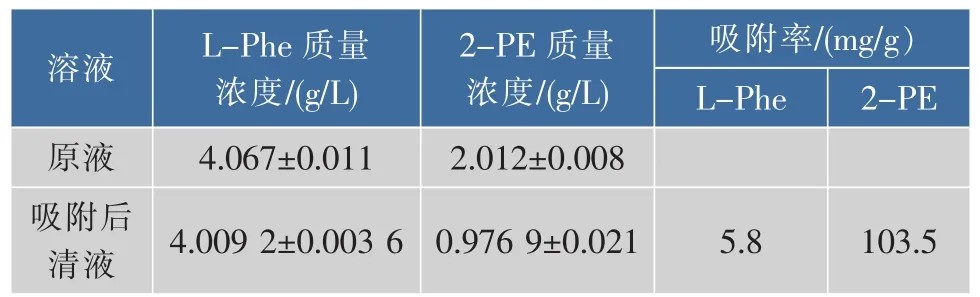
表6 HZ816树脂对L-苯丙氨酸和2-苯乙醇的静态吸附率Table 6 Static adsorption capability of L-Phe and 2-PE on HZ816
树脂HZ816对2-PE的吸附率为103.5 mg/g,对底物L-Phe的吸附率仅为5.8 mg/g,对产物的吸附量是底物的约18倍,是一种较理想的产物分离树脂。用10倍树脂体积的95%乙醇静态洗脱2-PE,洗脱液中 2-PE 量为(98.3±3.8) mg,2-PE 的洗脱率为95%。
2.9 大孔树脂提高静息细胞转化2-苯乙醇产量试验
在静息细胞转化液中加入10%大孔树脂,在最适转化条件下转化40 h,转化18 h补加底物L-Phe和辅酶辅助底物乙醇,实验设计和结果见表7。
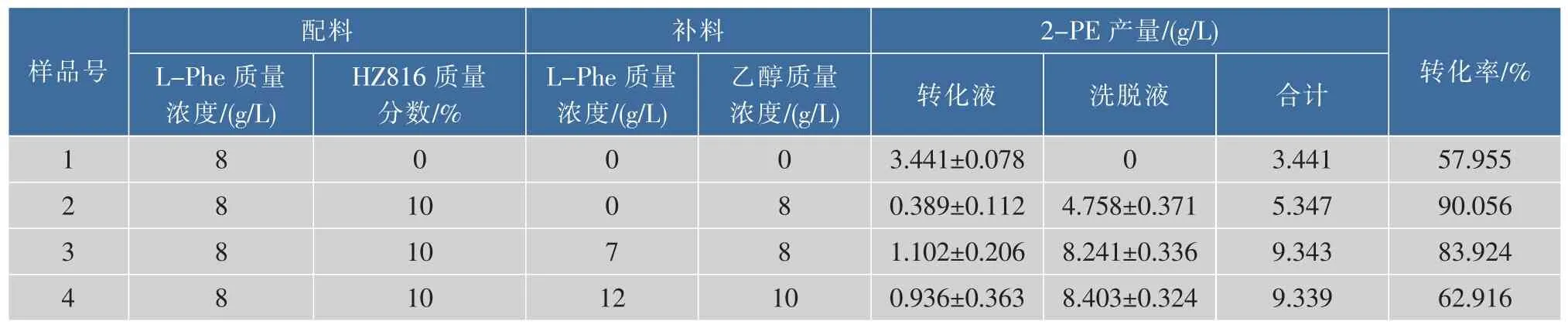
表7 大孔树脂HZ816对静息细胞转化合成2-PE产量的影响Table 7 Effect of macroporous resin HZ816 on 2-PE bioconversion by resting cell
在转化液中加入大孔树脂,可大大提高2-PE产量,转化液中2-苯乙醇质量浓度较低,大量的产物2-PE被吸附在树脂中。在L-Phe质量浓度为8 g/L时,加入树脂的转化液中2-PE产量提高55.4%,转化率达90%,树脂对2-PE的吸附率为82.4 mg/g,比其在水溶液中的吸附率(103.5 mg/g)低,这可能是高浓度的菌体降低了树脂对产物的吸附。提高底物质量浓度至15 g/L时,产量达9.34 g/L,比未加树脂产量提高171.5%,继续提高底物质量浓度,2-PE产量没有提高,这可能是树脂吸附已达饱和,需要进一步增加树脂的添加量。
3 结 语
通过酿酒酵母静息细胞转化合成2-苯乙醇,确定了培养20 h的菌体为制备静息细胞最适菌龄;0.1 mol/L的磷酸钾缓冲液有利于2-苯乙醇的合成;乙醇作为辅酶辅助底物可有效还原乙醇脱氢酶辅酶NAD为NADH,与糖类作为辅助底物相比,乙醇作为辅助底物便于后期产物的分离纯化。
通过Plackett-Burman设计法和响应面试验建立了酵母静息细胞转化条件的二次多项式模型,得到静息细胞最佳转化条件为:乙醇质量浓度为16.7 g/L,转化温度为 26℃,pH 5.1,2-苯乙醇产量为3.49 g/L,比优化前产量提高了49.1%。此外,静息细胞作为生物催化剂重复利用8次,其生物催化活性仍保持91.5%。在转化液中加入树脂进行产物原位转移,可大大提高2-苯乙醇产量,在底物质量浓度为15 g/L时,2-PE产量达9.34 g/L,底物转化率为83.9%,比未加树脂产量提高了171.5%。与生长细胞相比,静息细胞具有转化合成2-苯乙醇操作简便,无需在无菌条件下进行操作,转化液组成简单,细胞可多次重复使用,易于产业化,对未来工业应用有潜在的优势。
[1]LU Jian,LU Shaoming,MA Jifeng.Situation and development prospects of the β-phenylethanol[J].Guangdong Chemical Industry,2012,39(11):123-124.(in Chinese)
[2]YIN S,ZHOU H,XIAO X,et al.Improving 2-phenylethanol production via ehrlich pathway using genetic engineered Saccharomyces cerevisiae strains[J].Curr Microbiol,2015,70(5):762-767.
[3]KIM T Y,LEE S W,OH M K.Biosynthesis of 2-phenylethanol from glucose with genetically engineered Kluyveromycesmarxianus[J].Enzyme Microbial Technol,2014,61:44-47.
[4]ESHIOL N,SENDOVSKI M,BAHALUL M.et al.Production of 2-phenylethanol from L-phenylalanine by a stress tolerant Saccharomyces cerevisiae strain[J].Journal of Applied Microbiology,2009,106(2):534-542.
[5]STARK D,MUNCH T,SONNLEITNER B,et al.Extractive bioconversion of 2-phenylethanol from L-phenylalanine by Saccharomyces cerevisiae[J].Biotechnology Progress,2002,18(3):514-523.
[6]ETSCHMANN M M W,SCHRADER J.An aqueous-organic two-phase bioprocess for efficient production of the natural aroma chemicals 2-phenylethanol and 2-phenylethylacetate with yeast[J].Appl Microbiol Biotechnol,2006,71(12):440-443.
[7]LI Huijing,YU Weiting,DAI Xiaomin,et al.In situ product removal used in 2-phenylethanol production by microbial conversion[J].Chemical Industry and Engineering Progress,2012,31(3):633-638.(in Chinese)
[8]GUAN Ang,WANG Hang,MENG Chun,et al.Biosynthesis of 2-phenylethanol by Saccharomyces cerevisiae sp.strain with ISPR technology[J].The Chinese Journal of Process Engineering,2009,9(1):128-132.(in Chinese)
[9]RONG Shaofeng,FU Yanli,WANG Tao,et al.Research on the extraction of 2-phenylethanol in fermented broth by macroporous adsorption resin[J].Journal of Food Science and Biotechnology,2010,29(5):693-697.(in Chinese)
[10]YANG Dajiao,REN Tianbao,WANG Fengqin,et al.The research progress of resting cell fermentation production of industry[J].Food and Fermentation Industries,2013,39(8):187-191.(in Chinese)
[11]WANG Dan,ZHANG Qiang,LI Wang,et al.Asymmetric reduction of ethyl pyruvate catalyzed by yeast resting cells to (S)-ethyl lactate[J].Chinese Journal of Catalysis,2011,32(6):1035-1039.(in Chinese)
[12]ZHU Hongli,ZHANG Jia,SONG Jirong,et al.A study on microbial transformation of gastrodin by resting cell of Absidia coerulea[J].Journal of Northwest University:Natral Science Edition,2007,37(1):73-76.(in Chinese)
[13]LIU Fengli,MU Wanmeng,JIANG Bo,et al.The optimization of bioconversion conditions for the production of phenyllactic acid with resting cells[J].Science and Technology of Food Industry,2008,8(8):67-70.(in Chinese)
[14]PAN Xiaoxia,LI Jingjing,HE Wensen,et al.Cloning and expression of benzoylformate decarboxylase gene and study on biotransformation of ethyl vanillin by resting cell[J].Journal of Food Science and Biotechnology,2013,32(1):15-21.(in Chinese)
[15]TSUGE Y,KAWAGUCHI H,SASAKI K,et al.Two-step production of D-lactate from mixed sugars by growing and resting cells of metabolically engineered Lactobacillus plantarum[J].Appl Microbiol Biotechnol,2014,98:4911-4918.
[16]WANG Hang,DONG Qingfeng,MENG Chun,et al.Breeding for high-yield 2-phenylethanol strains of Saccharomyces cerevisiae[J].Journal of Fuzhou University:Natural Science,2010,38(1):153-156.(in Chinese)
[17]YANG Zhonghua,YAO Shanjing,XIA Haifeng,et al.Asymmetric reduction of 2-octanone to 2-octanol by yeast in aqueous phase[J].Journal of Chemical Industry and Engineering,2004,55(8):1301-1305.(in Chinese)
[18]ZHANG Chong,XING Xinhui.Research progress in cofactor regeneration systems[J].Chinese Journal of Biotechnology,2004,20(6):811-816.(in Chinese)
[19]RAVASIO D,WENDLAND J,WALTHER A.Major contribution of the Ehrlich pathway for 2-phenylethanol/rose flavor production in Ashbya gossypii[J].FEMS Yeast Res,2014,14:833-844.
[20]WANG Hang,MENG Chun,SHI XianAi,et al.Effects of 2-phenylethanol on physiological and biochemical characteristics of Saccharomyces cerevisiae[J].Microbiology China,2012,39(6):749-755.(in Chinese)
[21]DU Shan,WANG Xuehua,YANG Zhengmao,et al.Study on metabolic pathways of β-phenyl ethanol bioconversion and regulation[J].Food and Fermentation Industries,2014,40(1):168-172.(in Chinese)
