经导管3个水平胸椎旁阻滞预防乳腺癌术后疼痛综合征的疗效观察
2018-01-18陈利孙彩霞
陈利,孙彩霞
(江苏大学附属医院麻醉科,江苏镇江212001)
乳腺癌术后疼痛综合征(post-mastectomy pain syndrome,PMPS)是乳腺癌手术的常见并发症,表现为术后在手术或手术相关部位出现与切口愈合无关的慢性疼痛,可能为灼烧感、针刺样痛、触觉诱发痛或深部钝痛等[1-3]。PMPS曾不为临床重视,直到20世纪70年代,Wood[4]才首次报道。PMPS在手术治疗的乳腺癌患者中广泛存在,发生率为20%~80%[5-6],症状出现后持续3个月以上甚至多年,且难以治愈,给患者心理、生理等术后生活质量带来极大影响。
与PMPS相关的文献多为国外流行病学的调查以及长期跟踪随访等[7-9],国内对 PMPS的关注和研究有限。PMPS病因并未明确,现有资料显示PMPS症状严重的患者术中镇痛药的消耗量明显高于普通患者,术后急性疼痛程度也更严重[10-13]。许多研究提示[5,9],加强围术期的疼痛管理可能减轻PMPS症状的严重程度。
椎旁阻滞作为传统的区域阻滞方式,可有效改善乳腺癌和开胸手术后的急性疼痛,并降低手术后慢性疼痛的发生率[14-16]。但传统的胸椎旁阻滞方式失败率较高,达 6.1% ~20%[17-18],且气胸、血胸并发症较多,客观上限制了该法的推广。近年来,超声技术的发展为椎旁阻滞的应用提供了极大的便利,超声直视下行椎旁间隙穿刺大大提高了阻滞成功率并减少了并发症,使得椎旁阻滞再次成为研究热点。
国内椎旁阻滞用于乳腺癌的研究,多集中于术后镇痛和减轻全身麻醉并发症方面,而椎旁阻滞对PMPS的影响则未见报道。本研究拟尝试将Sundarathiti等[6]在2015年提出的经导管3个水平胸椎旁阻滞技术用于乳腺癌手术患者,观察该技术对术后急性疼痛、PMPS严重程度以及患者术后生活质量的影响,探寻该方法的推广价值。
1 对象与方法
1.1 病例及分组
经江苏大学附属医院伦理委员会批准,选择2015年10月至2016年9月于我院拟行乳腺癌改良根治术的患者为研究对象。
术前访视患者,向愿参加研究的患者和(或)家属告知以下内容:①研究者会在患者离开苏醒室时、术后4 h、8 h、12 h 4个围术期急性疼痛观察时点和术后3月、6月两个慢性疼痛观察时点共6个时间点采集数据,采集内容包括静息和运动时的VAS评分和3月、6月的简式McGill问卷(short-form McGill pain questionnaire,SF-MPQ)[10]评分;② 研究者会在术后3月和6月的前1周提醒患者,嘱其记录未来1周内的疼痛发生天数和疼痛部位作为PMPS的诊断依据。③疼痛评分采用VAS视觉模拟量表;生活质量评估采用SF-MPQ量表,内容主要包括对疼痛及疼痛导致不愉快情绪的评级,以此评估生活质量。研究者指导患者学会以上两种评分表的使用方法,并测量患者的血压、心率,作为术中参考的基础值。
患者纳入标准:初次行乳腺癌改良根治术、ASA分级Ⅰ~Ⅱ级、肝肾功能基本正常的女性病例(40~68岁)。排除标准:术前已有观察区慢性疼痛者,术前接受过放化疗者,既往有神经肌肉系统疾病者,胸椎旁阻滞禁忌者,有全麻或局麻药过敏者,既往有精神病史者。
本次研究共有55例符合标准的患者自愿参加,采用随机数字表法将患者分为两组。阻滞组行经导管3个水平胸椎旁阻滞联合喉罩全身麻醉;全麻组行标准的喉罩全身麻醉,最终有每组20例共40例患者完成全部数据的采集。两组基线资料间差异无统计学意义(P>0.05),具有可比性。见表1。

表1 两组患者基线资料比较¯x±s,n=20
1.2 麻醉方法
患者入室后建立外周静脉通路,连接心电图、指脉氧饱和度仪(SpO2),无创血压计监测生命体征,静滴咪达唑仑注射液1.5 mg、盐酸戊乙奎醚1 mg,5 min后依分组选用麻醉方案。
全麻组:行喉罩全麻。诱导采用丙泊酚1~2 mg/kg、舒芬太尼 0.4μg/kg、罗库溴铵 0.6 mg/kg,插入喉罩后连接麻醉机。呼吸参数设置:容量控制模式,潮气量 8~10 mL/kg,呼吸频率 10~12次/min。
阻滞组:行经导管3个水平胸椎旁阻滞。定位T3-T4胸椎节段后,在超声引导下依照Eason等[19]描述的胸椎旁阻滞操作方式,采用平面内或平面外技术,穿刺针针尖确认椎旁间隙后,给予5 mL生理盐水扩充壁层胸膜后间隙,置入8 cm硬膜外导管,之后分别在8、6和4 cm置管深度推注局麻药,每次10 mL 0.375%盐酸罗哌卡因,3次共30 mL。注药完毕后拔出硬膜外导管,消毒穿刺点以敷料贴固定,将患者转为平卧位。20~25 min后,用针刺法或温度法确认椎旁阻滞平面达第3胸椎水平且无不良反应后行全身麻醉,诱导和维持方式同全麻组。
两组患者术中均采用七氟醚维持麻醉,呼气末七氟醚浓度控制在1%~2%,间断给予顺式阿曲库铵维持肌松。当血压或心率大于基础值20%时追加舒芬太尼10μg。皮肤缝合结束时停止吸入七氟醚,转入麻醉苏醒室,后按苏醒室正常流程拔除喉罩并送回病房。
1.3 观察指标
1.3.1 疼痛评分 采用VAS量表记录患者离开苏醒室时、术后4 h、术后8 h、术后12 h、术后3月、术后6月共6个时间点的静息和运动时VAS评分。对于运动疼痛的定义是手术部位同侧上肢外展90°时的疼痛。
1.3.2 术中术后相关指标 术中舒芬太尼用量、喉罩拔除时间(停止七氟醚吸入至喉罩拔除的时间),术后24 h恶心、呕吐发生率。
1.3.3 SF-MPQ评分 记录患者 SF-MPQ评分,评估PMPS影响下的生活质量。
1.3.4 PMPS 提前1周提醒患者术后3个月和6个月需要进行数据采集,请患者记录之后1周内的疼痛发生部位、发生天数和疼痛评分。PMPS的诊断标准[11]:原手术部位、术侧手臂、腋窝出现与切口愈合无关的疼痛,且1周内至少出现4 d。
1.4 统计学处理
数据采集及统计分析分别采用Excel 2003及SPSS 19.0软件。计量数据以均值±标准差表示,采用单因素方差分析、t检验;采用Spearman秩相关分析急性与慢性疼痛的VAS评分相关性,组间率的比较采用卡方检验或矫正卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 术中及术后相关指标比较
与全麻组比较,阻滞组患者喉罩拔除时间明显提前,术中舒芬太尼用量显著降低(均P<0.05);但两组患者术后恶心、呕吐发生率差异无统计学意义(P>0.05)。见表 2。
2.2 围术期疼痛评分比较
两组患者术后4 h运动时、术后8 h静息时VAS评分无统计学差异(P>0.05);其余围术期观察点阻滞组VAS评分均优于全麻组,差异有统计学意义(P<0.05)。见表 3。
2.3 术后3月、6月疼痛评分比较
除术后3月静息时两组患者VAS评分无显著差异(P>0.05)外,在3月、6月其余观察点阻滞组VAS评分均明显低于全麻组(均P<0.05)。见表4。
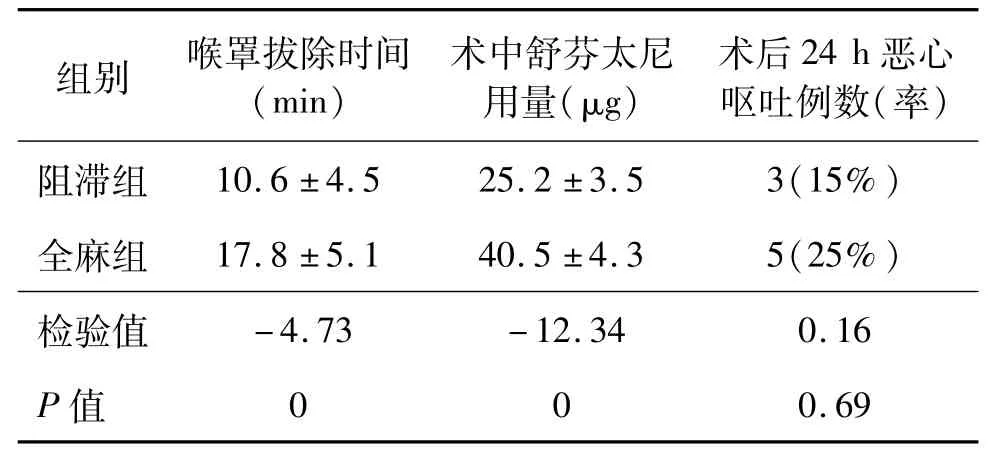
表2 两组喉罩拔除时间、舒芬太尼用量和术后不良反应n=20,¯x±s
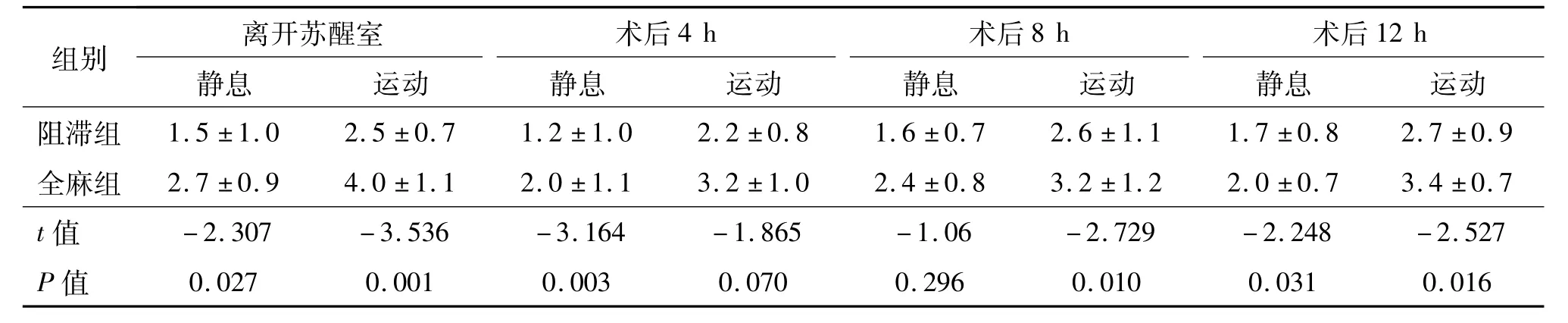
表3 两组术后围术期疼痛VAS评分比较¯x±s,n=20,分

表4 两组患者术后3月、6月的VAS评分比较¯x±s,n=20,分
2.4 PMPS疼痛发生部位和发生率
术后3月和6月时两组患者的慢性疼痛可出现在手术切口部位、手术同侧腋窝、手术同侧上臂,具体见表5;术后3月时阻滞组PMPS发生率为50%(10/20),全麻组为 60%(12/20);6个月时阻滞组为35%(7/20),全麻组为 45%(9/20)。两组患者PMPS发生率无统计学差异(3个月 χ2=0.4,6个月时,χ2=0.42,均P>0.05)。
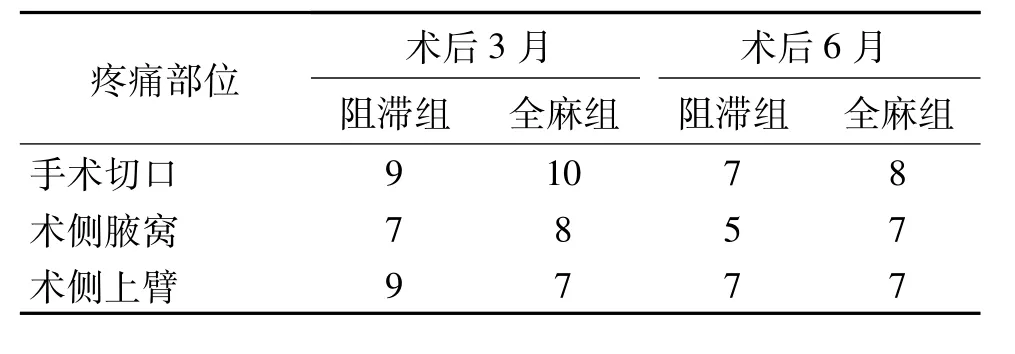
表5 两组3月和6月时慢性疼痛发生部位 例
2.5 急性疼痛与慢性疼痛的VAS评分相关性
Spearman相关性检验显示,全麻组各急性疼痛观察时点与3月、6月时VAS评分均有相关性(P<0.05);阻滞组除了术后4 h、术后8 h与6月时VAS评分无相关性外(P>0.05),其他急性疼痛观察时点与3月、6月时 VAS评分均相关(P<0.05)。见表6、表7。
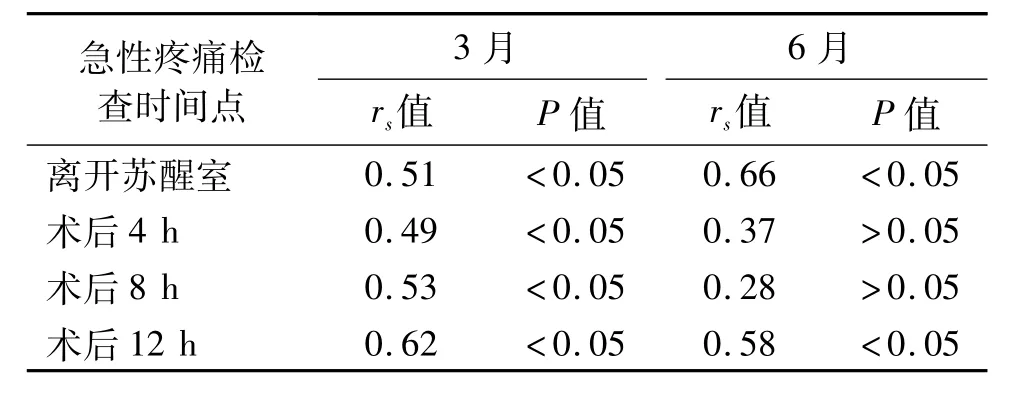
表6 阻滞组急性与慢性疼痛VAS评分相关性
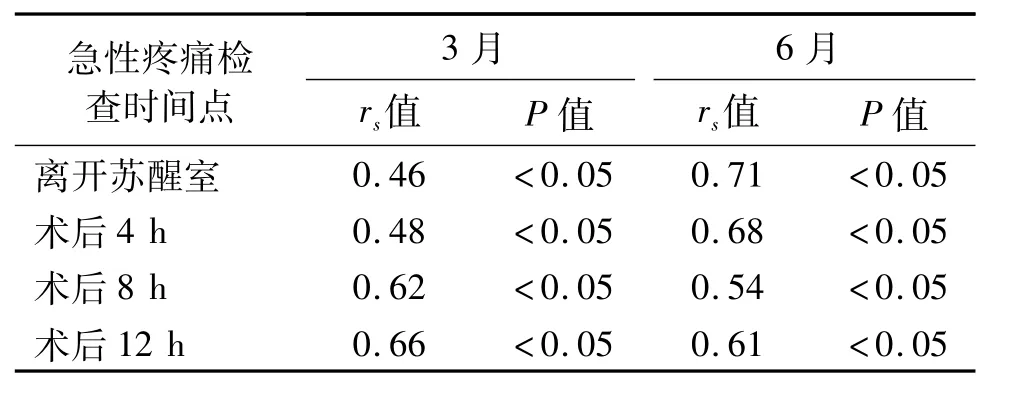
表7 全麻组急性与慢性疼痛VAS评分相关性
2.6 生活质量比较
阻滞组SF-MPQ评分在3月和6月时均明显低于全麻组(均P<0.05),提示阻滞组患者疼痛症状较轻,PMPS对阻滞组患者生活质量影响较小。见表8。

表8 简式M cGill问卷得分对比n=20,¯x±s,分
3 讨论
乳癌术后慢性疼痛的发生机制尚未明确,现有观点认为,乳腺癌手术过程和术后放疗引起的神经损伤和炎症导致了慢性疼痛,同时慢性疼痛的发生与患者自身条件也有关系。
国外现有的调查随访显示,PMPS症状严重的患者一般当初术后急性疼痛程度较严重,术中或术后的镇痛药消耗高于普通患者[7,12-13]。这一现象为我们干预PMPS指出了一个可行的方向——加强急性疼痛的管理对于治疗PMPS有着重要意义。许多研究也已提示区域阻滞可降低开胸和乳腺癌手术后的慢性疼痛发生率,胸椎旁阻滞作为一种经典的胸部区域麻醉方式,可能在乳腺术后慢性疼痛干预方面有着潜在的应用价值。
本研究借鉴了Sundarathiti等[6]的经验,将经导管3个水平胸椎旁阻滞技术用于乳癌改良根治术患者的麻醉。为获得满意麻醉效果,操作中需确保导管被置入椎旁间隙不同深度。为此,本研究中所有阻滞操作过程包括穿透肋横突韧带、置入导管、注射局麻药等均在超声引导下进行,阻滞组置管操作均较顺利且未发现导管迂曲打折,通过观察局麻药成像也证实导管置入不同水平椎旁间隙。另外,阻滞组镇痛效果良好且未发现气胸、硬膜外阻滞等并发症,也间接证明导管位置正确。本研究结果显示,经导管3个水平椎旁阻滞联合喉罩全麻用于乳腺癌改良根治术,不但可减轻术后急性疼痛,减少术中阿片类药物用量、缩短术毕拔管时间,更重要的是显著减轻了患者3个月和6个月时的PMPS症状,提升了患者生活质量;同时提示术后急性疼痛评分是发生PMPS的危险因素之一;另外,两组患者PMPS的发生率无显著差异,与国外报道相符[5,12,16]。这提示我们,椎旁阻滞虽可缓解PMPS症状,但PMPS的发病机制是多因素的,单纯依靠加强术后急性期疼痛管理还不够。限于患者数量较少及观察期较短,本文的统计分析结果有一定局限性,我们将继续跟踪调查上述病例,同时进一步积累病例数。
综上所述,经导管3个水平胸椎旁阻滞联合喉罩全麻可安全有效地用于乳腺癌改良根治术,并在改善术后急性镇痛、降低阿片类药物消耗、缩短手术拔管时间、减轻PMPS严重程度方面有着较高的应用价值,值得临床推广。
[1]Couceiro TC,Valença MM,Raposo MC,et al.Prevalence of post-mastectomy pain syndrome and associated risk factors:a cross-sectional cohort study[J].Pain Manag Nurs,2014,15(4):731-737.
[2]Macdonald L,Bruce J,ScottNW,etal.Long-term followup of breast cancer survivors with post-mastectomy pain syndrome[J].Br JCancer,2005,92(2):225-230.
[3]Shahbazi R,Akbari ME,Hashemian M,et al.High bodymass index and young age are not associated with post-mastectomy pain syndrome in breast cancer survivors:a case-control study[J].Iran J Cancer Prev,2015,8(1):29-35.
[4]Wood K.Intercostobrachial nerve entrapment syndrome[J].South Med J,1978,71(6):662-663.
[5]Karmakar MK,Samy W,Li JW,et al.Thoracic paravertebral block and its effects on chronic pain and health-related quality of life after modified radical mastectomy[J].Reg Anesth Pain Med,2014,39(4):289-298.
[6]Sundarathiti P,von Bormann B,Suvikapakornkul R,et al.Paravertebral catheter for three-level injection in radicalmastectomy:a randomized controlled study[J].PLoS One,2015,10(6):e0129539.
[7]Wallace MS,Wallace AM,Lee J,et al.Pain after breast surgery:a survey of282 women[J].Pain,1996,66(2/3):195-205.
[8]Wilder-Smith OH.Chronic pain and surgery:a review of new insights from sensory testing[J].J Pain Palliat Care Pharmacother,2011,25(2):146-159.
[9]Andreae MH,Andreae DA.Local anaesthetics and regional anaesthesia for preventing chronic pain after surgery[J].Cochrane Database Syst Rev,2012,10:CD007105.
[10]Choi SA,Son C,Lee JH,et al.Confirmatory factor analysis of the Korean version of the short-form McGill pain questionnairewith chronic pain patients:a comparison of alternative models[J].Health Qual Life Outcomes,2015,13:15.
[11]Kojima KY,Kitahara M,Matoba M,et al.Survey on recognition of post-mastectomy pain syndrome by breast specialist physician and present status of treatment in Japan[J].Breast Cancer,2014,21(2):191-197.
[12]Boezaart AP,Raw RW.Continuous thoracic paravertebral block formajor breast surgery[J].Reg Anesth Pain Med,2006,31(5):470-476.
[13]Schreiber KL,Martel MO,Shnol H,et al.Persistent pain in postmastectomy patients:comparison of psychophysical,medical,surgical,and psychosocial characteristics between patients with and without pain[J].Pain,2013,154(5):660-668.
[14]Kotake Y,Matsumoto M,Morisaki H,et al.The effectiveness of continuous epidural infusion of low-dose fentanyl and mepivacaine in perioperative analgesia and hemodynamic control in mastectomy patients[J].J Clin Anesth,2004,16(2):88-91.
[15]Kairaluoma PM,Bachmann MS,Korpinen AK,et al.Single-injection paravertebral block before general anesthesia enhances analgesia after breast cancer surgerywith and without associated lymph node biopsy[J].Anesth Analg,2004,99(6):1837-1843.
[16]Naja MZ,Ziade MF,Lönnqvist PA.Nerve-stimulator guided paravertebral blockade vs.general anaesthesia for breast surgery:a prospective randomized trial[J].Eur J Anaesthesiol,2003,20(11):897-903.
[17]Lönnqvist PA,MacKenzie J,Soni AK,et al.Paravertebral blockade:Failure rate and complications[J].Anaesthesia,1995,50(9):813-815.
[18]Naja Z,Lönnqvist PA.Somatic paravertebral nerve blockade.Incidence of failed block and complications[J].Anaesthesia,2001,56(12):1184-1188.
[19]Eason MJ,Wyatt R.Paravertebral thoracic block:a reappraisal[J].Anaesthesia,1979,34(7):638-642.
