rL-RVG通过拮抗α7烟碱型乙酰胆碱受体影响胃癌细胞凋亡及增殖
2018-01-18尹超云严玉兰章安伟张烜烽步雪峰
尹超云,严玉兰,章安伟,张烜烽,步雪峰
(1.江苏大学医学院,江苏镇江212013;2.江苏大学附属人民医院普外科,江苏镇江212002;3.江苏大学附属人民医院呼吸内科,江苏 镇江212002)
乙酰胆碱受体在很多肿瘤细胞中高度表达,如非小细胞肺癌、胃癌、膀胱癌、大肠癌等[1]。研究发现α7烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7-nAChR)的表达与激活对肿瘤细胞的增殖、侵袭、转移[2],血管生成[3]和炎症反应[4]具有重要影响。尼古丁等药物可通过激活乙酰胆碱受体促进胃癌细胞增殖及转移[5];5-氟尿嘧啶可抑制α7-nAChR表达,发挥抗肿瘤作用[6]。新城疫病毒(newcastle disease virus,NDV)是一种以感染禽类为特点的鸡瘟病毒[7],属于禽副黏病毒科的副黏病毒Ⅰ型[8]。有研究发现NDV病毒、脊髓灰质炎病毒、腺病毒、狂犬病毒等多种病毒具有溶瘤作用[9-10]。烟碱型乙酰胆碱受体可与狂犬病毒糖蛋白(rabies virus glycoprotein,RVG)结合[11],且 RVG的 G蛋白具有与银环蛇毒相近的烟碱型乙酰胆碱受体阻断作用[12]。重组 LaSota株新城疫病毒(recombinant La-Sota strain NDV expressing the rabies virus glycoprotein,rL-RVG)可以稳定表达 RVG[13],关于 rL-RVG是否可以通过拮抗乙酰胆碱途径影响胃癌HGC细胞凋亡及增殖尚不清楚。本实验采用rL-RVG感染HGC细胞,旨在探索细胞凋亡及增殖与乙酰胆碱途径之间的关系。
1 材料与方法
1.1 材料
RPMI 1640培养基(Gibco公司),胎牛血清(HyClone公司)。人胃癌HGC细胞由中国科学院上海生科院细胞资源中心提供,NDV病毒株及rLRVG病毒株由哈尔滨兽医研究所馈赠。Tris缓冲液(0.05 mol/L TBS,pH=7.35,自制);羊抗兔 α7-nAChR抗体(南京厚载公司);羊抗兔pro-caspase 3抗体(ImmunoWay公司)。核荧光染料(Hoechst 33342),Triton X-100、MTT试剂盒(Sigma公司)。HRP标记羊抗兔IgG、羊抗鼠IgG(上海康为世纪公司)。α7-nAChR抑制剂甲基牛扁亭碱为Santa Cruz公司产品,α7-nAChR激动剂溴化乙酰胆碱(Sigma公司);Alexa Flour 488标记羊抗鼠IgG、Cy3标记羊抗鼠IgG(美国KLP公司),DFC300 FX荧光显微镜(德国莱卡公司)。
1.2 细胞培养和病毒感染
将NDV、rL-RVG病毒原液用未加血清的1640培养基稀释1 000倍。用含10%灭活胎牛血清的1640培养基在37℃及5%CO2的饱和湿度下培养HGC细胞,每隔24 h更换含10%胎牛血清的培养基,当细胞在培养瓶中覆盖率达80%时进行传代培养。传3代后将细胞接种于6孔板中,待细胞达到50%~70%融合时,将其随机分为rL-RVG组、NDV组及PBS组,分别加入上述稀释的rL-RVG、NDV病毒液及PBS 2 mL,培养1 h,再更换含10%胎牛血清的培养基继续培养24 h。
1.3 MTT检测rL-RVG对HGC细胞增殖的影响
用无血清1640培养基分别将rL-RVG及NDV病毒原液稀释至以下浓度:10-1、10-2、10-3、10-4、10-5mmol/L。将HGC细胞接种于96孔板(5×104/mL),每孔100μL,培养过夜,次日换含20 mL/L胎牛血清的1640培养基,在rL-RVG组和NDV组分别加入病毒液,PBS组加入PBS;每组设5个平行孔,1640完全培养基为调零孔。培养24 h,每孔加入20 μLMTT,培养4 h,每孔加入150μL二甲基亚砜溶解,酶标仪490 nm测定光密度(D)值,实验重复3次,计算细胞活力值=(实验组平均D值/对照组平均D值)×100%。
1.4 免疫荧光染色观察HGC细胞中α7-nAChR的表达
取rL-RVG、NDV、PBS 3组细胞,分别使用4%低聚甲醛在室温下固定20 min,PBS洗3次,PBS稀释的0.5%Triton X100室温下处理细胞30 min,PBS洗3遍,5%的BSA封闭1 h,加入PBS溶解的α7-nAChR抗体(1∶100),4℃孵育过夜。洗3次,5 min/次;Cy3标记的兔二抗(1∶200)染色1 h,PBS洗3次,5 min/次;Hoechst 33342染色细胞核 10 min,PBS洗3次后再置于荧光显微镜下观察。
1.5 rL-RVG感染后的细胞形态学变化
将HGC细胞接种至6孔板培养,分为rL-RVG+α7-nAChR抑制剂组、NDV+α7-nAChR抑制剂组、PBS+α7-nAChR抑制剂组,rL-RVG组、NDV组、PBS组,rL-RVG+α7-nAChR激动剂组、NDV+α7-nAChR激动剂组、PBS+α7-nAChR激动剂组。当细胞生长至50%~70%密度时,各抑制剂组加入10-3mmol/L的甲基牛扁亭碱预处理4 h,各激动剂组加入10-3mmol/L的溴化乙酰胆碱预处理4 h;弃培养基,PBS洗 2遍;然后 rL-RVG组、rL-RVG+α7-nAChR抑制剂组、rL-RVG+α7-nAChR激动剂组感染rL-RVG;NDV组、NDV+α7-nAChR抑制剂组、NDV+α7-nAChR激动剂组感染NDV,PBS组、PBS+α7-nAChR抑制剂组、PBS+α7-nAChR激动剂组直接用PBS处理。倒置显微镜下观察受病毒感染的细胞形态。
1.6 蛋白质印迹法检测 RVG、NDV、pro-caspase 3、bax、bcl-2、α7-nAChR蛋白的相对表达
将方法“1.2”及“1.5”中经过处理的 HGC细胞种植于6孔板上(5×104个/mL),培养24 h后提取细胞蛋白,后经SDS-PAGE转膜;5%脱脂奶粉封闭1 h,分别加入小鼠抗RVG抗体(1∶300)、鸡抗NDV抗体(1∶300)、羊抗兔 pro-caspase 3抗体(1∶1 000)、羊抗兔 α7-nAChR抗体(1∶500)、羊抗兔 bax抗体(1∶400)、羊抗兔 bcl-2抗体(1∶400)、羊抗鼠β-肌动蛋白抗体(1∶5 000),4℃孵育过夜;TBST洗3次,加羊抗鼠或羊抗兔 HRP标记 IgG(1∶3 000)室温孵育1 h;TBST洗膜3次,ECL发光剂发光显色,在Typhoon 9400扫描仪上扫描记录,用LANE.1D软件(北京赛制公司)进行条带灰度值结果分析。
1.7 统计学处理
应用GraphPad Prism 6软件进行数据处理,数据以均数±标准差(±s)表示,两组比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 rL-RVG对 HGC细胞RVG、NDV、pro-caspase 3与α7-nAChR蛋白表达的影响
蛋白质印迹结果显示,与PBS组及NDV组比较,RVG蛋白在rL-RVG组中显著性表达(P均<0.01);与 PBS组比较,NDV、pro-caspase 3和 α7-nAChR蛋白在rL-RVG组及NDV组中的表达均明显升高(P均<0.01);rL-RVG组与NDV组NDV蛋白表达差异无统计学意义(P>0.05);rL-RVG组α7-nAChR、pro-caspase3蛋白表达明显高于NDV组(P均<0.01)。见图1。
2.2 rL-RVG对HGC细胞增殖的影响
MTT检测结果显示,不同浓度NDV和rL-RVG作用HGC细胞24 h后,细胞活力值随浓度增加而降低。与PBS对照组相比,各稀释浓度rL-RVG及NDV对细胞的增殖均有明显抑制作用(P<0.05)。见图2。
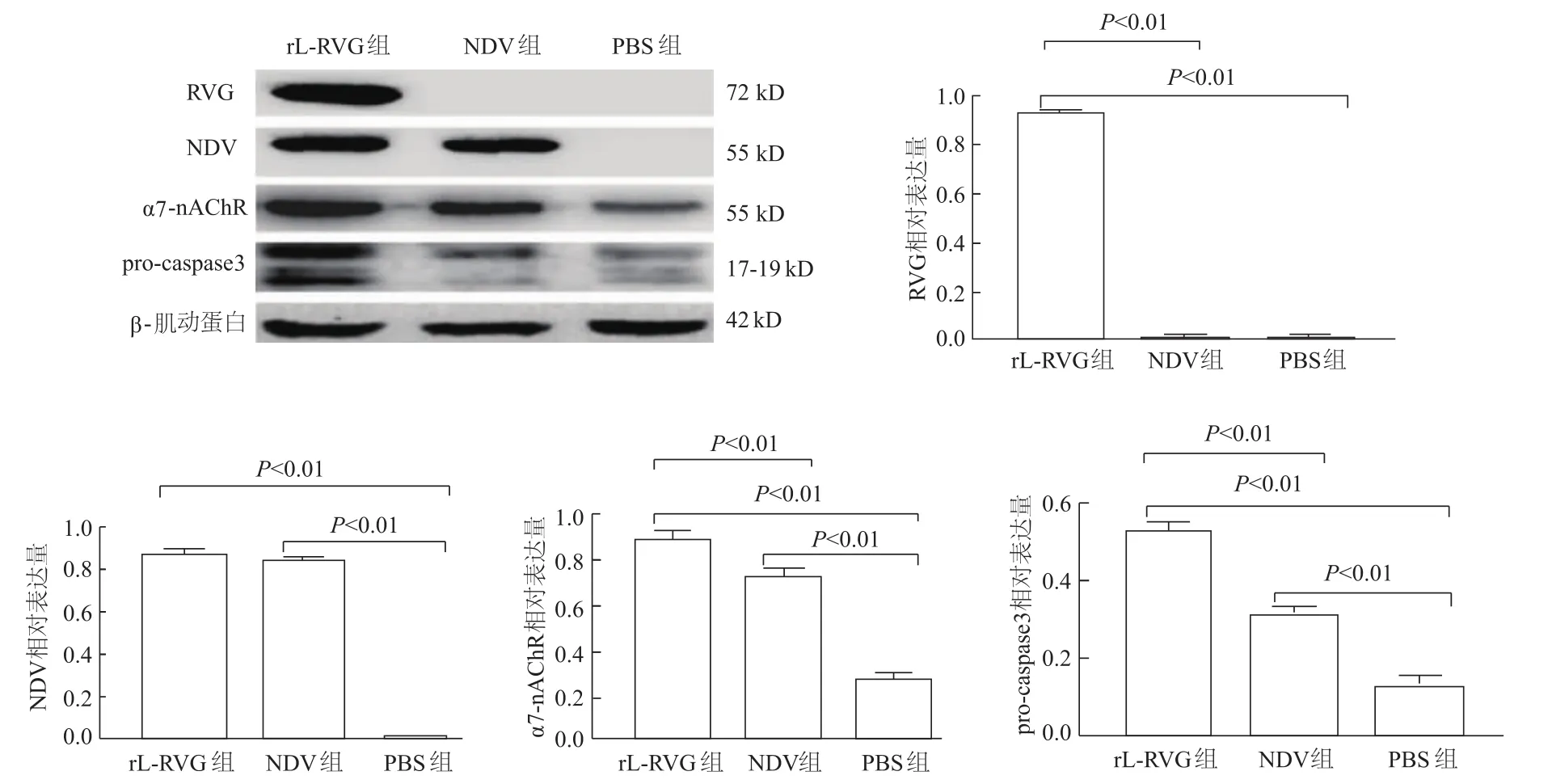
图1 HGC细胞感染rL-RVG后RVG、NDV、pro-caspase 3和α7-nAChR蛋白的表达
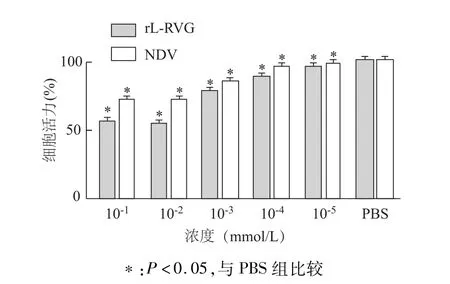
图2 不同浓度NDV、rL-RVG病毒对胃癌HGC细胞增殖的影响
2.3 rL-RVG感染后HGC细胞α7-nAChR蛋白的荧光表达
免疫荧光染色结果显示,rL-RVG组HGC细胞α7-nAChR的表达明显高于NDV组及PBS组,NDV组高于PBS组(图3)。
2.4 rL-RVG感染后细胞形态学的变化
各组细胞经相应处理24 h后倒置显微镜下可见,细胞逐渐由贴壁生长状态转为悬浮生长状态,细胞膜皱缩,凋亡增多。rL-RVG组较NDV明显;α7-nAChR抑制剂处理过的 NDV组、PBS组分别较NDV组、PBS组明显,但rL-RVG+α7-nAChR抑制剂组与rL-RVG组差别不大;经α7-nAChR激动剂处理过的rL-RVG组、NDV组和PBS组分别较rL-RVG组、NDV组和PBS组细胞膜明显皱缩,凋亡状态明显减弱。见图4。
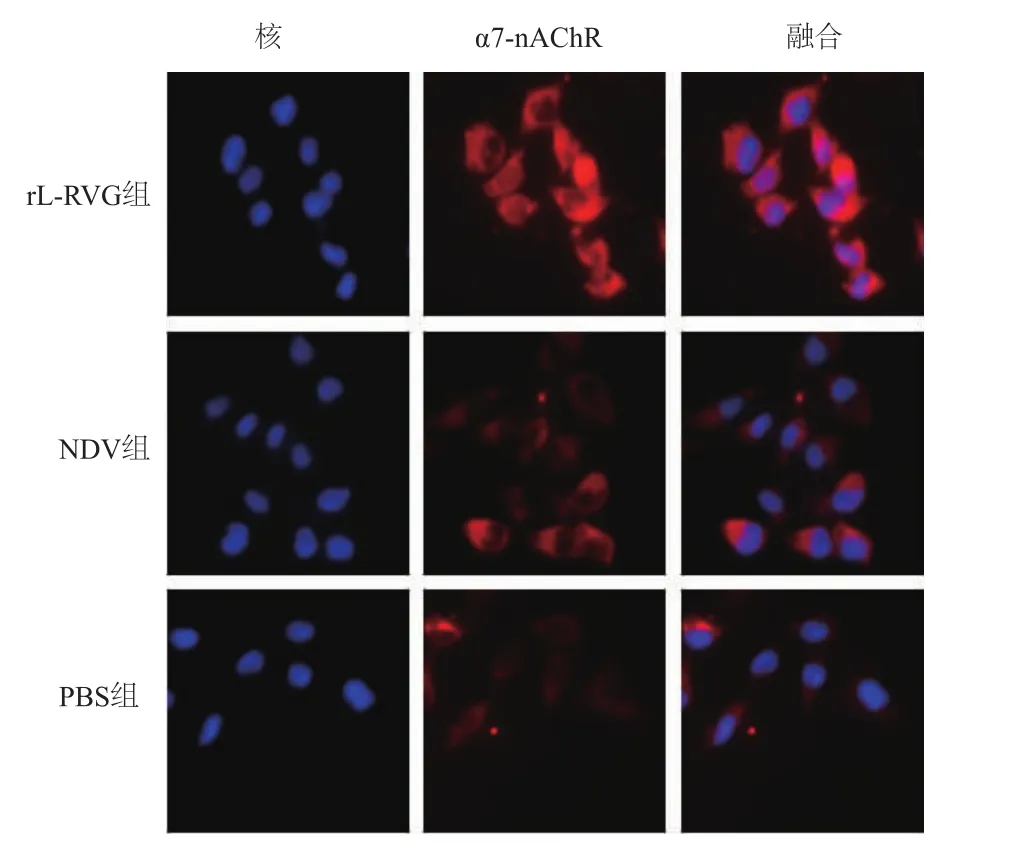
图3 rL-RVG感染后HGC细胞α7-nAChR蛋白表达(荧光显微镜×1 000)
2.5 rL-RVG感染后 HGC细胞 pro-caspase 3、bax、bcl-2的相对表达量
蛋白质印迹结果显示,rL-RVG组和NDV组pro-caspase 3、bax表达明显高于 PBS组(P均<0.01)。
pro-caspase3、bax蛋白在 NDV+α7-nAChR抑制剂组、PBS+α7-nAChR抑制剂组分别较NDV组、PBS组明显提高(P均<0.01),在 rL-RVG+α7-nAChR抑制剂组与rL-RVG组间无明显差异(P>0.05);bcl-2蛋白在NDV+α7-nAChR抑制剂组、PBS+α7-nAChR抑制剂组表达量分别明显低于NDV组、PBS组(P均<0.01),在rL-RVG+α7-nAChR抑制剂组与rL-RVG组间无明显差异(P>0.05)。
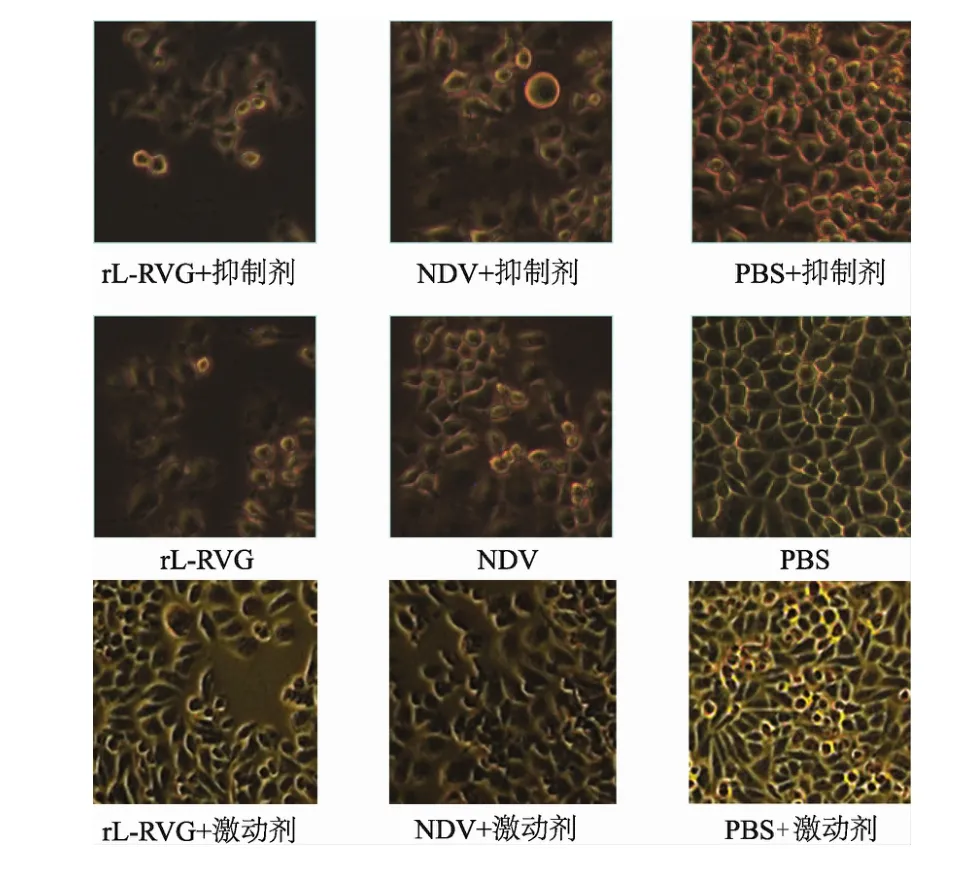
图4 rL-RVG感染后HGC细胞的形态学变化(倒置显微镜×1 000)
pro-caspase3、bax蛋白在 rL-RVG+α7-nAChR激动剂组表达显著低于rL-RVG组(P<0.05或P<0.01),而NDV+α7-nAChR激动剂组的表达量明显低于NDV组(P均<0.01)。bcl-2蛋白在 rL-RVG+α7-nAChR激动剂组表达显著低于rL-RVG组(P<0.05),而 NDV+α7-nAChR激动剂组的表达量明显高于NDV组(P<0.01)。见图5。
3 讨论
胃癌细胞中广泛表达α7-nAChR,α7-nAChR参与肿瘤的侵袭、增殖和转移[4]。rL-RVG稳定表达的RVG可与烟碱型乙酰胆碱受体结合,对其具有阻断作用[11-13],所以我们猜测rL-RVG可以通过拮抗α7-nAChR受体促进胃癌细胞凋亡及抑制胃癌细胞增殖。
本研究MTT试验显示,当病毒浓度接近于10-5mmol/L时,rL-RVG、NDV组的细胞活力明显受到抑制。同时免疫荧光及蛋白质印迹证实胃癌细胞稳定表达α7-nAChR,加入rL-RVG病毒后α7-nAChR蛋白表达明显提高。α7-nAChR表达升高应该会抑制肿瘤细胞凋亡[6],但凋亡蛋白及光镜下形态学结果显示rL-RVG作用后HGC细胞凋亡增多。rL-RVG感染HGC细胞产生的RVG的G蛋白竞争性抑制了α7-nAChR,进一步促进HGC细胞凋亡,从α7-nAChR免疫荧光及蛋白质印迹可以看出,RVG的G蛋白对α7-nAChR有拮抗作用,引起α7-nAChR反馈性上调。而且蛋白质印迹结果显示,α7-nAChR抑制剂作用HGC细胞24 h后,pro-caspase 3及bax表达量与rL-RVG组无明显差异,说明rL-RVG本身产生的RVG产生同样的效果。但NDV及PBS组加入抑制剂后其表达量增多,证明了α7-nAChR抑制剂可以促进胃癌细胞凋亡,这与本课题组的前期实验相符[10]。
同时,α7-nAChR激动剂加入rL-RVG组和NDV组后pro-caspase 3及bax蛋白表达受到明显抑制,进一步证实rL-RVG感染HGC通过拮抗α7-nAChR途径促进胃癌细胞的凋亡和抑制其增殖。
本实验是对rL-RVG杀肿瘤作用理论的补充,为rL-RVG在临床上治疗肿瘤晚期患者提供了一定实验基础。关于rL-RVG通过烟碱型乙酰胆碱受体作用哪些途径导致HGC细胞凋亡还需进一步探索。
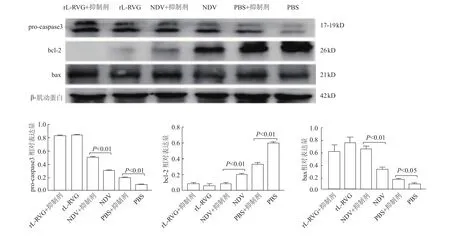
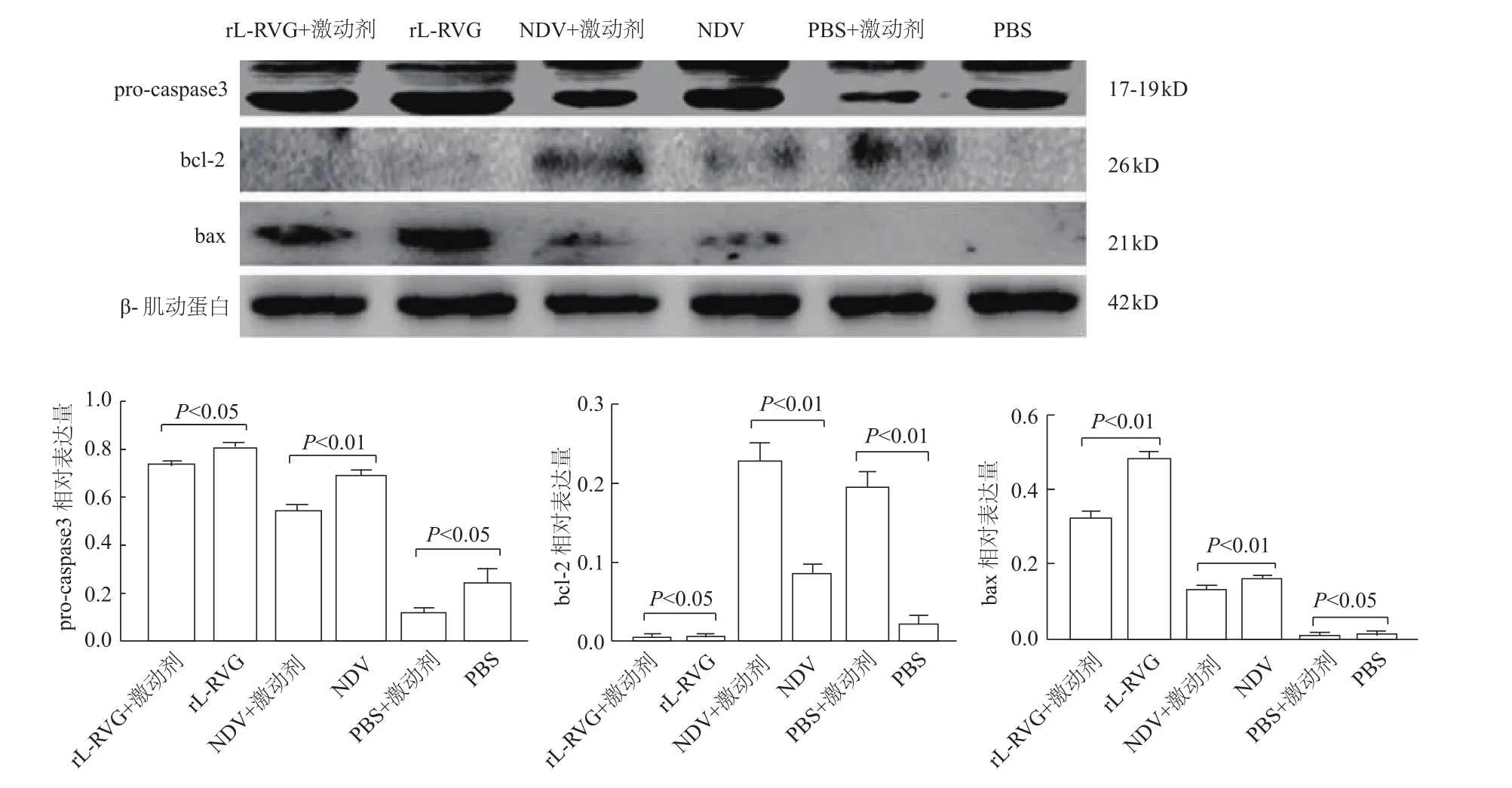
图5 rL-RVG感染后HGC细胞凋亡相关蛋白的表达
[1]Alexander DJ.Gordon Memorial Lecture.Newcastle disease[J].Br Poult Sci,2001,42(1):5-22.
[2]Mayo MA.A summary of taxonomic changes recently approved by ICTV[J].Arch Virol,2002,147(8):1655-1663.
[3]Jin CY,Park C,Hwang HJ,et al.Naringenin up-regulates the expression of death receptor 5 and enhances TRAIL-induced apoptosis in human lung cancer A549 cells[J].Mol Nutr Food Res,2011,55(2):300-309.
[4]Zhao J,Lu Y,Shen HM,et al.Targeting p53 as a therapeutic strategy in sensitizing TRAIL-induced apoptosis in cancer cells[J].Cancer Lett,2012,314(1):8-23.
[5]Tu CC,Huang CY,Cheng WL,et al.Silencing A7-nAChR levels increases the sensitivity of gastric cancer cells to ixabepilone treatment[J].Tumour Biol,2016,37(7):9493-9501.
[6]Dasgupta P,Rizwani W,Pillai S,et al.Nicotine induces cell proliferation,invasion and epithelial-mesenchymal transition in a variety of human cancer cell lines[J].Int JCancer,2009,124(1):36-45.
[7]Heeschen C,Weis M,Aicher A,et al.A novel angiogenic pathway mediated by non-neuronal nicotinic acetylcholine receptors[J].JClin Invest,2002,110(4):527-536.
[8]Pavlov VA,Wang H,Czura CJ,et al.The cholinergic anti-inflammatory pathway:a missing link in neuroimmunomodulation.[J].Mol Med,2003,9(5-8):125-134.
[9]Ge J,Wang X,Tao L,et al.Newcastle disease virus-vectored rabies vaccine is safe,highly immunogenic,and provides long-lasting protection in dogs and cats[J].J Virol,2011,85(16):8241-8252.
[10]赵英海,严玉兰,李米,等.重组新城疫病毒 rL-RVG诱导人胃腺癌细胞内质网应激和凋亡[J].江苏大学学报(医学版),2016,26(3):199-203.
[11]Gastka M,Horvath J,Lentz TL.Rabies virus binding to the nicotinic acetylcholine receptorαsubunit demonstrated by virus overlay protein binding assay[J].J Gen Virol,1996,77(Pt10):2437-2440.
[12]Mai H,MayWS,Gao F,etal.A functional role for nicotine in Bcl-2 phosphorylation and supression of apoptosis[J].JBiol Chem,2003,278(3):1886-1891.
[13]Lentz TL,Burrage TG,Smith AL,et al.Is the acetylcholine receptor a rabies virus receptor?[J].Science,1982,215(4529):182-184.
