皮肤桥蛋白在肥胖小鼠脂肪中的表达
2018-01-18白宁宁严寒琚丽萍陈淑芹张菁胡瑞玮杨颖方启晨
白宁宁,严寒,琚丽萍,陈淑芹,张菁,胡瑞玮,杨颖,方启晨
(上海交通大学附属第六人民医院糖尿病研究所,上海200233)
脂肪组织的细胞外基质(extracellular matrix,ECM)是存在于细胞之间的致密动态网络结构,主要由血管基质细胞(stromal vascular fraction,SVF)和脂肪细胞合成和分泌,不仅为脂肪组织提供结构支撑,还可通过各种细胞外信号途径,在生理和病理条件下调节脂肪组织重构[1]。ECM由多种成分组成,其中很大比例是各种类型的胶原蛋白,比如Ⅰ-Ⅳ型胶原蛋白[2]。此外,还存在许多非胶原蛋白,动态调节组织结构与功能。
皮肤桥蛋白(dermatopontin,DPT)是一种相对分子质量为22 kD的分泌性蛋白,最初在提纯牛皮肤核心蛋白多糖的实验中被发现[3]。DPT在ECM非胶原蛋白中所占比例非常高,在哺乳动物皮肤、骨骼肌、心脏、肺、肝等组织和器官中广泛表达[4],其部分酪氨酸残基可被硫酸化,硫酸化的酪氨酸可以调节ECM蛋白间的相互作用[5]。我们在实验中发现DPT在人和小鼠脂肪中的基础表达很高,但目前尚不明确DPT作为一种非胶原蛋白在脂肪组织中的作用。另外,抗糖尿病药物过氧化物酶体增殖物激活受体-γ(PPARγ)激动剂可通过抑制脂肪细胞和巨噬细胞中胶原蛋白的转录,从而发挥潜在的抗纤维化作用[6],但它对非胶原蛋白DPT基因表达的影响报道甚少。本研究拟在饮食诱导肥胖小鼠模型上观察DPT在脂肪组织中的表达变化,以及PPARγ激动剂罗格列酮干预后3T3-L1分化成熟的脂肪细胞DPT基因的变化趋势,为进一步探讨DPT在肥胖等代谢性疾病中的作用机制奠定基础。
1 材料与方法
1.1 主要材料
35只6周龄雄性C57BL/6J小鼠(上海斯莱克实验动物有限公司),普通饲料和高脂饲料(Diet Research公司),3T3-L1细胞株(ATCC细胞库),DMEM培养基、胎牛血清(Gibco公司),罗格列酮、地塞米松、3-异丁基-1-甲基黄嘌呤、胶原酶(Sigma公司),胰岛素(常规优泌林),Trizol试剂(Invitrogen公司),RIPA裂解液、蛋白酶抑制剂PMSF和BCA蛋白定量试剂盒(上海碧云天公司),引物(上海生物工程有限公司),逆转录和SYBR Premix Ex Taq(TaKaRa公司),鼠源性DPT单克隆抗体(Santa公司),兔源性HSP90多克隆抗体作为内参抗体(Abcam公司)。
1.2 方法
1.2.1 饮食诱导肥胖小鼠模型的建立 6周龄C57BL/6J雄性小鼠适应性喂养2周后,随机分为正常饮食组和高脂饮食组,分别给予普通饲料 (10%热卡来自脂肪)和高脂饲料(60%热卡来自脂肪)喂养16周,每组各10只。以上实验经过上海交通大学附属第六人民医院动物福利与伦理委员会的批准。
1.2.2 脂肪组织SVF和脂肪细胞的分离 15只6周龄小鼠分为3组,每组5只。小鼠过量麻醉处死后,取出皮下和内脏脂肪,缓冲液反复冲洗后剪碎,胶原酶 37℃消化 60 min,2 000 r/min离心 10 min。去上清液,红细胞裂解液处理10 min,离心去上清液;缓冲液冲洗离心,静置10 min,上层为脂肪细胞,下层为SVF。
1.2.3 3T3-L1细胞的诱导分化及药物处理 将3T3-L1细胞培养于含10%胎牛血清的DMEM培养基中,待细胞融合后,加入诱导液A(10%胎牛血清的 DMEM含 0.5 mmol/L 3-异丁基-1-甲基黄嘌呤、1 μmol/L地塞米松、1.7μmol/L胰岛素),隔天更换诱导液B(10%胎牛血清的DMEM含1.7μmol/L胰岛素),继续培养直至出现大量脂滴。浓度梯度实验:以不同剂量(0、0.25、0.5、1、2μmol/L)罗格列酮处理脂肪细胞24 h;时间梯度实验:以2μmol/L罗格列酮处理脂肪细胞 0、4、12、24、48 h。
1.2.4 实时定量PCR测定DPTmRNA表达 小鼠组织和细胞采用Trizol试剂抽提RNA,经逆转录成为cDNA,并由qPCR试剂盒进行扩增。引物序列如下,DPT:正义 5′-CTGCCGCTATAGCAAGAGGT-3′,反义 5′-TGGCTTGGGTACTCTGTTGTC-3′;36B4:正义 5′-AAGCGCGTCCTGGCATTGTCT-3′,反 义 5′-CCGCAGGGGCAGCAGTGGT-3′。以 36B4作为内参,计算DPTmRNA的相对拷贝数2-△△Ct。
1.2.5 蛋白质印迹法检测DPT蛋白的表达 小鼠组织和细胞总蛋白采用RIPA裂解液提取,经BCA蛋白定量试剂盒测总蛋白浓度,最后加热变性。取20~60μg蛋白样本聚丙烯酰胺凝胶电泳,湿转蛋白至硝酸纤维素膜,孵育一抗4℃过夜。次日TBST洗3次,每次5 min,过氧化物酶标记的抗兔(鼠)二抗室温孵育1 h,再次TBST洗3次,每次5 min。最后经ImageQuant凝胶图像分析仪曝光成像。
1.2.6 GEO数据库芯片分析 登录NCBI数据库Gene Expression Omnibus(GEO)Profiles窗口 (http:/www.ncbi.nlm.nih.gov/geo/),以“DPT,adipose tissue”为检索词,获得芯片及探针数据GDS3142/1418511_at。GDS3142代表小鼠各组织基因表达芯片这一数据集,而1218511_at代表DPT这一基因的探针,数据涉及22个器官或组织。
1.3 统计学处理
2 结果
2.1 DPT在人和小鼠的脂肪组织中高度表达
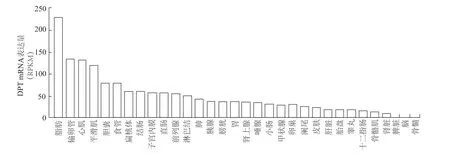
图1 DPT在人类主要组织的表达谱
首先利用人类蛋白质门户(The Human Protein Atlas)数据库和2015年发表在《Science》上的一项人类蛋白质图谱研究[7],发现DPT基因在人类大多数组织中均有表达,其中mRNA表达水平在脂肪中表达最高(图1)。同时利用 GEO数据库(GDS3142/1418511_at)发现,DPT mRNA在小鼠各组织的表达与人类类似,同样在脂肪中表达最高(图2)。提取6周龄小鼠主要组织(包括皮下、内脏、棕色脂肪,腓肠肌和比目鱼肌)的RNA和蛋白,对DPT在各组织的表达进行验证。实时定量PCR和蛋白质印迹结果显示,DPTmRNA和蛋白表达水平均在白色脂肪中最高,其次是棕色脂肪,但在腓肠肌和比目鱼肌中的表达较低(图3)。
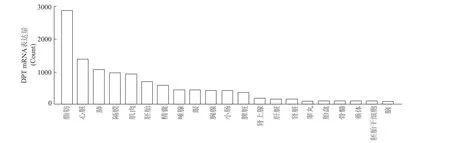
图2 DPT在小鼠主要组织的表达谱
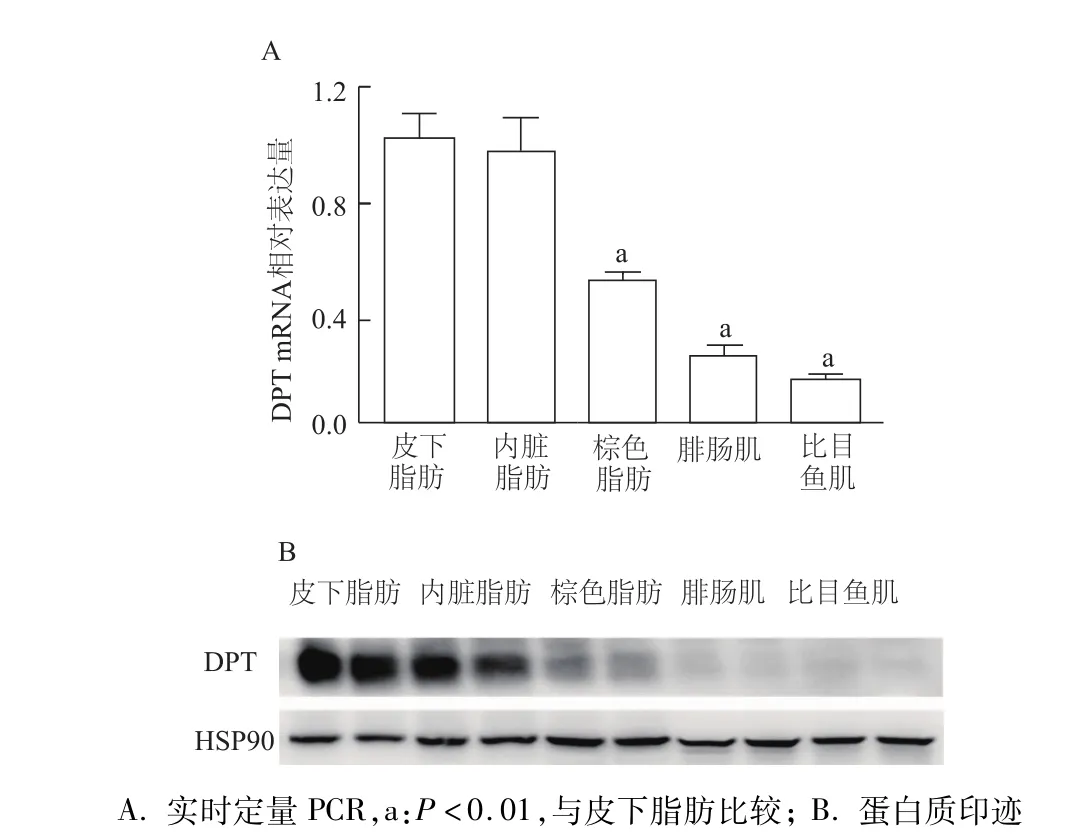
图3 DPT mRA和蛋白在小鼠主要组织的表达
2.2 高脂饮食明显增加白色脂肪中DPT表达水平
提取正常饮食组和高脂饮食组小鼠皮下、内脏、棕色脂肪和腓肠肌、比目鱼肌的RNA和蛋白。实时定量PCR结果表明,与正常饮食组相比,高脂饮食组小鼠的皮下、内脏、棕色脂肪中DPTmRNA表达水平均明显增加,其中在皮下脂肪中升高约6倍(t=-8.264,P<0.01),在内脏脂肪中升高约 2倍(t=-4.964,P<0.01),在棕色脂肪中升高 1.5倍左右(t=-2.789,P<0.01)。但腓肠肌和比目鱼肌中DPTmRNA表达水平两组间差异无统计学意义(图4A)。蛋白质印迹结果表明,与正常饮食组相比,DPT蛋白表达水平在高脂饮食组小鼠白色脂肪中增加,其中皮下脂肪增加较为明显(图4B)。
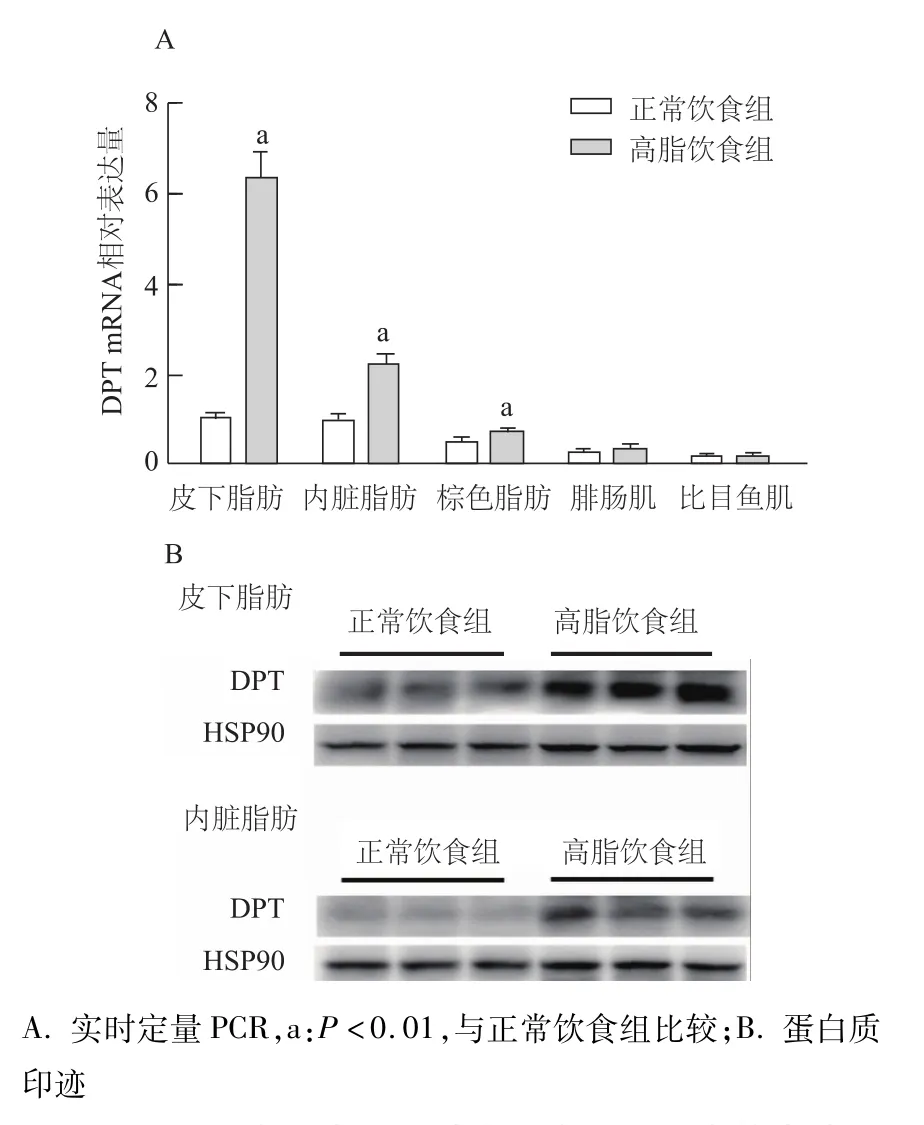
图4 DPT在正常和肥胖小鼠主要组织中的表达
2.3 DPT主要由脂肪细胞合成并分泌至胞外
进一步分离6周龄小鼠皮下和内脏脂肪组织的SVF和脂肪细胞,发现脂肪细胞的DPTmRNA和蛋白表达水平明显高于在SVF中的表达(图5)。
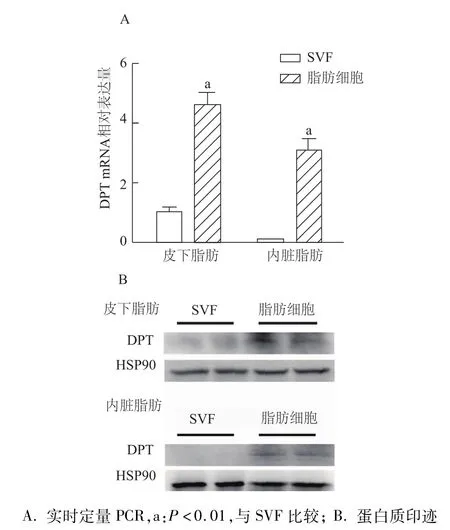
图5 6周龄小鼠皮下和内脏脂肪组织SVF和脂肪细胞中DPT mRNA和蛋白表达差异
同时,在3T3-L1前脂肪细胞诱导分化为脂肪细胞的过程中,DPTmRNA表达水平从分化第4天起逐渐增加,并在第8天达到最高;同样在其分化过程的细胞裂解物和上清液中,DPT蛋白表达水平也逐渐增加,并于第8天达到最高(图6)。
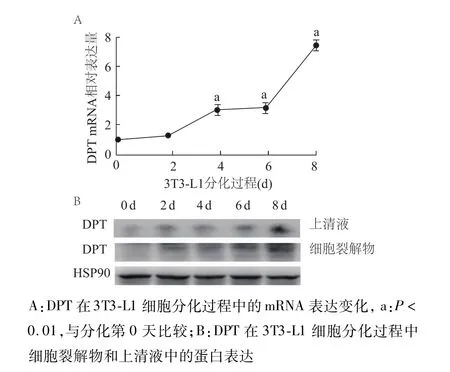
图6 DPT在3T3-L1细胞分化过程中的表达
2.4 罗格列酮下调3T3-L1脂肪细胞中DPT表达水平
实时定量PCR结果显示,与对照组相比,以0.25、0.5、1、2μmol/L罗格列酮处理脂肪细胞 24 h后,DPTmRNA表达水平明显降低(P<0.05或P<0.01);以 2μmol/L罗格列酮处理脂肪细胞 4、12、24、48 h,DPTmRNA表达水平在4 h、12 h无明显变化,但随着处理时间的延长,在24 h、48 h降低明显(P<0.05或P<0.01)。以2μmol/L罗格列酮处理脂肪细胞48 h、72 h,DPT蛋白表达水平均明显降低(图7)。
3 讨论
脂肪组织快速扩张的能力主要依赖于组织内各种细胞的协同反应,共同参与重构过程中的ECM重构、急性炎症反应及适度的血管新生,其中ECM重构发挥关键作用[8]。而肥胖状态下,脂肪组织发生纤维化、慢性炎症反应及血管新生受损等病理性改变,是肥胖症及糖尿病等系统性代谢紊乱的主要致病因素[9]。既往研究显示,高脂饮食诱导的肥胖小鼠的脂肪组织中存在包括Ⅳ型胶原在内的胶原沉积[6]。而胶原蛋白沉积使脂肪组织可塑性减弱,并且促进肥胖机体代谢紊乱,许多其他非胶原ECM成分在肥胖机体脂肪组织也处于失调状态[10-11]。
DPT作为一种非胶原ECM蛋白,可以与核心糖蛋白、TGF-β、Ⅰ型胶原蛋白等作用,并具有促进胶原纤维形成等功能,在多种与ECM有关的生理和病理过程中发挥作用[12-13]。最近的一项研究发现,在超重/肥胖合并非乙醇性肝炎和肝脏纤维化患者的肝脏中DPT的表达增加,而通过代谢手术治疗肥胖的同时,患者肝纤维化明显缓解,且肝脏中DPT的表达降低[14];通过 DPT-/-小鼠模型观察到 DPT对胶原蛋白沉积和纤维化有促进作用,而过氧化物酶体增殖物激活受体-α激活后可有效降低DPT的表达。这项研究充分说明DPT与组织纤维化之间的密切联系,DPT可能成为逆转组织纤维化进程的一个有效作用靶点。另外一项研究发现DPT可以调节内皮细胞TGF-β1和整合素α3β1的表达,从而促进血管新生过程[15]。
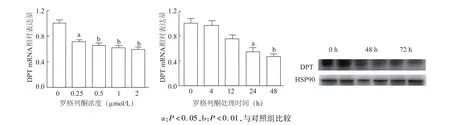
图7 罗格列酮对3T3-L1脂肪细胞DPT基因表达的调控
本研究发现细胞外基质成员DPT在人和小鼠脂肪中表达很高,小鼠高脂饮食后DPT在脂肪中的表达明显增加,特别是白色脂肪。我们进一步发现DPT主要由脂肪细胞合成并分泌。这提示脂肪组织作为一个活跃的内分泌器官,应对营养变化时,脂肪细胞本身可以分泌多种因子从而调节机体代谢。高脂饮食后脂肪细胞分泌增加的DPT广泛分布于细胞外,从而影响肥胖发生发展进程中伴随的脂肪组织结构及功能。但是DPT具体通过何种机制影响脂肪组织的结构和功能,以及DPT的表达水平是否与肥胖机体脂肪组织纤维化相关,尚需进一步明确。另外本研究发现,罗格列酮处理3T3-L1脂肪细胞后,DPT的表达量明显降低。这说明PPARγ激动剂作为一种抗糖尿病药物,不仅可以有效降低脂肪细胞中胶原蛋白的转录,从而抵抗纤维化的发生,同时可调控非胶原蛋白DPT的表达。如果DPT是肥胖发展过程中脂肪组织纤维化的风险因子之一,那么通过药物干预DPT的表达,有可能改善肥胖相关的脂肪组织结构及功能紊乱。
[1]Sun K,Kusminski CM,Scherer PE.Adipose tissue remodeling and obesity[J].J Clin Invest,2011,121(6):2094-2101.
[2]Ricard-Blum S,Ruggiero F.The collagen superfamily:from the extracellular matrix to the cellmembrane[J].Pathol Biol(Paris),2005,53(7):430-442.
[3]Neame PJ,Choi HU,Rosenberg LC.The isolation and primary structure of a 22-kDa extracellularmatrix protein from bovine skin[J].J Biol Chem,1989,264(10):5474-5479.
[4]Okamoto O,Fujiwara S.Dermatopontin,a novel player in the biology of the extracellular matrix[J].Connect Tissue Res,2006,47(4):177-189.
[5]Yamatoji M,Kasamatsu A,Kouzu Y,et al.Dermatopontin:a potential predictor formetastasis of human oral cancer[J].Int J Cancer,2012,130(12):2903-2911.
[6]Khan T,Muise ES,Iyengar P,et al.Metabolic dysregulation and adipose tissue fibrosis:role of collagen VI[J].Mol Cell Biol,2009,29(6):1575-1591.
[7]Uhlen M,Fagerberg L,Hallstrom BM,et al.Proteomics.Tissue-based map of the human proteome[J].Science,2015,347(6220):1260419.
[8]Mariman EC,Wang P.Adipocyte extracellular matrix composition,dynamics and role in obesity[J].CellMol Life Sci,2010,67(8):1277-1292.
[9]Crewe C,An YA,Scherer PE.The ominous triad of adipose tissue dysfunction:inflammation,fibrosis,and impaired angiogenesis[J].JClin Invest,2017,127(1):74-82.
[10]Lin D,Chun TH,Kang L.Adipose extracellular matrix remodelling in obesity and insulin resistance[J].Biochem Pharmacol,2016,119:8-16.
[11]Spencer M,Unal R,Zhu B,etal.Adipose tissue extracellularmatrix and vascular abnormalities in obesity and insulin resistance[J].JClin Endocrinol Metab,2011,96(12):E1990-1998.
[12]MacBeath JR,Shackleton DR,Hulmes DJ.Tyrosine-rich acidic matrix protein(TRAMP)accelerates collagen fibril formation in vitro[J].J Biol Chem,1993,268(26):19826-19832.
[13]Kato A,Okamoto O,Ishikawa K,et al.Dermatopontin interacts with fibronectin,promotes fibronectin fibril formation,and enhances cell adhesion[J].J Biol Chem,2011,286(17):14861-14869.
[14]Lefebvre P,Lalloyer F,Bauge E,et al.Interspecies NASH disease activity whole-genome profiling identifies a fibrogenic role of PPARα-regulated dermatopontin[J].JCI Insight,2017,2(13):e92264.
[15]Krishnaswamy VR,Balaguru UM,Chatterjee S,et al.Dermatopontin augments angiogenesis and modulates the expression of transforming growth factorβ1 and integrin α3β1 in endothelial cells[J].Eur JCell Biol,2017,96(3):266-275.
