miR-136对胶质瘤U251细胞生物学功能的影响
2018-01-18钱尧邵根宝于强陈波王景文李鲁博周洲王品昊李巧玉
钱尧,邵根宝,于强,陈波,王景文,李鲁博,周洲,王品昊,李巧玉
(1.江苏大学医学院,江苏镇江212013;2.江苏大学附属人民医院神经外科,江苏镇江212002)
恶性胶质瘤恶性度高、侵袭性强,即使联合手术、放疗和化疗,也无法明显提高患者的生存率[1]。如常见的恶性星形细胞瘤,单纯手术治疗2年生存率为50%左右,中位生存期20~28个月[2]。微小RNA(miRNA)是一种内生的、非编码单链、小分子RNA[3],其可与靶 基因 mRNA 3′-非翻译区 (3′-UTR)结合从而调控靶基因的表达;根据靶基因的种类,发挥类似癌基因或抑癌基因的功能,与多种肿瘤细胞的增殖、侵袭、转移等生物学过程密切相关[4-7]。miRNAs在多种肿瘤包括胶质瘤中均发挥调节作用,部分miRNAs在胶质瘤发生发展中的作用机制已阐明[8]。miR-136在卵巢癌、乳腺癌及肺癌等多种肿瘤中呈低表达[9-11]。另有研究证实,miR-136在人胶质瘤组织中也呈低表达[12-14],其发挥的作用与不同类型的下游靶基因相关。FZD4属于frizzled家族,与恶性肿瘤关系密切,通过信号通路参与恶性肿瘤的一系列生物学行为,包括增殖、凋亡、侵袭和转移等[15]。但是,miR-136在胶质瘤中的作用及其是否参与对FZD4的调控尚不清楚。因此,本研究选择胶质瘤U251细胞系,上调miR-136的表达,分析FZD4的表达及其对细胞增殖、侵袭和迁移的影响。
1 材料与方法
1.1 材料
人胶质瘤U251细胞系购自美国典型培养物保藏中心。DMEM、PBS、胰蛋白酶为美国 Hyclone公司产品。胎牛血清购自上海依科赛生物制品有限公司。miR-136模拟物序列:5′-ACUCCAUUUGUUUUGAUGAUGGA-3′,阴性对照序列:5′-GUCCCACUUCGACCGUGCUUCCA-3′,由广州锐博生物有限公司构建。Lipofectamine2000转染试剂盒为美国Invitrogen公司产品;Trizol试剂盒、反转录试剂盒、定量PCR试剂盒、蛋白裂解液RIPA均为日本TaKaRa公司产品。CCK-8购自北京Sigma公司。FZD4兔抗人单克隆抗体、内参GAPDH抗体为美国Abcam公司产品。miR-136、FZD4及内参U6引物由上海生工生物工程有限公司合成。ECL化学发光试剂盒购自上海碧云天生物试剂有限公司。
1.2 细胞培养
采用含有10%胎牛血清和1%青霉素及链霉素的DMEM高糖培养基,置于37℃,5%CO2培养箱中培养。
1.3 细胞转染
转染前1 d胰酶消化U251细胞并计数,接种于6孔板中,分为2组。当细胞密度接近90%时,利用Lipofectamine2000转染试剂分别转染miR-136模拟物(50 nmol/L,模拟物组)及 miR-136模拟物阴性对照(50 nmol/L,对照组)。转染后将细胞置于培养箱中培养48 h。
1.4 实时定量 PCR检测 U251细胞 miR-136和FZD4 mRNA的表达
取“1.3”转染后的2组细胞,参照Trizol试剂盒说明书分别提取细胞内总RNA,核酸测定仪检测RNA浓度及纯度[D(260 nm)/D(280 nm)在1.8~2.0之间]。将RNA反转录为cDNA,miR-136反转录引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCCAT-3′。反应体系 10μL,反应条件:42℃60 min;70℃10 min,1个循环。取反转录产物行定量PCR,miR-136引物序列:上游5′-GCGCACTCCATTTGTTTTGAT-3′;下 游 5′-GTGCAGGGTCCGAGGT-3′。FZD4引物序列:上游 5′-AAACTAGCGGCCGCTAGTTCAGTTACCAGTGACCTTCAT-3′;下游 5′-CTAGATGAAGGTCACTGGTAACTGAACTAGCGGCCGCTAGTTT-3′;以 U6为 内 参。PCR反应条件:反应体系20μL,90℃30 s;95℃5 s,60℃ 30 s,共 40个循环。以 2-ΔΔCt值计算 mRNA的相对表达量,实验重复3次。
1.5 细胞增殖实验
取“1.3”转染后2组细胞,胰酶消化,接种于6孔板中(细胞计数1×105个/孔),于37℃、5%CO2培养箱中培养6 h;待细胞完全贴壁后显微镜下观察细胞密度,拍照记录,记为“0 h”,继续培养24 h,显微镜下观察并拍照记录,记为“24 h”。
取“1.3”转染后2组细胞,调整细胞密度为1×104个/孔,并接种于96孔板中,于37℃、5%CO2培养箱中培养。连续培养72 h,每24 h加入10μL CCK-8试剂,于37℃、5%CO2培养箱培养2 h,测各组细胞在450 nm波长处的光密度(D)值。
1.6 Transwell和划痕实验
采用Transwell实验评估胶质瘤细胞的侵袭能力。取“1.3”转染后的2组U251细胞,胰酶消化、离心,弃上清液,重悬于无血清培养基中;再将细胞置于含有Matrigel侵袭室内,在下室中加入有血清的培养基,于培养箱中诱导培养;次日用4%低聚甲醛室温固定30 min;结晶紫染色15 min;弃小室内液体,用棉签轻轻擦干,并置于显微镜下拍照。
采用划痕实验评估胶质瘤细胞的迁移能力。将2组细胞接种于6孔板中,置于培养箱中培养。次日观察细胞,待铺满培养板后,用200μL枪头垂直画线,形成间隙。PBS重复洗3遍,再加入不含血清的培养基,放入培养箱中培养;分别于0 h、24 h显微镜下观察并拍照。
1.7 miR-136靶基因生物信息学预测
检索 miRnada[16]生物信息学数据库根据信息提示,预测并分析miR-136的下游靶基因。
1.8 蛋白质印迹法检测U251细胞中FZD4蛋白的表达
取“1.3”转染后2组细胞,按照RIPA说明书分别提取总蛋白;100℃水浴15min使蛋白充分变性;行SDS-PAGE,每孔上样量15μL;110 V电泳1 h;300 mA恒流,90 min转至PVDF膜;5%封闭液(2 g脱脂奶粉溶于40 mL TBST溶液)于4℃封闭4 h;TBST缓冲液摇床振荡洗膜3次,每次2 min;加入抗FZD4单抗及内参GAPDH抗体(均1∶1 000稀释),4℃孵育过夜;次日TBST缓冲液摇床漂洗3次,每次10 min;加入二抗(1∶1 000稀释)室温孵育1 h;TBST洗涤3次,每次10 min;将超敏ECL化学发光试剂盒A液和B液按1∶1混合,均匀加至PVDF膜,室温避光孵育2 min;置于自动显影仪器进行目的蛋白显影,采用Image J图像分析软件进行灰度分析。
1.9 统计学方法
每组实验独立重复3次,统计分析采用SPSS 17.0软件。计量资料以均数±标准差(±s)表示。两组间均数比较采用Student′st检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-136的转染效率
qRT-PCR检测结果显示,模拟物组胶质瘤U251细胞中miR-136的表达量明显高于对照组,差异有统计学意义(t=10.05,P<0.05)。见图1。
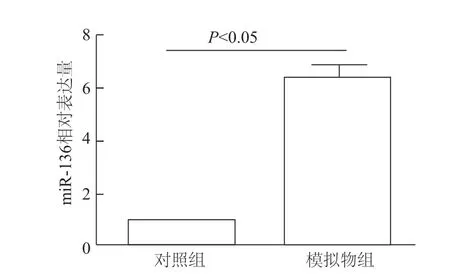
图1 U251细胞中m iR-136的表达
2.2 miR-136对胶质瘤U251细胞增殖、侵袭和迁移的影响
镜下观察结果显示,在0 h时模拟物组和对照组细胞密度无明显差异,转染24 h之后模拟物组细胞密度明显低于对照组,说明miR-136可抑制U251细胞生长。见图2。

图2 U251细胞的生长密度(×400)
CCK-8检测结果显示,在24,48,72 h时模拟物组D值均低于对照组(P<0.05),尤其在24~48 h模拟物组细胞增殖非常缓慢,基本停止增殖,表明miR-136可抑制胶质瘤U251细胞的增殖活性。见图3。
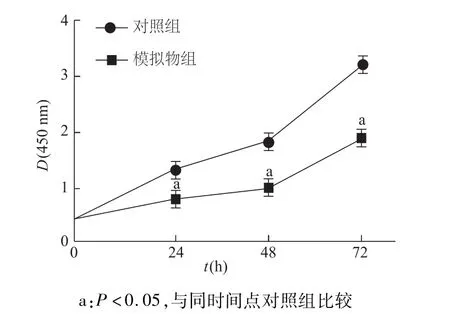
图3 CCK-8检测U251细胞增殖力
Transwell实验结果显示,转染24 h后模拟物组U251细胞数明显少于对照组,说明miR-136可抑制U251细胞侵袭。见图4。
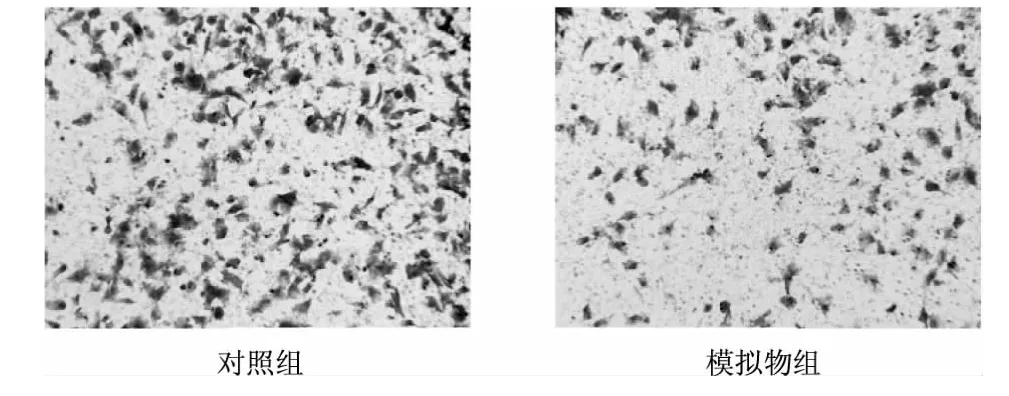
图4 Transwell实验检测细胞的侵袭能力(×200)
划痕实验结果显示,转染24 h后模拟物组U251细胞迁移距离明显小于对照组,表明miR-136可抑制U251细胞的迁移。见图5。

图5 划痕实验检测细胞的迁移能力(×40)
2.3 miR-136靶基因生物信息学预测
利用miRnada数据库分析miR-136的靶基因,结果发现FZD4可能是其下游靶基因。miR-136与FZD4 mRNA 3′-UTR结合区域预测结果见图6。

图6 靶基因数据库预测FZD4为m iR-136下游靶基因
2.4 转染后U251细胞中FZD4 mRNA和蛋白的表达
qRT-PCR结果显示,模拟物组中FZD4 mRNA表达水平明显低于对照组(t=5.878,P<0.05),说明miR-136抑制FZD4 mRNA表达。蛋白质印迹检测结果显示,模拟物组FZD4蛋白表达水平明显低于对照组(P<0.05)。由此表明,miR-136抑制FZD4蛋白表达。见图7。
3 讨论
miRNA在大小、结构和功能方面存在着高度的保守性,组成了物种进化过程中细胞高度复杂的RNA表达调控网络[17],参与细胞的分化、增殖、凋亡等一系列关键进程。邢亚楠等[18]报道证实,抑制miR-136表达可促进PPP2R2A蛋白表达,进而引起胃癌细胞凋亡。因此,miR-136功能失调可能导致恶性肿瘤的发生发展。本研究结果显示,上调miR-136表达可明显抑制U251细胞的生物学活性,从而证实miR-136在胶质瘤的发生发展进程中发挥着类似抑癌基因的功能。

图7 m iR-136转染后U251细胞FZD4 mRNA和蛋白的表达
FZD4是wnt信号通路中重要的下游基因,参与细胞的增殖、侵袭及凋亡等多种生物学过程[19]。据文献报道,FZD4参与多种恶性肿瘤细胞内的信号传导,在肿瘤细胞中发挥着类似癌基因的作用,如在膀胱癌、肺癌及宫颈癌等癌组织中均呈高表达,且其高表达水平与肿瘤的预后不良密切相关[16,20-21]。本研究通过miRnada生物信息学数据库预测FZD4 mRNA 3′-UTR存在miR-136的靶向结合位点。因此,我们推测FZD4可能为miR-136的靶基因之一,miR-136与FZD4之间可能存在靶向调控作用。本研究结果显示,上调miR-136可明显降低FZD4 mRNA及蛋白表达,因此证实 miR-136可负向调控FZD4的表达,从而抑制胶质瘤U251细胞增殖、侵袭及转移。但是本研究只证实上调miR-136可抑制FZD4的表达,尚未阐述miR-136靶向调控FZD4的具体作用机制,以及FZD4是否参与胶质瘤发生发展的其他过程(如U251细胞凋亡)与预后的关系等,还需要进一步研究。
综上所述,在胶质瘤U251细胞中miR-136可能通过下调FZD4的表达,进而抑制细胞的增殖、侵袭及迁移,提示miR-136、FZD4可作为临床治疗胶质瘤的潜在标志物。
[1]Wang X,Jia Y,Wang P,et al.Current status and future perspectives of sonodynamic therapy in glioma treatment[J].Ultrason Sonochem,2017,37:592-599.
[2]Siegel RL,Miller KD,Jemal A,et al.Cancer Statistics,2017[J].CA Cancer JClin,2017,67(1):7-30.
[3]高佳莉,罗玉萍,李思光.miR-34基因家族的分子进化[J].动物学研究,2007,28(3):271-278.
[4]Piva R,Spandidos DA,Gambari R,et al.From microRNA functions tomicroRNA therapeutics:novel targets and novel drugs in breast cancer research and treatment(Review)[J].Int JOncol,2013,43(4):985-994.
[5]Luna-Aguirre CM,de la Luz Martinez-Fierro M,Mar-Aguilar F,et al.Circulating microRNA expression profile in B-cell acute lymphoblastic leukemia[J].Cancer Biomark,2015,15(3):299-310.
[6]Sampson VB,Yoo S,Kumar A,et al.MicroRNAs and potential targets in osteosarcoma:review[J].Front Pediatr,2015,3:69.
[7]Kanda M,Kodera Y.Recent advances in themolecular diagnostics of gastric cancer[J].World JGastroenterol,2015,21(34):9838-9852.
[8]Yang L,Mu Y,Cui H,et al.miR-9-3p augments apoptosis induced by H2O2through down regulation of Herpud1 in glioma[J]. PLoS One, 2017, 12(4):e0174839.
[9]Zhao H,Liu S,Wang G,et al.Expression ofmiR-136 is associated with the primary cisplatin resistance of human epithelial ovarian cancer[J].Oncol Rep,2015,33(2):591-598.
[10]Yan M,Li X,Tong D,et al.miR-136 suppresses tumor invasion and metastasis by targeting RASAL2 in triple-negative breast cancer[J].Oncol Rep,2016,36(1):65-71.
[11]Yang Y,Liu L,Cai J,et al.Targeting Smad2 and Smad3 by miR-136 suppresses metastasis-associated traits of lung adenocarcinoma cells[J].Oncol Res,2013,21(6):345-352.
[12]Wu H,Liu Q,Cai T,et al.MiR-136 modulates glioma cell sensitivity to temozolomide by targeting astrocyte elevated gene-1[J].Diagn Pathol,2014,9:173.
[13]Yang Y,Wu J,Guan H,et al.MiR-136 promotes apoptosis of glioma cells by targeting AEG-1 and Bcl-2[J].FEBS Lett,2012,586(20):3608-3612.
[14]Chen W,Yang Y,Li Q,et al.MiR-136 targets E2F1 to reverse cisplatin chemosensitivity in glioma cells[J].JNeurooncol,2014,120(1):43-53.
[15]Ueno K,Hirata H,Majid S,et al.Tumor suppressor microRNA-493 decreases cellmotility and migration ability in human bladder cancer cells by downregulating RhoC and FZD4[J].Mol Cancer Ther,2012,11(1):244-253.
[16]John B,Enright AJ,Aravin A,et al.Human MicroRNA targets[J].PLoSBiol,2004,2(11):e363.
[17]戴中华,陈良标.MicroRNA对多细胞动物复杂性进化的影响[J].遗传,2010,32(2):105-114.
[18]邢亚楠,邓鹏,徐惠绵.miR-136通过抑制PPP2R2A表达调控胃癌细胞SGC7901凋亡[J].临床与病理杂志,2015,35(12):2108-2111.
[19]Gupta S,Iljin K,Sara H,et al.FZD4 as amediator of ERG oncogene-induced WNT signaling and epithelial-tomesenchymal transition in human prostate cancer cells[J].Cancer Res,2010,70(17):6735-6745.
[20]Lin J,Zandi R,Shao R,et al.A miR-SNP biomarker linked to an increased lung cancer survival by miRNA-mediated down-regulation of FZD4 expression and Wnt signaling[J].Sci Rep,2017,7(1):9029.
[21]Ma C,Xu B,Husaiyin S,et al.MicroRNA-505 predicts prognosis and acts as tumor inhibitor in cervical carcinoma with inverse association with FZD4[J].Biomed Pharmacother,2017,92:586-594.
