miR-222-3p通过靶向调节Bim蛋白表达参与肾细胞癌的发生发展
2018-01-18田亚萍王成钟锦莎丁梦葛京平张春妮
田亚萍,王成,钟锦莎,丁梦,葛京平,张春妮
(1.江苏大学医学院,江苏镇江212013;2.南京军区南京总医院临床检验科,江苏南京210002;3.南京军区南京总医院泌尿外科,江苏南京210002)
肾细胞癌是常见的成人泌尿系统恶性肿瘤,发病机制至今不详,早期多无症状,约30%的患者发现时已经发生转移,导致预后极差[1]。故阐明肾细胞癌发生发展的分子机制,寻找新型的分子治疗靶标,是提高肾细胞癌患者生存率和改善预后的关键。
微小核糖核酸(microRNA,miRNAs)是一类小分子非编码RNA,可通过与靶信使RNA(messenger RNA,mRNA)3′端非翻译区(3′-untranslated region,3′-UTR)完全或部分互补结合,导致靶mRNA翻译抑制或降解,在转录后水平调控靶基因表达[2]。不同的miRNAs通过靶向不同的基因发挥原癌和抑癌基因作用,参与肿瘤的发生发展[3-4]。已有研究显示,miR-222-3p在恶性甲状腺滤泡癌水平升高,可用来区分良恶性甲状腺滤泡癌[5];在胶质细胞瘤中,miR-221/222通过与蛋白质酪氨酸磷酸酶 μ3′-UTR结合,下调该蛋白在胶质瘤中表达,进而诱导细胞的侵袭和迁移[6];卵巢癌上皮细胞分泌的miR-222-3p可以促进单核细胞向肿瘤相关巨噬细胞转化从而促进肿瘤的生长和转移[7]。上述研究提示,miR-222-3p的表达异常与多种肿瘤发生发展密切相关。在miR-222-3p与肾肿瘤的研究中,已报道肾透明细胞癌患者血浆中miR-221/222的表达水平升高并且与其发生转移有关,具体机制尚不清楚[8-9]。
Bim是细胞凋亡信号转导途径中关键的凋亡调节因子,是一种重要的促凋亡蛋白,研究发现Bim在多种肿瘤中发挥抑癌作用[10-11]。Terasawa等[12]发现miR-222通过在转录水平下调Bim的表达从而减少PC12细胞凋亡。然而miR-222-3p是否通过调节Bim的表达参与肾细胞癌的发生发展尚未见报道。因此本研究主要探讨miR-222-3p在肾细胞癌组织中的表达变化、影响肾细胞癌的凋亡能力以及可能作用的靶基因。
1 材料与方法
1.1 材料
1.1.1 组织标本来源 收集15例2013年10月至2017年11月在南京军区南京总医院泌尿外科手术的肾细胞癌组织标本,患者平均年龄(63.47±2.99)岁,其中男10例,女5例,均无吸烟饮酒史。14例病理分型为肾透明细胞癌,1例为嫌色细胞癌。按照Furhman分级标准对患者组织标本进行分级[13],其中Ⅰ~Ⅱ级 5例(33.3%),Ⅲ ~Ⅳ级 3例(20.0%),不确定7例(46.7%),均为新诊治患者,行肾癌根治性切除术前未进行任何辅助治疗。手术切除的肾癌组织留作本课题研究的肿瘤标本,同时在距肿瘤远端约3~5 cm处切取正常组织作为对照。组织样本取出后用液氮速冻,然后保存于-80℃冰箱。
1.1.2 细胞培养 人源肾癌细胞株769-P(北京协和细胞中心)和人胚肾细胞293T(上海中国医学科学院细胞库)分别培养于含10%胎牛血清和1%青霉素/链霉素的 RPMI1640、DMEM培养液,并于37℃湿润的培养箱(5%CO2)以贴壁形式生长。
1.1.3 试剂与材料 miR-222-3p检测探针(美国Applied Biosystems公司);miR-222-3p模拟物(miR-222-3p mimic,序 列 为 5′-AGCUACAUCUGGCUACUGGGU-3′)和阴性对照寡核苷酸(miR-NC mimic,序列为 5′-UAGUGGAUGGCAGGCACACUCA-3′)由上海吉玛生物公司合成;Bim mRNA定量检测引物(前向引物 5′-CACCAGCACCATAGAAGAA-3′,后向引物 5′-ATAAGGAGCAGGCACAGA-3′)、GAPDH定量检测引物(前向引物 5′-AGAAGGCTGGGGCTCATTTG-3′,后 向 引 物 5′-AGGGGCCATCCACAGTCTTC-3′)[14]、荧光素酶报告质粒(p-MIRLuciferase report)由金斯瑞公司合成;RIPA试剂(碧云天公司);Bim抗体(Cell Signaling公司);GAPDH、α微管蛋白、羊抗兔二抗、羊抗鼠二抗(Santa Cruz公司);凋亡检测试剂盒(美国Sigma-Aldrich公司);荧光素酶报告系统检测试剂盒(Promega公司);Opti-MEM培养液、DMEM培养液、1640培养液和胎牛血清(Gibco公司);Trizol试剂、Lipofectamine 2000(美国Invitrogen公司);SYBR Green试剂(大连TaKaRa公司);ECL试剂盒(美国Pierce公司)。
1.2 方法
1.2.1 qRT-PCR检测肾组织miR-222-3p的表达组织总RNA用Trizol试剂提取。miR-222-3p检测采用茎环qRT-PCR法。由于组织中常用内参miR-16、U6在癌及癌旁正常组织中表达均有差异(PmiR-16<0.01,PU6<0.01),miR-222-3p的表达由直接循环阈值法计算。
1.2.2 靶基因预测 应用TargetScan在线工具(http/www.targetscan.org/)寻找 miR-222-3p的可能作用靶基因。
1.2.3 荧光素酶活性检测实验 将293T细胞按每孔5×104个接种于48孔板中,当细胞汇合度为70%时,分别将 miR-NC mimic、miR-222-3p mimic、Bim野生型、Bim突变型、半乳糖苷酶表达载体(βgal)质粒共转染293T细胞,培养6 h后换成含2%胎牛血清的DMEM继续培养,48 h后检测细胞荧光素酶的活性。β-gal为内参比较实验组相对于对照组荧光素酶活性的变化。
1.2.4 免疫组织化学染色检测组织Bim蛋白的表达 采用 EnVision(DAKO公司)二步法[15],抗体为Bim(1∶1 000)。使用 ImageJ-Pro Plus 6.0软件分别计算癌组织及癌旁组织中200倍视野下Bim蛋白阳性颗粒数和总细胞数,阳性颗粒数与总细胞数之比为Bim相对表达水平。
1.2.5 蛋白质印迹法检测组织Bim蛋白表达 采用RIPA裂解液提取癌组织及癌旁组织蛋白,配制12.5%的分离胶和5%的浓缩胶,将蛋白加入梳孔进行电泳。电泳结束后转印至PVDF膜,1.5 h后用5%的脱脂牛奶封闭,室温1 h后加入一抗(Bim、GAPDH)4℃孵育过夜。TBST洗膜,二抗孵育1 h后用ECL试剂盒显色发光。使用ImageJ软件对结果进行灰度分析,计算蛋白表达水平。
1.2.6 蛋白质印迹法检测转染miR-222-3p后769-P细胞Bim蛋白表达 将769-P细胞按每孔5×104个接种在6孔板上,将200 pmol的 miR-NC mimic,miR-222-3p mimic用溶于Opti-MEM的Lipofectamine 2000试剂转染769-P细胞,培养6 h后换成含2%胎牛血清的1640继续培养48 h。收集细胞,用PBS洗涤2遍后提取总蛋白质。将蛋白提取液用12.5%SDS-PAGE进行电泳分离。分离完毕后通过电转方法将蛋白质转至PVDF膜。用Bim、GAPDH单克隆抗体孵育过夜,TBST洗膜后二抗孵育1 h,蛋白条带用ECL试剂盒显色发光。使用ImageJ软件对结果进行灰度分析。
1.2.7 qRT-PCR检测转染 miR-222-3p后769-P细胞中Bim mRNA的表达 Bim mRNA的定量PCR扩增使用SYBR Green试剂,GAPDH作为内参,其相对表达用2-ΔΔCT法表示,其中 ΔCT=CtBim-CtGAPDH,ΔΔCT=ΔCT肾癌组织-ΔCT癌旁组织。
1.2.8 流式细胞术检测转染 miR-222-3p后769-P细胞的凋亡水平 将769-P细胞按每孔5×104个接种在6孔板上,将200 pmol的 miR-NC mimic,miR-222-3p mimic用溶于Opti-MEM的Lipofectamine 2000试剂转染769-P细胞,培养6 h后换成含2%胎牛血清的1640继续培养48 h。将细胞用PBS洗涤2遍后,按照凋亡试剂盒说明书步骤将PI和Annexin-V加入细胞中孵育20 min,采用流式细胞术检测肿瘤细胞的凋亡。
1.3 统计学方法
所有数据应用GraphPad Prism 5软件进行统计学分析,组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 肾细胞癌组织中miR-222-3p的表达水平显著升高
qRT-PCR检测结果显示,肾细胞癌组织中miR-222-3p表达水平显著高于癌旁对照组织(图1)。
2.2 Bim是miR-222-3p的直接靶点
靶基因预测结果表明,miR-222-3p与促凋亡基因Bim mRNA 3′-UTR的第4052-4059位碱基序列(AUGUAGCA)互补结合(图2),提示 Bim可能是miR-222-3p的靶点。
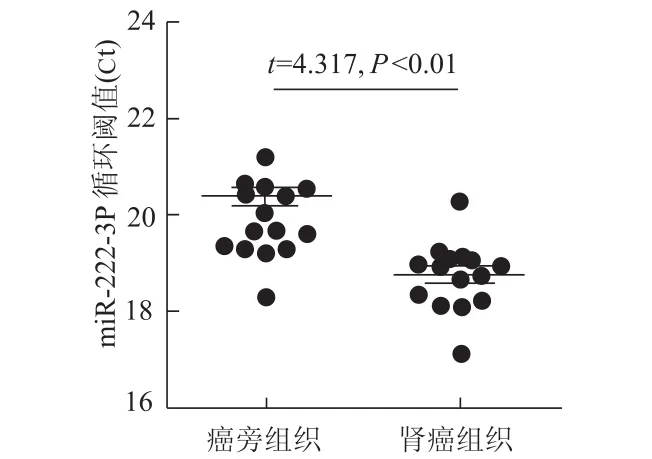
图1 qRT-PCR检测肾细胞癌组织和癌旁组织中m iR-222-3p的表达水平
为验证Bim是miR-222-3p直接作用的靶基因,我们克隆了包含miR-222-3p结合位点的 Bim 3′-UTR序列,并将该序列插入到携带荧光素酶报告基因的质粒中,然后在人胚肾细胞293T进行了荧光素酶报告基因实验。结果显示,与miR-NCmimic和空载β-gal相比,转染 miR-222-3p mimic和含有 Bim的3′-UTR区域的质粒后,荧光强度明显降低(P<0.01)。为进一步验证miR-222-3p对含Bim 3′-UTR区的荧光活性的抑制是由于与该位点的结合所致,我们将Bim的3′-UTR区序列AUGUAGCA突变为UACAUCGA。同上述的转染方法,同时转染含有Bim的3′-UTR区域突变体质粒和化学合成的miR-222-3p mimic。结果显示,与对照相比,荧光素酶活性没有变化(图3)。上述结果证明miR-222-3p通过特异性地识别并结合Bim的3′-UTR区域靶向调节Bim表达。
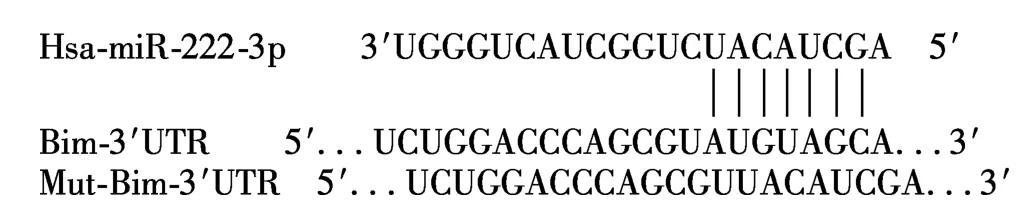
图2 m iR-222-3p与Bim m RNA靶位点配对示意图
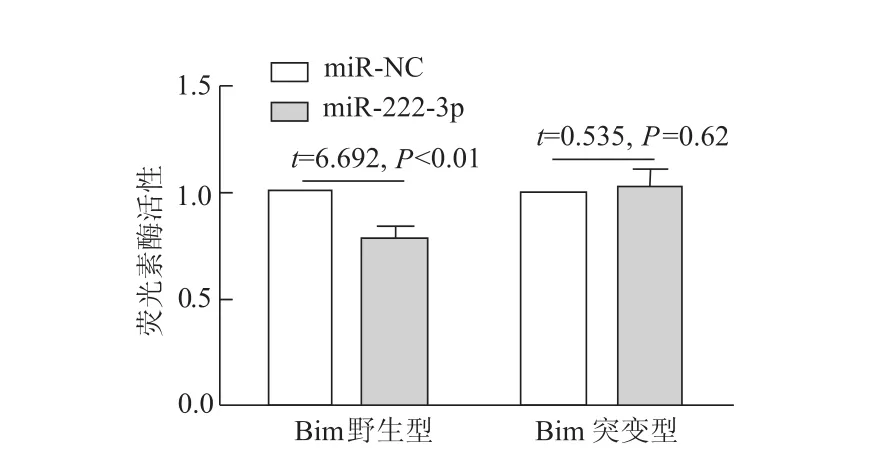
图3 荧光素酶活性检测
2.3 Bim蛋白在肾细胞癌组织中表达明显下降
免疫组化结果显示,癌旁组织可见大量棕黄色颗粒,Bim蛋白表达强;癌组织中则分布少量或不可见的棕黄色颗粒,Bim蛋白表达弱(图4);光密度分析结果显示,癌组织与癌旁组织之间Bim蛋白表达差异有统计学意义(P<0.01)。蛋白质印迹结果显示,与癌旁组织相比,癌组织中Bim蛋白的表达明显减低(P<0.01,图5)。说明 Bim蛋白在肾细胞癌组织中表达下调,这与miR-222-3p的表达水平相反。
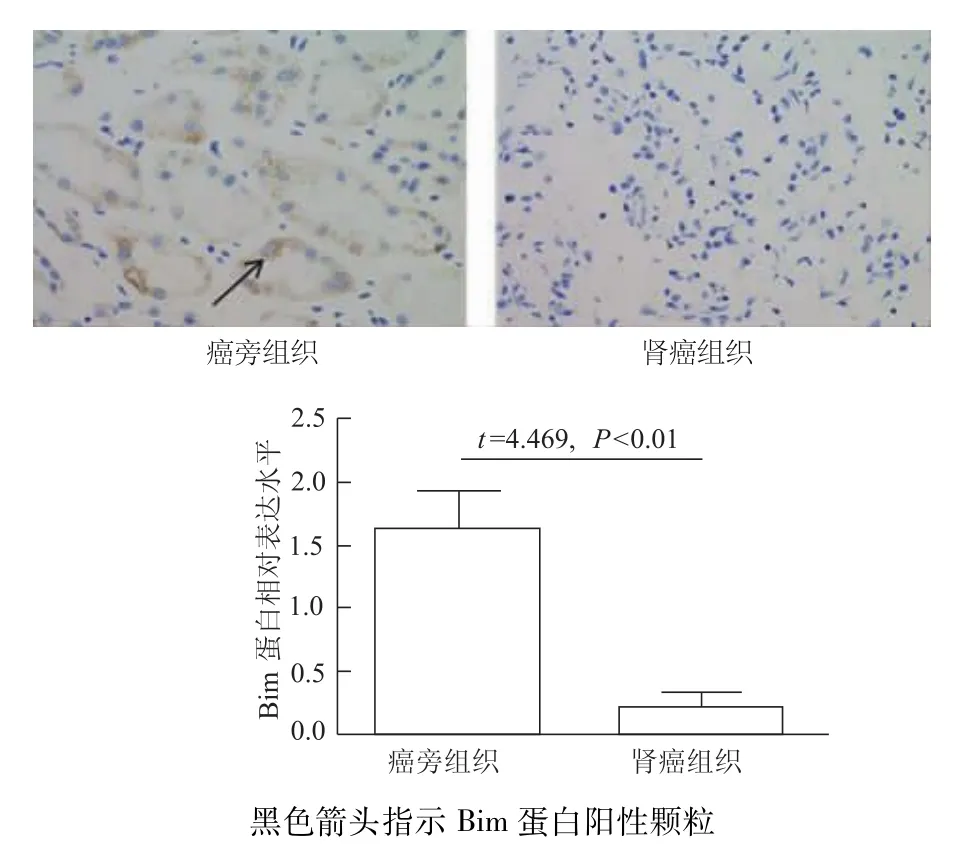
图4 免疫组化检测肾癌组织Bim蛋白表达(×200)
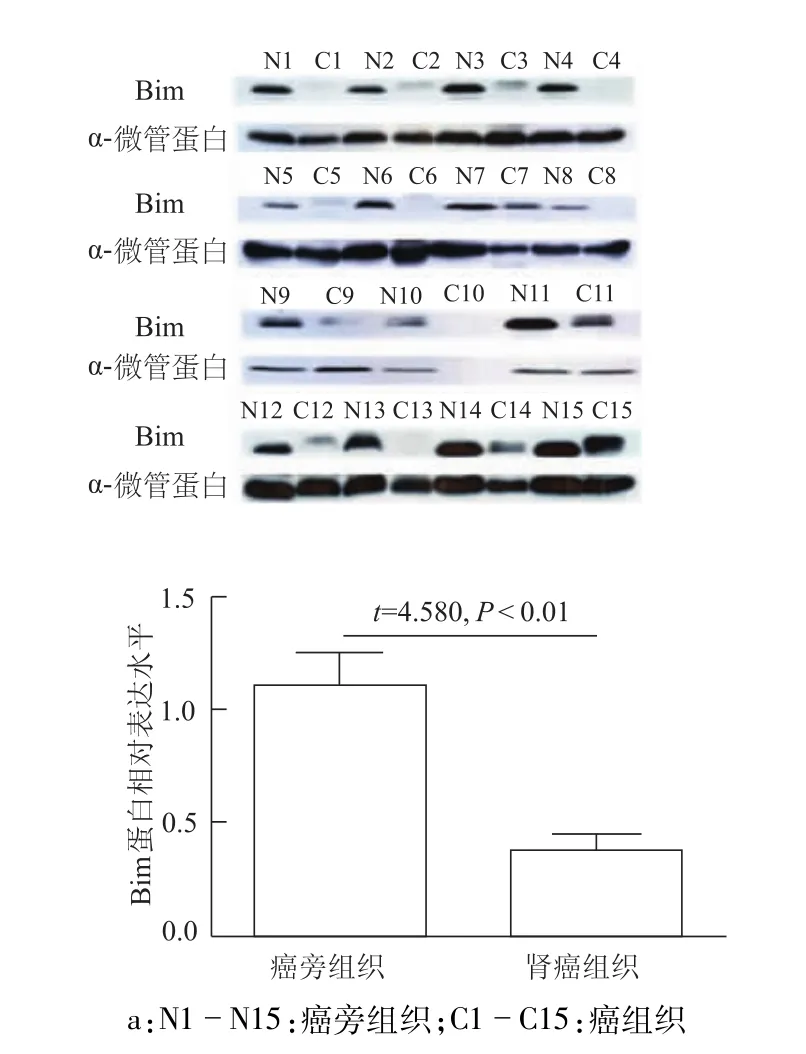
图5 蛋白质印迹检测肾癌组织Bim蛋白表达
2.4 miR-222-3p降低769-P细胞Bim蛋白的表达
为进一步证实miR-222-3p对Bim的负向调控作用,在769-P细胞瞬时过表达miR-222-3p后,发现Bim蛋白水平明显下调(图6),而Bim mRNA水平无明显变化(图7),提示miR-222-3p对Bim的调控是经典的转录后水平调控。
2.5 miR-222-3p降低769-P细胞的凋亡水平
流式细胞术检测结果显示,与转染 miR-NC mimic相比,转染miR-222-3p mimic后769-P细胞凋亡水平明显下降(图8)。
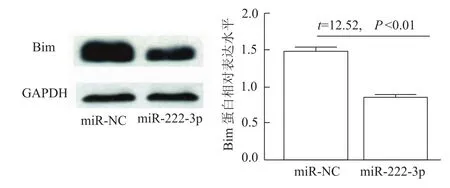
图6 瞬时过表达m iR-222-3p后769-P细胞Bim蛋白表达
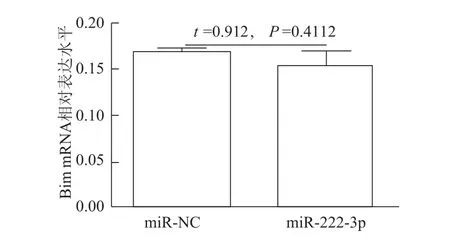
图7 瞬时过表达m iR-222-3p后769-P细胞Bim mRNA表达
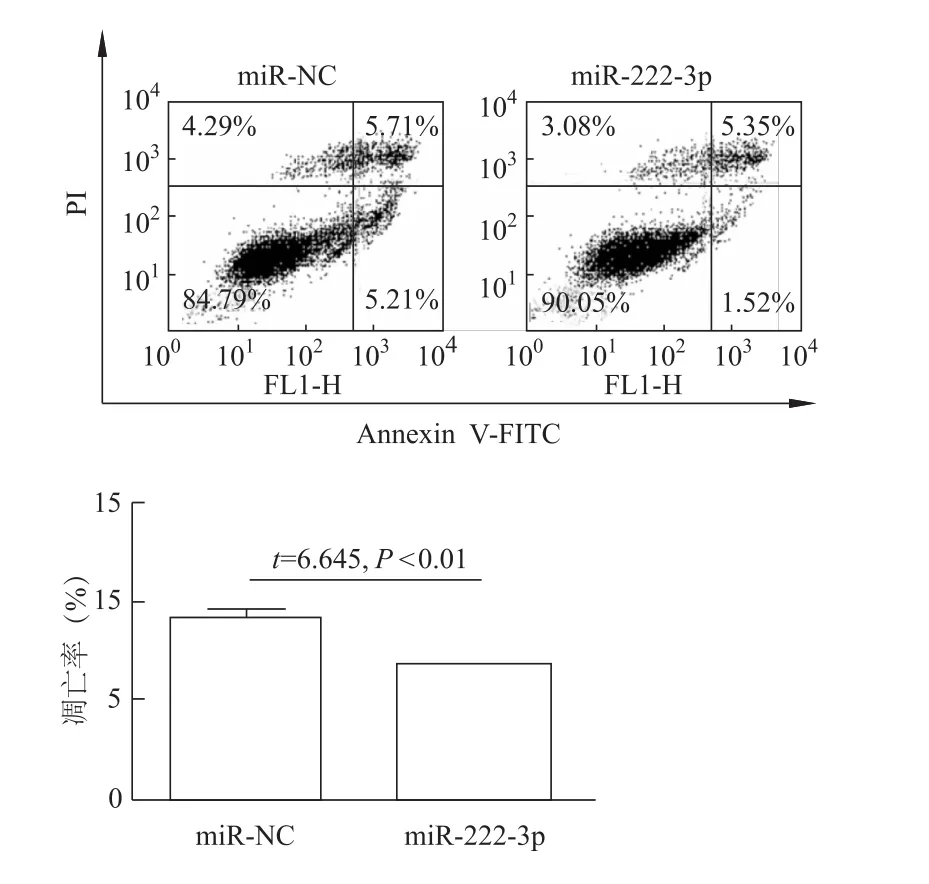
图8 Annexin V/PI染色法检测769-P细胞的凋亡水平
3 讨论
近年来对肾细胞癌相关miRNA差异性表达的研究揭示,miRNA与肾细胞癌密切相关,并在肾细胞癌发生发展中发挥重要的生理病理功能。Arai等[16]发现miR-10a-5p的低表达、纺锤体和着丝粒相关蛋白1(SKA1)的高表达与肾细胞癌患者的总生存率显著相关。进一步实验结果表明miR-10a-5p不仅可以下调SKA1的过表达,而且与肾细胞癌的发生和临床酪氨酸激酶抑制剂治疗抵抗紧密相关。我们课题组研究发现miR-28-5p通过抑制RAP1B(Ras相关的小 GTP结合癌蛋白)表达并影响RAP1B下游MAPK信号通路中的两种激酶的活化对肾细胞癌的发生起促进作用[17]。研究报道miR-222-3p在肾透明细胞癌患者血浆中表达水平升高,是一个促癌miRNA[8],但其在组织中的表达尚未见报道。本研究结果显示肾细胞癌组织中的miR-222-3p表达水平明显高于癌旁组织,进一步说明miR-222-3p在肾细胞癌发生发展中起促进作用。
miR-222-3p的生理病理功能并不完全清楚。有报道显示,miRNA-19b/221/222可通过下调过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)的水平促进动脉粥样硬化的形成,显示miR-222-3p参与病理情况下血管结构变化的过程[18]。Nardelli等[19]通过芯片技术检测肥胖妊娠和非肥胖妊娠妇女羊膜间质干细胞中多个miRNA的表达,发现miR-138/miR-222在肥胖妊娠妇女中高表达,这一结果提示可以通过改变饮食结构调整羊膜干细胞中miRNA的表达水平,为新生儿肥胖及肥胖相关代谢紊乱疾病提供新的治疗思路。Terasawa等[12]则发现miR-222与PC12细胞凋亡有关。
Bim是Bcl-2家族中BH3-only亚家族的一员,是一种重要的促凋亡蛋白。研究表明Bim表达的缺失与多种肿瘤的不良预后有关。表皮生长因子受体(EGFR)酪氨酸激酶抑制剂是一种用来治疗有EGFR突变的晚期非小细胞肺癌患者的药物,Zhao等[20]发现Bim缺失使其药效降低。Maimaiti等[21]发现Bim表达缺失与乳腺癌尤其是luminal A型乳腺癌患者不良预后有关。Zantl等[22]发现Bim的丢失与肾细胞癌化疗抵抗有关。这些研究充分说明Bim是一个重要的肿瘤抑制因子。本研究首先通过生物信息学方法发现miR-222-3p与Bim mRNA的3′-UTR有结合位点,并通过荧光素酶报告实验证实miR-222-3p可以直接作用于Bim的3′-UTR序列。同时应用免疫组化和蛋白质印迹技术检测了肾细胞癌组织中Bim蛋白表达情况,两者结果均显示Bim蛋白在肾细胞癌组织显著降低,这与miR-222-3p的表达水平相反。进一步使用转染技术实现769-P细胞过表达miR-222-3p,检测769-P细胞Bim蛋白及mRNA的变化,证实miR-222-3p对Bim的调节是经典的转录后调控。凋亡实验结果进一步说明miR-222-3p可以降低769-P细胞的凋亡水平,对肿瘤发生发展起促进作用。
综上所述,本实验结果揭示miR-222-3p是肾细胞癌中一个重要的促癌基因,通过下调抑癌基因Bim的表达抑制肾癌细胞的凋亡,参与肾细胞癌的发生发展。miR-222-3p/Bim轴为治疗肾细胞癌提供了新思路。
[1]Siegel RL,Miller KD,Fedewa SA,et al.Colorectal cancer statistics[J].CA Cancer JClin,2017,67(10):177-193.
[2]Ebert MS,Sharp PA.Roles formicroRNAs in conferring robustness to biological processes[J].Cell,2012,149(3):515-524.
[3]Wolfson B,Eades G,Zhou Q.Roles ofmicroRNA-140 in stem cell-associated early stage breast cancer[J].World JStem Cells,2014,6(5):591-597.
[4]Mo ZH,Wu XD,Li S,et al.Expression and clinical significance ofmicroRNA-376a in colorectal cancer[J].A-sian Pac JCancer Prev,2014,15(21):9523-9527.
[5]Stokowy T,Eszlinger M,Swierniak M,et al.Analysis options for high-throughput sequencing in miRNA expression profiling[J].BMC Res Notes,2014,7:144.
[6]Quintavalle C,Garofalo M,Zanca C,et al.miR-221/222 overexpession in human glioblastoma increases invasiveness by targeting the protein phosphate PTPmu[J].Oncogene,2012,31(7):858-868.
[7]Ying X,Wu Q,Wu X,et al.Epithelial ovarian cancersecreted exosomal miR-222-3p induces polarization of tumor-associated macrophages[J].Oncotarget,2016,7(28):43076-43087.
[8]Teixeira AL,Ferreira M,Silva J,etal.Higher circulating expression levels ofmiR-221 associated with poor overall survival in renal cell carcinoma patients[J].Tumour Biol,2014,35(5):4057-4066.
[9]Khella HW,Butz H,Ding Q,et al.miR-221/222 are involved in response to sunitinib treatment in metastatic renal cell carcinoma[J].Mol Ther,2015,23(11):1748-1758.
[10]Letai A,Bassik MC,Walensky LD,et al.Distinct BH3 domains either sensitize or activatemitochondrial apoptosis,serving as prototype cancer therapeutics[J].Cancer Cell,2002,2(3):183-192.
[11]Adams JM,Cory S.The Bcl-2 apoptotic switch in cancer development and therapy[J].Oncogene,2007,26(9):1324-1337.
[12]Terasawa K,Ichimura A,Sato F,et al.Sustained activation of ERK1/2 by NGF inducesmicroRNA-221 and 222 in PC12 cells[J].FEBS J,2009,276(12):3269-3276.
[13]Fuhrman SA,Lasky LC,Limas C.Prognostic significance ofmorphologic parameters in renal cell carcinoma[J].Am JSurg Pathol,1982,6(7):655-663.
[14]Zhang H,Duan J,Qu Y,et al.Onco-miR-24 regulates cell growth and apoptosis by targeting BCL2L11 in gastric cancer[J].Protein Cell,2016,7(2):141-151.
[15]Kosemehmetoglu K,Vrana JA,Folpe AL.TLE1 expression is not specific for synovial sarcoma:awhole section study of 163 soft tissue and bone neoplasms[J].Mod Pathol,2009,22(7):872-878.
[16]Arai T,Okato A,Kojima S,et al.Regulation of spindle and kinetochore-associated protein 1 by antitumor miR-10a-5p in renal cell carcinoma[J].Cancer Sci,2017,108(10):2088-2101.
[17]Wang C,Wu C,Yang Q,et al.miR-28-5p acts as a tumor suppressor in renal cell carcinoma formultiple antitumor effects by targeting RAP1B[J].Oncotarget,2016,7(45):73888-73902.
[18]Xue Y,Wei Z,Ding H,et al.MicroRNA-19b/221/222 induces endothelial cell dysfunction via suppression of PGC-1αin the progression of atherosclerosis[J].Atherosclerosis,2015,241(2):671-681.
[19]Nardelli C,Granata I,Iaffaldano L,etal.miR-138/miR-222 overexpression characterizes themiRNome of amniotic mesenchymal stem cells in obesity[J].Stem Cells Dev,2017,26(1):4-14.
[20]Zhao M,Zhang Y,CaiW,et al.The Bim deletion polymorphism clinical profile and its relation with tyrosine kinase inhibitor resistance in Chinese patients with nonsmall cell lung cancer[J].Cancer,2014,120(15):2299-2307.
[21]Maimaiti Y,Dong L,Aili A,et al.Bim may be a poor prognostic biomarker in breast cancer patients especially in those with luminal A tumors[J].Cancer Biomark,2017,19(4):411-418.
[22]Zantl N,Weirich G,Zall H,et al.Frequent loss of expression of the pro-apoptotic protein Bim in renal cell carcinoma:evidence for contribution to apoptosis resistance[J].Oncogene,2007,26(49):7038-7048.
