复方半边莲注射液对阿霉素肾病大鼠模型的药理学作用研究
2018-01-18孙嘉婧刘勇马岩马伟
孙嘉婧,刘勇,马岩,马伟*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.哈尔滨商业大学管理学院,黑龙江 哈尔滨 150028)
肾病综合征(nephritic syndrome,NS)是由多种肾脏疾病导致肾脏基底膜的通透性增加,以大量蛋白尿、低蛋白血症、高脂血症为该病状的主要特征,病程很长并且容易反复发作[1]。阿霉素能够损伤肾细胞,能从DNA分子水平上直接干预足突细胞蛋白质合成,造成足突细胞的形态学发生改变[2]。用药几天就可以导致肾脏发生严重的损伤是阿霉素肾病的模型主要特征,并且时段稳定、能够预料且死亡率低[3]。该模型和人类的慢性蛋白尿肾脏疾病非常类似,同时该模型在大鼠和小鼠上情况也十分接近[4],因此已被广泛使用[5-6]。有研究表明,SD大鼠、Wistar大鼠及BALB/c小鼠对造模药物非常敏感,且具有出现模型相应特征迅速持续与稳定的特点,并且这几种动物易于培养,生存能力又强,在阿霉素肾病模型中被广泛使用[7-9]。
在肾病治疗领域中,细胞毒性药物、糖皮质激素与免疫抑制剂为目前采用的主要治疗药物[10]。但是这几种治疗药物通常具有很大毒副作用,并且该方法疗程很长,不良反应偏多。本实验选择由半边莲、半枝莲及白花蛇舌草三种药材组成的复方半边莲注射液为研究对象,其通常多用于多发性疖肿,扁桃体炎以及乳腺炎等相关疾病治疗,也作为肿瘤化疗用药[11]。近年来有相关文献研究表明,复方半边莲注射液对小儿支气管炎、肺炎、腹泻以及成人呼吸道感染均有很好的治疗作用[12-13],但是暂未发现其对肾病的相关治疗作用报道。通过对其在阿霉素肾病模型的药效学作用分析,能够为该复方在后续临床研究中的应用提供新的思路。
1 仪器与试剂
全自动生化仪(日本日立公司);代谢笼(安徽正华生物仪器设备);复方半边莲注射液(160901,河南同源制药公司);注射用还原型谷胱甘肽(16232360,重庆药友制药公司);水合氯醛(上海鼓臣生物);尿蛋白试纸(20160702,广州市珠江生化试剂);注射用盐酸多柔比星(16000311,海正辉瑞制药)。
2 实验方法
2.1 实验动物及分组
4~6周龄SD雄性大鼠,体质量200~220 g,48只,采购于青岛大任富城畜牧公司(scxk鲁2014.0001,青岛市实验动物中心),饲养于黑龙江中医药大学中药研究院动物房,自由饮水,普通饲料喂养,室温21~23℃,湿度55%~65%,适应性饲养1周后,随机分为6组,每日大鼠进食前观察大鼠精神状态,并且每周称量一次体质量。
于实验前,以尿蛋白试纸测定各大鼠尿蛋白情况,确定测定结果为阴性后,按照各分组情况进行后续实验,分组情况如下:
空白组:大鼠经尾静脉一次性注射等量盐酸阿霉素生理盐水,其他组2周造模结束后,按中剂量组剂量每日给予等量蒸馏水腹腔注射。
模型组:大鼠经尾静脉一次性注射盐酸阿霉素的给药剂量为6.5 mg/kg,期间自由饮水进食,2周后造模完成,按中剂量组剂量每日给予等量蒸馏水腹腔注射。
复方半边莲注射液低剂量组:同模型组造模后,大鼠每日腹腔注射复方半边莲注射液0.417 ml/kg,连续给药3周。
复方半边莲注射液中剂量组:同模型组造模后,大鼠每日腹腔注射复方半边莲注射液0.834 ml/kg,连续给药3周。
复方半边莲注射液高剂量组:同模型组造模后,大鼠每日腹腔注射复方半边莲注射液1.668 ml/kg,连续给药3周。
注射用还原型谷胱甘肽(阳性药)[14]组:同模型组造模后,大鼠每日腹腔注射注射用还原性谷胱甘肽170 mg/kg,连续给药3周。
2.2 建立大鼠阿霉素肾病模型
SD大鼠饲养适应1周后,除空白组外的模型组、阳性药组、复方半边莲注射液低、中、高剂量组,以一次性尾静脉注射阿霉素的方法使大鼠形成肾病综合征。具体操作如下:以注射用水20 ml将一瓶阿霉素(10 g)完全溶解,浓度稀释至1 g/ml。按给药剂量6.5 mg/kg缓慢推注阿霉素,静注完后再静推0.9% Nacl 1 ml,避免阿霉素渗透至皮下,导致烂尾现象发生,影响实验结果。静注结束后,各组大鼠均自由进水进食。
2.3 尿液及血液的采集
造模前一天及其后的每周均将各组大鼠置于清洁好的代谢笼中,收集24 h内的尿液,禁食可自由饮水。尿液收集完成后,取部分尿液置于2 mL EP管中,-80℃冷冻保存。剩余尿液以蛋白尿定性试纸进行定性检测,造模前进行比较,若由阴性或者中性结果变为阳性,则视为造模成功。为能够更加准确的造模结果,亦以酶联免疫法对24 h尿蛋白的含量进行测定。
待6周实验结束后,配制浓度为60 g/l的水合氯醛溶液,每只大鼠按6 ml/kg的剂量进行腹腔注射进行麻醉,待麻醉成功后,于肝门静脉取血5 ml,离心(3 500 r/min)10 min,取上清,冻存于-80℃冰箱待测。
2.4 数据分析

3 实验结果
3.1 大鼠活动状态
空白组大鼠饮食、饮水及活动未见与平时有何明显不同,精力较别组更为旺盛;模型组大鼠均出现睾丸水肿,前后爪水肿,精神状态萎靡同时伴有不同程度的饮水量、尿量减少,体毛无光泽;各给药组的这些情况均得到了不同程度的改善,其中以阳性药物组和半边莲注射液高剂量组的情况改善最为明显,整体状况最为接近空白组大鼠。
3.2 大鼠体质量、尿量及24 h尿蛋白的比较
结果如表1可知,模型组于造模开始第2周,与空白组相比体质量显著减少,统计学分析显示其具有显著性差异(P<0.05或P<0.01);半边莲注射液低剂量组与同期模型组相比体质量体现出一定的增长趋势,但其差异不具有统计学意义;而阳性药组,半边莲注射液中、高剂量组在给药后与同期模型组相比体质量显著增加,差异具有统计学意义(P<0.05或<0.01)。
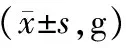
表1 造模及给药前后各组大鼠体质量比较
注:与空白组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01
结果如表2可知,模型组于造模开始第2周,与空白组相比尿量显著减少,统计学分析显示其具有显著差异(P<0.05);半边莲注射液低剂量组在给药后与同期模型组相比体尿量体现出一定的增长趋势,但差异不具有统计学意义;而阳性药组,半边莲注射液中、高剂量组在给药后与同期模型组相比尿量显著增加,差异具有统计学意义(P<0.05)。

表2 造模及给药前后各组大鼠24h尿量指标比较
注:与空白组相比,*P<0.05;与模型组相比,#P<0.05
结果如表3与表4可知,模型组于造模开始第2周,与同期空白组相比24 h尿蛋白量开始显著增多,统计学分析显示其具有显著差异(P<0.05或P<0.01);且时间越长大鼠24 h尿蛋白量越多,至给药第1周时出现大量蛋白尿;半边莲注射液低剂量组给药后与同期模型组相比,尿蛋白含量有小幅变化,但其差异不具有统计学意义;而阳性药组,半边莲注射液中、高剂量组在给药后与同期模型组相比24 h尿蛋白量增长趋势显著减缓,差异具有统计学意义(P<0.05或P<0.01)。

表3 造模及给药前后各组大鼠尿蛋白定性结果

表4 造模及给药前后各组大鼠24 h尿蛋白指标比较
注:与空白组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01
3.3 大鼠肾功能、血脂及血清蛋白指标的比较
结果如表5所示,与空白对照组比较,模型组ALB及TP含量(血清蛋白指标)显著减少,变化差异具有统计学意义(P<0.05或P<0.01);与模型组比较,各组含量均有不同程度的增加,差异具有统计学意义(P<0.05或P<0.01)。

表5 各组大鼠血清蛋白指标比较
注:与空白组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01
结果如表6所示,与空白对照组比较,模型组BUN及Cr含量(肾功能指标)显著减少,变化差异具有统计学意义(P<0.05或P<0.01);与模型组比较,各组含量均有不同程度的增加,差异具有统计学意义(P<0.05或P<0.01)。

表6 各组大鼠肾功能指标比较
注:与空白组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01
结果如表7所示,与空白对照组比较,模型组CHO及TG含量(血脂指标)显著增加,变化差异具有统计学意义(P<0.05或P<0.01);与模型组比较,各组含量均有不同程度的减少,差异具有统计学意义(P<0.05或P<0.01)。

表7 各组大鼠血脂指标
注:与空白组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01
4 讨论
本实验以阿霉素经尾静脉注射后造成的肾病大鼠为研究模型,分别从尿液、血液及组织等方面考察复方半边莲注射液对模型大鼠的药物作用效果如何,是否能够缓解并改善肾病模型大鼠的病理状态。
尿蛋白作为判定肾脏是否出现病理学变化的主要检测指标之一,在对尿液中尿蛋白进行定量及定性的双重测定后,初步确定该模型已造模成功后,继续对后续给药后的尿蛋白的含量进行监控发现,虽然低、中剂量组的药效并不十分明显,但高剂量及阳性药组可以明显降低尿液中尿蛋白的含量,表明其能够对肾脏起到一定的保护作用,对病变的肾脏起到治疗作用。同时,对血液中的血肌酐、尿素氮、总胆固醇、甘油三酯、总蛋白、血清白蛋白进行了考察,与模型组相比较,各指标均有明显改善,血清白蛋白及总蛋白含量均明显增多,其余指标明显减少,表明该药物能够起到改善肾功能、平衡血脂及提高血清内蛋白含量的作用,即对肾病模型有明确的药理作用,但是组内比较发现,低剂量给药时,效果不明显。
本实验研究结果揭示,复方半边莲注射液在肾病模型大鼠治疗方面的效果,虽然当其给药剂量在低及中剂量时效果并不十分明显,但是当达到高剂量时其作用效果与阳性药物相当,为后续其在临床研究中的应用提供了理论基础。
[1] 胡剑卓,邱细敏,江建锋,等.人工虫草多糖对阿霉素大鼠肾脏保护作用的实验观察[J].中医药导报,2015,21(11):16-18.
[2] Jeansson M,Bjorck K,Tenstad O,et al.Adriamycinalters glomerular endothelium to induce proteinuria[J].Nephrol,2009,20(1):114-122.
[3] Pippin JW,Brinkkoetter PT,Cormack-Aboud FC,et al.Inducible rodent models of acquired podocyte diseases[J].Am J Physiol Renal Physiol,2009,296(2):213-229.
[4] Weiss RB.The anthracyclines:will we ever find a better doxorubicin[J].Semin Oncol,1992,19(6):667-686.
[5] Demik SM,Hoogduijn MJ,de Bruin RW,et al.Pathophysiology and treatment of focal segmental glomer-ulosclerosis: the role of animal models[J].BMC Nephrol,2013,14:74-83.
[6] Takiue K,Sugiyama H,Inoue T,et al.Acatalasemicmice are mildly susceptible to adriamycin nephropathyand exhibit increased albuminuria and glomerulosclerosis[J].BMC Nephrol,2012,13:14-23.
[7] Deschenes G,Doucet A.Collecting Duct Na+/K+-ATPase Activity is correlated with urinary sodium excretion in rat nephrotic syndromes[J].Clin Exp Nephrol,2000,11(4):604-615.
[8] 魏骐骄,刘晓雅,武国红,等.线粒体分裂相关蛋白高表达参与阿霉素大鼠肾病模型蛋白尿的发生[J].肾脏病与透析肾移植杂志,2017,26(1):37-43.
[9] Cheng HF,Wang S,Jo YI,et al.Over expression of cyclooxy genase-2 predisposes to podocyte injury[J].Nephrol,2007,18(2):551-559.
[10] 王海燕.肾脏病学[M].3版.北京:人民卫生出版社,2009:418-954.
[11] 陈琼,王海燕,王伟.α-淀粉酶协同超声波法提取复方半边莲注射液工艺优化[J].信阳师范学院学报(自然科学版),2014,27(3):398-400.
[12] 石磊,姬志强,康文艺.复方半边莲注射液的临床应用[J].中国药房,2011,22(47):4508-4509.
[13] 吕辉文,许培玲.复方半边莲注射液治疗小儿急性呼吸道感染[J].福建医药杂志,2011,33(5):123-124.
[14] 谢雅清,梁晓美,叶伟霞.还原型谷胱甘肽的药理作用与临床应用研究进展[J].中国药业,2013,22(7):124-127.
