基于水通道蛋白的黄芩利水作用研究
2018-01-18陈平平张亚男高鑫王红玉刘树民
陈平平,张亚男,高鑫,王红玉,刘树民*
(1.黑龙江中医药大学中医药研究院,黑龙江 哈尔滨 150040;2.黑龙江中医药大学药物安全性评价中心,黑龙江 哈尔滨 150040)
黄芩古存今失的“逐水”功效研究是2014年“国家重点基础研究发展计划-基于利水功效的中药药性理论研究”的重要组成部分。2015版《中国药典》对黄芩性能及功效的论述为:“苦,寒。归肺、胆、脾、大肠、小肠经。清热燥湿,泻火解毒,止血,安胎”。但是从《本经》至清代以前的本草著作中,记载黄芩具有明确的“逐水”功效,例如《神农本草经》载:“黄芩主诸热黄疸,肠澼泄利,逐水,下血闭,恶创,恒蚀火疡”;《证类本草》载:“黄芩主诸热黄疸,肠澼泄痢,逐水下血闭,恶疮疽蚀火疡,疗痰热,胃中热,小腹绞痛,消谷,利小肠,女子血闭,淋露下血,小儿腹痛”。而近现代医著中则无此记载。黄芩“逐水”功效是被淘汰还是被遗漏,对这一功效是应该继承还是应该废除,成为本课题需要解决的科学问题之一。本实验拟通过建立大鼠水负荷模型,在观察黄芩引起大鼠尿量变化的同时,从对各脏器的水通道蛋白影响的角度剖析黄芩的利水作用,借此阐明黄芩古存今失的“逐水”作用的客观性,不仅能够在扩大黄芩临床使用范畴及指导临床用药等方面起到积极的作用,也可以更加全面的补充利水功效的药性理论研究的科学内涵。
1 实验材料
1.1 仪器与试剂
DG5033A酶标仪(南京华东电子集团医疗装备有限责任公司);AL204电子天平(梅特勒-托利多仪器有限公司);TGL-20M高速台式冷冻离心机(湖南湘仪实验室仪器开发有限公司);Elisa试剂盒(南京建成生物工程研究所,批号20161025)。
1.2 药材
黄芩饮片(河北承德药材有限公司,批号 20150623)经黑龙江中医药大学中药资源与开发教研室王振月教授鉴定为唇形科植物黄芩(ScutellariabaicalensisGeorgi)的干燥根,符合《中国药典》2015年版规定。取该批次黄芩600 g,第一次加10倍水煎煮1 h,第二次加8倍量水煎煮1 h,合并煎液,浓缩干燥,研成细粉备用。根据人的临床用量,大鼠的等效剂量为人体每日用药量的6.25倍,计算得出大鼠的给药量,黄芩低剂量组为3 g生药/kg,黄芩中剂量组为6 g生药/kg,黄芩高剂量组为12 g生药/kg。
1.3 实验动物
雄性SD大鼠60只,SPF级,体质量(200±20)g,SPF级,由黑龙江中医药大学实验动物中心提供,许可证号:[SCXK(黑)2015-004],室温(22±1)℃,相对湿度(65±5)%,实验动物自由摄食饮水。
2 实验方法
2.1 实验动物筛选及分组
将SD雄性大鼠预先置于代谢笼中1~2天,观察其自由饮水条件下尿量是否稳定。实验前禁食不禁水18 h,实验开始时轻压大鼠腹部,排尽膀胱内余尿,按25 ml/kg灌胃给予去离子水,形成水负荷,收集2 h内尿液,凡尿量超过40%水负荷者即为合格动物。
实验动物分组及处置,取合格大鼠40只,随机分为空白组、水负荷模型组、黄芩高、中、低剂量组,共5组,每组8只。将动物置于代谢笼中,各组大鼠均在每日上午9~10点按照10 ml/kg灌胃给予相应的试剂,连续3日,每天1次。记录每日饮水量、日间8 h尿量、夜间12 h尿量。第4日给药同前,实验前动物禁食不禁水12 h,实验过程中禁食禁水,给药1 h,各组大鼠腹腔注射生理盐水5 ml,同时灌胃给予生理盐水5 ml,实验动物给药完毕后,轻压动物腹部排尽膀胱内余尿,迅速放入代谢笼中,收集2 h尿量并记录,连续6 h。水负荷试验结束时,取各组大鼠的气管、肝脏、肾脏、大肠、小肠、胰腺、心脏、肺脏、唾腺,-80℃冰箱冻存。
2.2 相关指标的检测
取出之前冻存的脏器组织解冻后,剪碎,称取0.2 g,按照1:9的重量体积比,放入1.8 ml的生理盐水,加入玻璃匀浆器中,于冰上充分研磨,最后将匀浆液以4 000 r/min,离心10 min,依据酶联免疫试剂盒说明书检测心脏AQP1、大肠AQP2、肺AQP3、肺AQP4、小肠AQP4、肝AQP9、肾AQP2、气管AQP3、气管AQP4、唾腺AQP5、胰腺AQP3。
3 实验结果
3.1 黄芩对正常大鼠尿量及饮水量的影响
表1和图1~3结果所示,与空白组比较,各给药组干预后均出现不同程度的干预效果,其中黄芩中剂量组大鼠第3天日间8 h尿量和夜间12 h尿量显著性增加,差异具有统计学意义(P<0.05)。而且药物干预组的大鼠出现少动、脱毛的现象,部分大鼠还出现便溏甚至水样便现象。
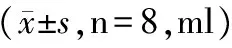
表1 药物对正常大鼠连续3天日间8 h、夜间12 h尿量及饮水量的影响
注:与空白组同期比较,★P<0.05,★★P<0.01

图1 黄芩对正常大鼠日间8h尿量的影响

图2 黄芩对正常大鼠夜间12 h尿量的影响
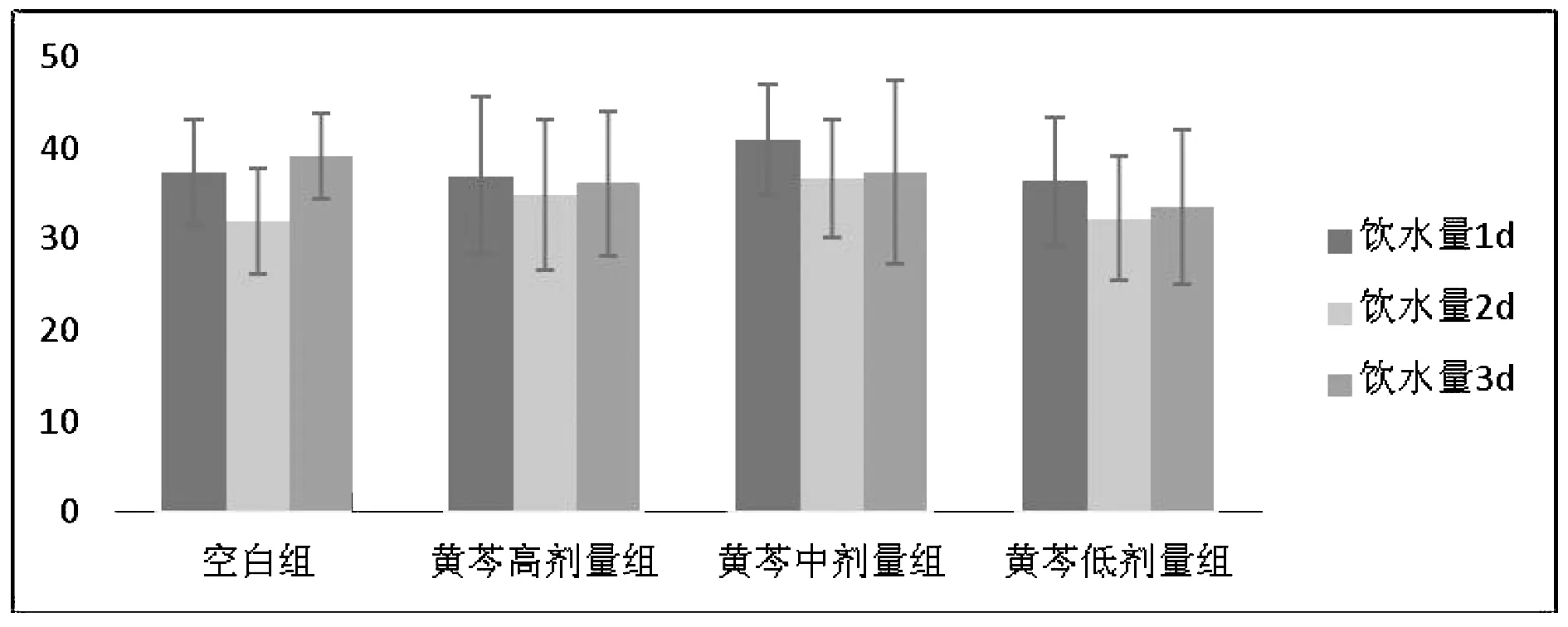
图3 黄芩对正常大鼠饮水量的影响
3.2 黄芩对水负荷模型大鼠不同时间段尿量的影响
如表2和图4~5结果所示,与空白组比较,模型组大鼠0~2 h、4~6 h及总尿量显著性降低,差异具有统计学意义(P<0.05);与模型组比较,黄芩高剂量组大鼠4~6 h尿量明显增加且差异具有统计学意义(P<0.05),黄芩中剂量组大鼠0~2 h、4~6 h及总尿量显著性增加,差异具有统计学意义(P<0.05),显示黄芩高、中剂量具有一定的利尿作用,当水负荷状态时,其利尿作用效果较明显而且持久。

表2 黄芩对水负荷模型大鼠不同时间段尿量的影响
注:与空白组同期比较,★P<0.05;与模型组同期比较,▲P<0.05
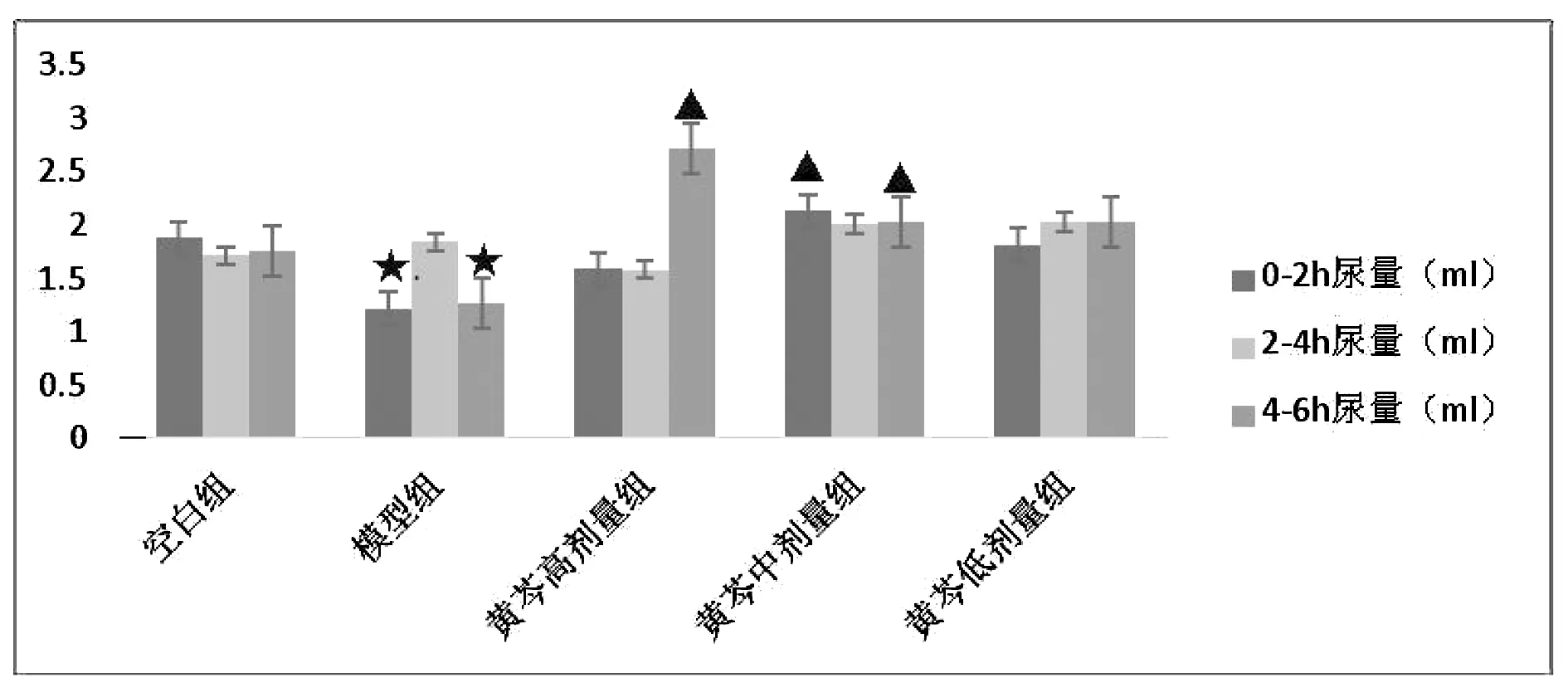
图4 黄芩对水负荷模型大鼠不同时间段尿量的影响

图5 黄芩对水负荷模型大鼠总尿量的影响
3.3 黄芩对水负荷大鼠水通道蛋白的影响
如表3和图6所示,模型组与空白组比较,大肠AQP2、肺AQP3、肺AQP4、小肠AQP4、肾AQP2、气管AQP3、气管AQP4、唾腺AQP5、胰腺AQP3蛋白表达含量显著性升高,且均具有显著性差异(P<0.05),心脏AQP1蛋白表达降低(P<0.05);给药干预后与模型组比较,黄芩高剂量组大鼠气管AQP3、气管AQP4、唾腺AQP5、胰腺AQP3蛋白表达均呈下调趋势,且差异具有统计学意义(P<0.05),黄芩中剂量组大鼠肺AQP3、气管AQP3蛋白含量明显降低且差异具有统计学意义(P<0.05),黄芩低剂量组大鼠肺AQP3、胰腺AQP3蛋白表达显著性降低(P<0.05)。由此可看出黄芩高剂量组有明显的通过对气管、唾腺、胰腺的水通道蛋白下调,中、低剂量组对肺的水通道蛋白下调,调控水负荷大鼠各脏器分泌相关体液,进而发挥利水作用。

表3 黄芩对水负荷大鼠水通道蛋白的影响
注:与空白组比较,★P<0.05;与模型组比较,▲P<0.05,▲▲P<0.01
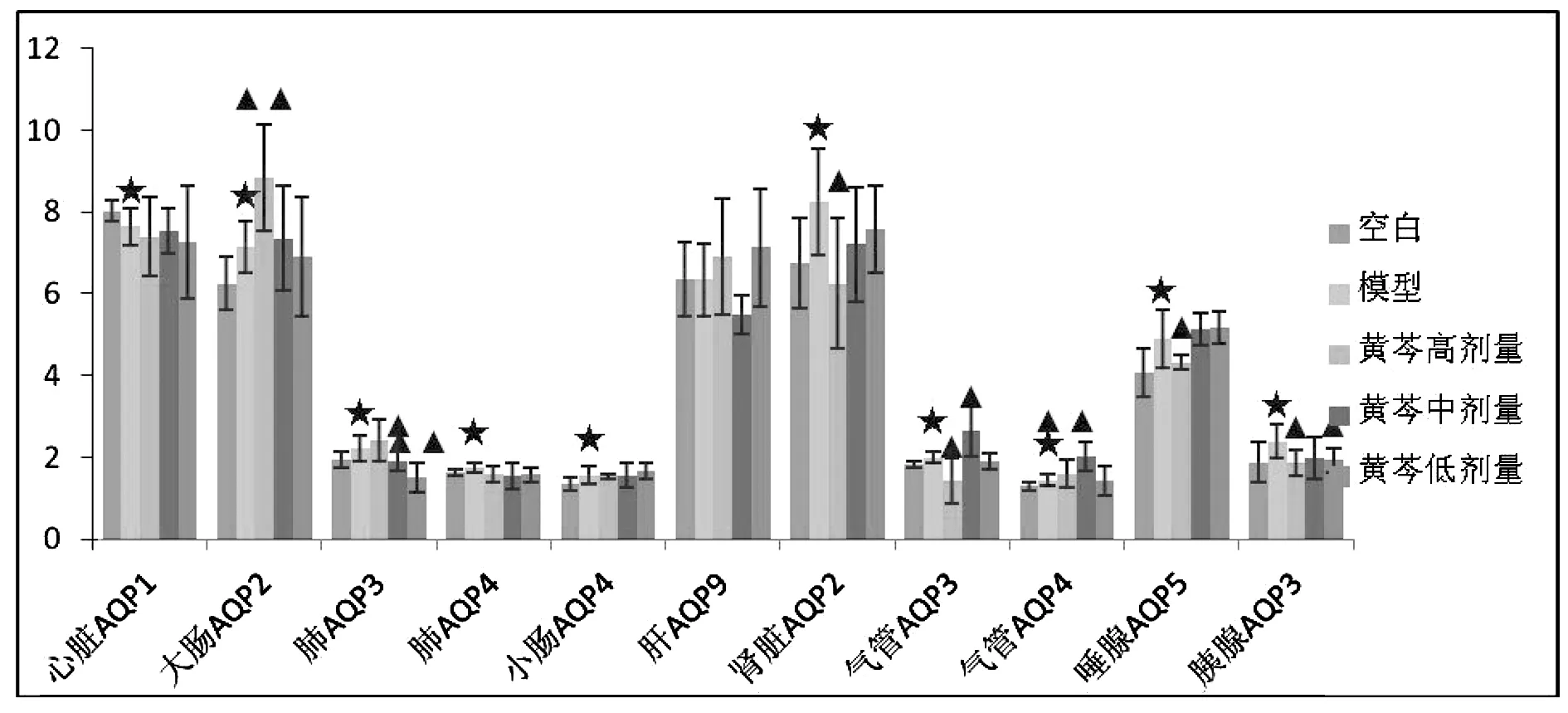
图6 黄芩对水负荷大鼠水通道蛋白的影响
4 讨论
在对古今文献的整理与研究中我们发现,黄芩的“逐水”功效可能是客观存在的[1]。尽管“逐水”作用不能简单等同于利尿作用,但药物的利尿作用却是最能直接反应其“逐水”的功效与特点。水液的代谢过程是生成、输布及排泄的复杂生理过程,需要多个脏腑协调配合才能完成。《素问·经脉别论篇》中对水的代谢进行了精要的概述:“饮入于胃,游溢精气,上输于脾,脾气散精,上归于肺,通调水道,下输膀胱,水精四布,五经并行”。水液的代谢涉及到了多脏腑如肺、脾、胃、肾、肝、小肠、大肠、膀胱、三焦等的功能[2],各脏腑的功能正常,三焦水道通利,气机运行畅通,则水液生成、输布、排泄正常,能够维持正常的生理功能。
现代研究中人们对于水在机体中的代谢过程了解一直不是很多,水的转运机制一直被解释为简单扩散,直到20 世纪 90 年代初有研究者发现了水通道蛋白[3-4]。水通道蛋白(aquaporin,AQP)是一类在机体水液转运和代谢中起重要作用的蛋白质分子家族,AquaPorins(AQPs)家族的发现为研究不同组织水分子的跨膜转运提供了分子生物学基础,是对水调节机制研究的新里程碑,多种AQP与某些临床疾病有着密切的关系,通过科学验证,迄今在哺乳动物体内发现至少存在 13 种水通道蛋(AQP0-12)分子[5-6]。肾脏作为机体的泌尿器官,主要分布AQP1和AQP2,参与原尿形成中滤过、重吸收等重要生理过程[7]。肺脏水通道蛋白目前已证实分布于肺组织内的AQP有4种(AQP1、AQP2、AQP3、AQP5),主要位于肺毛细血管内皮细胞、肺泡型上皮细胞和气道上皮细胞膜上,参与这些细胞的水转运。肝脏中水通道蛋白AQP9主要是作用肝硬化,研究表明肝硬化是以星形胶质细胞分泌的I型胶原蛋白的沉积为特征[8-9],AQP9是重要的水通道蛋白,介导细胞凋亡开始和发展过程中水的丢失。AQP与人体泌尿、消化、呼吸及中枢神经系统的功能密切相关。
现代医学认为,水在体内的转运和代谢要通过AQP,可见津液代谢与AQP 密切相关,而且AQP在肺、消化系统和肾都有广泛表达。可见,水通道蛋白与水代谢关系密切,与中医理论的肺、脾、肾等脏器相关。近年来,有关AQP在脾胃湿热、脾胃湿阻、湿阻中焦等证候方面的作用受到越来越多的重视[10],并有望成为相关疾病临床治疗的新靶点。此外,深入研究 AQP 的作用,可以更好的解释痰、饮、水、湿等病理变化的机制。因此,AQP 可以成为诠释“利水中药”发挥其功效机制的一个新的靶分子,通过“津液代谢”这一关键环节,探讨 AQP 的变化与中药“利水”功效的内在联系,还可以对“利水”这一作用进行量化研究,因而具有重要的理论与临床意义[11]。
本研究结果表明,通过对正常大鼠以及水负荷模型大鼠尿量研究发现,黄芩可以不同程度的改变正常大鼠以及水负荷大鼠尿量,显著性增加大鼠不同时间段尿量,由此推测出黄芩具有很好的利尿作用,当水负荷状态时,其利尿作用效果明显而且持久。实验数据显示,水负荷模型组可显著升高脏器中水通道蛋白水平,与模型组比较,黄芩高、中、低剂量组干预后,均表现出不同程度的干预效果,其中黄芩高剂量组可显著性抑制气管AQP3、气管AQP4、唾腺AQP5、胰腺AQP3等蛋白表达,黄芩中、低剂量组明显降低肺AQP3、气管AQP3、胰腺AQP3蛋白含量,说明黄芩可以通调水道从而抑制了机体对水的重吸收作用,起到利水作用。由此可以看出,黄芩高、中、低剂量有明显的通过对气管、胰腺以及肺、唾腺水通道蛋白下调,调控水负荷大鼠各脏器分泌相关体液,进而发挥利水作用。在实验过程中我们发现,给予黄芩后,大鼠出现不同程度的便溏症状,高剂量组表现更为明显。黄芩性寒味苦,根据中医学理论,当大量给予苦寒药物时,可能会中伤脾胃,导至脾胃运化水液的功能异常,引起溏泻、倦怠等症状。在本实验中,当大量给予苦寒的黄芩时,部分水液通过大便排出体外。
根据以上的实验结果,推测黄芩可以在一定程度上增加生理状态下大鼠的尿量,为黄芩“逐水”功效提供了佐证。而对于黄芩干预病理状态下大鼠的水液代谢的实验研究,是黄芩“逐水”功效的重要体现。本课题将对心源性水肿、肝腹水等不同病理模型下的黄芩利水作用进一步深入研究。
[1] 苑艺蕾,汪娜,韩贞爱,等.黄芩“逐水”功效的文献学考证[J].中医药信息,2014,31(6):41-43.
[2] 刘志杰.伤寒论师承课堂实录[M].北京:人民军医出版社,2009:12.
[3] Preston GM,Carroll TP,Guggino WB,et al.Appearance ofwater channels in Xenopus oocytes expressing red cell CHIP28protein[J].Science,1992,256(5055):385-387.
[4] Benga G.Birth of water channel proteins—the aquaporins[J].Cell Biol Int,2003,27(9):701-709.
[5] 郭昊,李学军.细胞膜上的水通道—2003年诺贝尔化学奖工作介绍[J].生理科学进展,2007,38(3):283-289.
[6] 王永军,李坤正,肖宗宇.水通道蛋白4的研究进展[J].中国医学创新,2016,13(26):129-131.
[7] 邹旭,吴焕林.邓铁涛教授治疗充血性心力衰竭经验选粹[J].中医药学刊,2004,22(4):583.
[8] Friedman SL.Hepatic stellate cells:protean,multifunctional,andenigmatic cells of the liver[J].Physiol Rev,2008,88(1):125-172.
[9] Friedman SL.Hepatic fibrosis overview[J].Toxicology,2008,254(3):120-129.
[10] Li H,Lee S,Jap BK.Molecular design of aquaporin-1 waterchannel as revealed by electron crystallography[J].Nature Structural &Molecular Biology,1997,4(4):263.
[11] 王鹏程,赵珊,王秋红,等.利水中药功效发挥与水通道蛋白之间的关系[J].中国中药杂志,2015,40(12):2272-2277.
