桦褐孔菌醇提物对几种消化系统恶性肿瘤的影响
2018-01-18王蔚周忠光刘旭王晓璐费洪新李宝龙韩玉生仲丽丽王金涛李冰乔羽
王蔚,周忠光*,刘旭,王晓璐,费洪新,李宝龙,韩玉生,仲丽丽,王金涛,李冰,乔羽
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江儒泰有限责任公司,黑龙江 哈尔滨 150000;3.齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
肿瘤的危害众所周知,其中消化系统恶性肿瘤在全部恶性肿瘤的发病及死亡中都占据前列,胃癌是中国恶性肿瘤发病率的第二位,死亡率第三位[1],而肝癌、胰腺癌均预后极差。消化系统肿瘤的治疗一直是医学工作的重点,而中草药的扶正祛邪功效可在肿瘤治疗中发挥重大作用。桦褐孔菌(Inonotus obliquus)是一种具有多种药用价值的中草药,由文献可知,上世纪六七十年代IO醇提取物被用来治疗恶性肿瘤,表现出效果佳,毒性小[2]等特点。近年的国内外相关研究资料显示,桦褐孔菌在抗肿瘤方面有良好效果[3-5],但抗消化系统肿瘤方面的研究不够完善。本文通过研究桦褐孔菌醇提物对几种消化系统恶性肿瘤增殖和凋亡的影响,探讨其抗消化系统肿瘤的作用机制,为胃癌等消化系统恶性肿瘤的治疗提供新方法,新思路。
1 材料与方法
1.1 材料与试剂
桦褐孔菌(黑龙江儒泰有限责任公司提供);卡培他滨片(500 mg/片,上海罗氏制药有限公司);5-Fu(250 mg,上海旭东海普药业有限公司);RPMI-1640、胎牛血清(武汉Boster公司);MTT(美国Sigma公司);胰蛋白酶、DMSO、荧光染剂PI和Hoechst33342(Beyotime公司);鼠系MFC胃癌细胞(中科院上海细胞所);人系胃癌细胞株BGC-823、胃癌细胞株MGC-803、胰腺癌细胞Bxpc-3、肝癌细胞HepG-2(中科院上海细胞所)。
1.2 实验仪器
超净工作台(苏州净化设备有限公司);CO2培养箱(日本SANYO公司);低温冰箱(海尔公司);离心机(北京医用离心机厂LDZ5-2型);倒置显微镜、正置显微镜(日本OLYMPUS公司);电子天平(天津市天平仪器有限公司,MP-200A型);METTLER XS205微量分析天平(深圳市怡华新电子有限公司);UV-3600PLUS 分光光度计(日本岛津)。
1.3 实验动物
SPF级Balc小鼠,体质量15~20 g,购于辽宁长生生物技术有限公司,生产许可证号SCXK(辽)2015-0001,4~6周龄。自由摄食饮水,室温(25±2)℃,标准颗粒饲料喂养。
1.4 方法
1.4.1 桦褐孔菌醇提物的制备
称取桦褐孔菌1 kg,加70%乙醇10 L,加盖常温下浸泡24 h,加热回流提取3次,每次2 h,过滤,取上清液,弃去沉渣,烘干上清液,得桦褐孔菌醇提物粉剂。此次桦褐孔菌提取物由黑龙江中医药大学药学院提供。
1.4.2 体内肿瘤抑制增长试验
1.4.2.1 胃癌动物模型的建立
将体外培养生长良好的MFC细胞,调整浓度为2×106个/mL,在洁净条件下,酒精清洁后,接种于小鼠腋下,接种量为0.2 mL细胞悬液,注射部位略有隆起。
1.4.2.2 分组及给药
饲养24 h后,称重,按桦褐孔菌醇提物高、中、低剂量,随机分为6组,剂量确定依据查阅相关参考资料及预试所得[6-7],桦褐孔菌醇提物高、中、低剂量分别为4、2、1 mg/g,阳性对照组药物依据临床应用,选用抗消化道肿瘤常用口服药物卡培他滨片,剂量经人鼠等效剂量折算确定为0.5 mg/g,阴性对照组选用生理盐水,空白组不做处理,每组10只小鼠。
1.4.2.3 观察指标
0.3 mL连续灌胃7 d和10 d。停药次日处死动物,取肿瘤,称重,计算桦褐孔菌醇提物的抑瘤率。观察肝脏等脏器的肿瘤转移情况。

1.4.3 体外肿瘤试验
1.4.3.1 细胞培养
用90%的RPMI-1640,10%的胎牛血清和1%的双抗制作培养液,用于人系胃癌细胞株BGC-823、胃癌细胞株MGC-803、胰腺癌细胞Bxpc-3的培养;用90%的DMEM,10%的胎牛血清和1%的双抗制作培养液,用于人肝癌细胞HepG-2的培养。
1.4.3.2 MTT法测定药物对肿瘤的生长抑制情况
在各肿瘤细胞的对数生长期,用胰酶消化,调整细胞浓度为5×104个/mL,接种于96孔板,每孔100 μL,按桦褐孔菌醇提物给药浓度分为6组,每组8个复孔。查阅相关资料及预试[8-9],确定桦褐孔菌醇提取物各组剂量、阳性对照组药物5-Fu的浓度。桦褐孔菌醇提物高、中、低剂量分别为16、8和4 mg/mL,阳性对照药物5-Fu浓度为120 mg/mL。阴性对照组为生理盐水,空白组为PBS溶液,用于计算和纠正误差。接种后培养24 h,加药20 μL,继续培养24 h,然后每孔加入10 μL MTT溶液,继续培养4 h后弃上清,加入DMSO 150 μL,略微震荡,在酶标仪中测量吸光度,波长定为570 nm。
1.4.3.3 免疫荧光法观察IO醇提物对胃癌BGC-823细胞凋亡的影响
选取BGC-823对数期细胞,调整细胞浓度为1×105个/mL,接种于6孔板,每孔2.5 mL,分组及给药情况同上。实验依据带电荷的PI不能使活细胞染色,Hoechst33342使活细胞和凋亡细胞的DNA染色,PI产生红色荧光,Hoechst33342产生蓝色荧光。可在活细胞中先加入Ho染料,再进行PI染色,观察凋亡情况。用0.25%胰酶消化细胞,离心,去上清液,将其混悬于50 μL PBS溶液中。加入100 μL的PI,混匀,放于冰箱中染色30 min。再加入1.85 μL细胞固定液,混匀。加入50 μL Ho,混匀,放入冰箱中染色30 min。暗室中观察,可见典型凋亡细胞表现,细胞体积小,呈圆形。活细胞的Ho蓝色荧光最强,早期凋亡细胞的Ho蓝色应该较弱,也可有微弱PI红色荧光。晚期凋亡细胞PI红色荧光加强,坏死细胞PI红色荧光最强,而Ho蓝色荧光较弱。
1.5 统计学分析方法
用SPSS16.0软件处理所得的数据,检验水准α=0.05,P<0.05被认为有统计学意义。
2 结果
2.1 体内实验观察抑制肿瘤生长及转移效果
2.1.1 各组抑瘤率比较
不同时间桦褐孔菌醇提物对MFC接种小鼠的抑瘤率,结果如表1和表2所示。

表1 7 d给药的肿瘤抑瘤率比较
注:与空白组比较,*P<0.05

表2 10 d给药的肿瘤抑瘤率比较
注:与空白组比较,*P<0.05
经统计学分析,P<0.05,有统计学意义。认为桦褐孔菌醇提物对其有较好疗效,且随着浓度增加,疗效增加。
2.1.2 肿瘤细胞大小及转移灶情况
灌药10 d后的小鼠,肉眼观察肿瘤缩小较7 d给药组显著,肝脏等转移灶处肿瘤消失,证明桦褐孔菌醇提物抗肿瘤具有一定的时间依赖性,且对转移瘤也同样有效。
2.2 体外干预结果
2.2.1 MTT法观察体外抑制肿瘤增殖情况
由表3及图1可见,桦褐孔菌醇提物对4种恶性肿瘤均表现为良好直接抗肿瘤效果,且有浓度依赖性。IO醇提物对BGC-823胃癌细胞的抑制率高剂量组明显高于其他组,IO醇提物对MGC-803胃癌细胞中、低剂量组抑制率高于其他组,IO醇提物对肝癌HepG-2和胰腺癌Bxpc-3的抑制作用低于其他两组。

表3 4种消化道肿瘤的体外MTT结果

图1 MTT法肿瘤增殖抑制结果对比图
2.2.2 免疫荧光法观察BGC-823细胞凋亡情况
荧光图像显示,凋亡细胞随浓度呈增加趋势,图2为BGC-823细胞各组的荧光染色图片,与空白组对比,显示明显的促凋亡情况,且有一定的浓度依赖性。

高剂量组荧光图像
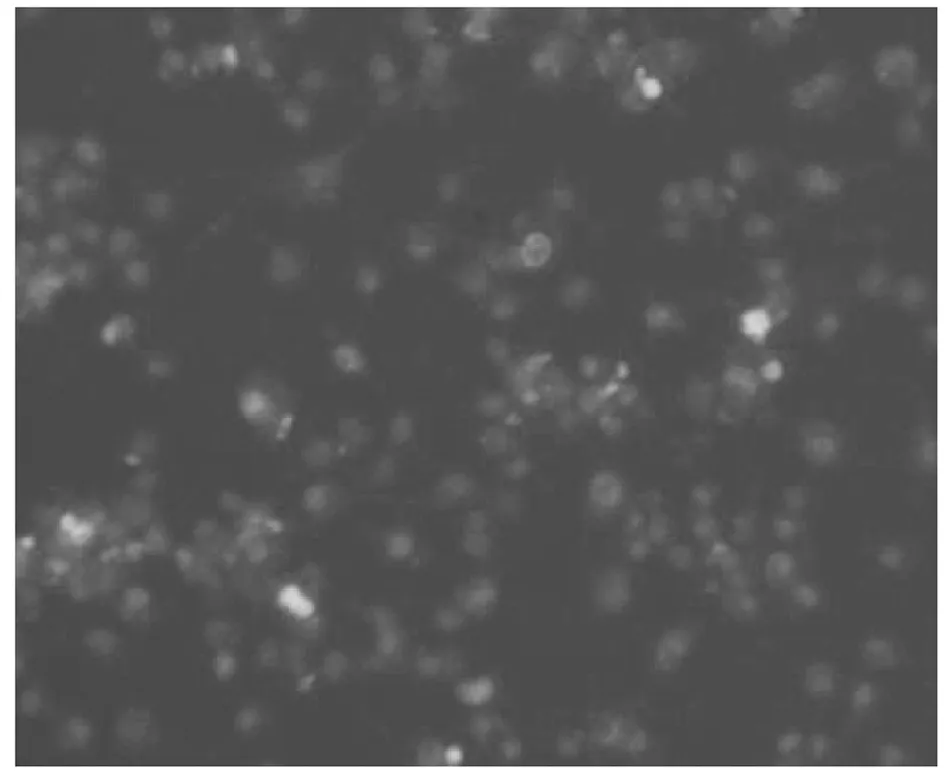
中剂量组荧光图像

低剂量组荧光图像

5-FU组荧光图像

空白组荧光图像

阴对组荧光图像
空白组和阴性对照组存活细胞最多,可见较多蓝色荧光染色,阳性对照组、高剂量组可见明显红色荧光,中剂量组和低剂量组的红色荧光呈递减趋势。
3 讨论
对肿瘤细胞增殖的促进和凋亡的抑制是肿瘤发生、发展的根本原因之一[10],因此有效的抗肿瘤药物应对肿瘤细胞具有明确的抑制增殖,促进凋亡作用[11]。在所有的恶性肿瘤中,消化道恶性肿瘤的治疗一直是医学关注的重点,其治疗的主要手段虽有所进步,但还是以手术和放化疗相互配合为主[12-14],给患者的生存质量带来极大破坏。在这方面,中医学提供了广泛的思路,近几年中医辅助治疗肿瘤非常具有成效[15],桦褐孔菌作为一种具有广泛民间使用基础,毒性小,用途广的中草药,是值得关注的。
本实验通过体内、体外两种途径,对比桦褐孔菌醇提物对于消化系统几种常见肿瘤的作用效果,推测其作用机制。证明桦褐孔菌醇提物对胃癌、肝癌、胰腺癌确实有效,但具有差异性。桦褐孔菌醇提物可以抑制肿瘤细胞增殖,且具有浓度-时间依赖性,并且对转移瘤有效。体内实验中,随着给药浓度的增加和给药时间的延长,表现为明显的抑瘤率增加;阴性对照组的抑瘤率为负数,从中医学角度讨论,可能为后天之本受损,引起机体免疫功能下调,导致肿瘤增长加速,也可从侧面推断出桦褐孔菌醇提物的毒性小和免疫正性调节作用。体外实验可见对肿瘤增殖的直接抑制作用,其中胃癌的抑制作用最佳;通过对胃癌BGC-823细胞凋亡的初步研究,证明其对胃癌凋亡有促进作用;通过与西药组对照,发现其抑制肿瘤增殖作用可能优于西药组,可见其促胃癌凋亡作用不弱于西药组。
本实验研究同时对照多组消化系统肿瘤在桦褐孔菌醇提物作用下的情况,可确定药物对消化系统恶性肿瘤的有效性及差异性,给临床用药的选择提供了资料。其明确的抗肿瘤功效和低毒性、调节免疫特点为胃癌等肿瘤的治疗打开了新思路,可解决西医疗法毒副作用大等缺点,同时为科学用药提供依据。由此可见,桦褐孔菌是一种具有临床应用价值的可推广药物。
[1] 季加孚.我国胃癌防治研究三十年回顾[J].中国肿瘤临床,2013,40(22):1345-1351.
[2] Shin YS,Tamai Y,Terazawa M.Chemical constituents of inonotus obliquus,A triterpene,3β-hydroxy-8,24-diene lanosta 21,23 lacton of romscretium[J].Eurasian Journal of Iorest Research,2000,1:43-50.
[3] 姚雪松,弥春霞.药用真菌桦褐孔菌的研究进展[J].吉林农业,2016,37(1):80-82.
[4] Hyun SL,Eun JK,Sun HK,Ethanol extract ofInonotus obliquus (Chaga mushroom) induces G1 cell cycle arrest in HT-29 human colon cancer cells[J].Nutrition Research and Practice,2015,9(2):111-116.
[5] 赵丽薇,钟秀宏,杨淑艳,等.桦褐孔菌醇对人宫颈癌Hela细胞凋亡和细胞周期的影响[J].中国药学杂志,2014,15(8):1310-1314.
[6] 王兰英,孟玲,黄芳,等.桦褐孔菌发酵液提取物小鼠体内抗H22肝癌的作用[J].中国食用菌,2010,29(8):37-39.
[7] 钟秀宏,赵芬琴,高宇,等.桦褐孔菌醇对人卵巢癌裸鼠移植瘤的抑制作用[J].中国妇幼保健,2015,30(20):3351-3353.
[8] 崔涛,钟秀宏,孙艳美,等.桦褐孔菌醇对人胃癌BGC-823细胞周期的影响及其机制[J].中国老年学杂志,2013,33(8):2691-2693.
[9] 王李俊,扬琴,王飞,等.桦褐孔菌醇诱导人乳腺癌MCF-7细胞凋亡的分子机制研究[J].中草药,2016,47(6):970-973.
[10] 崔进,张雅洁,张祥盛,等.病理学[M].北京:科学出版社,2007:88.
[11] 郑舒文,马建辉,尹世全.恶性肿瘤多学科综合诊疗模式的探索[J].中国肿瘤,2017,26(9):661-664.
[12] 胡祥.2014年第4版日本《胃癌治疗指南》更新要旨[J].中国实用外科学杂志,2015,35(1):16-19.
[13] 李焱,程朋.中晚期肝癌临床治疗进展[J].临床肝胆病杂志,2014,30(3):233-236.
[14] 丁雷,张平.胰腺癌治疗的研究进展[J].中国老年学杂志,2014,34(8):2298-2300.
[15] 郑伟达.中医肿瘤学[M].广东:广东高等教育出版社,2007:3.
