自杀行为中5-HT基因和GAD1基因的交互作用
2018-01-10黄缤慧于振剑冯小键董树平褚成静马文有广东医科大学人文管理学院应用心理学系广东东莞53808开滦市精神卫生中心河北唐山06300
黄缤慧,于振剑,冯小键,董树平,褚成静,马文有(. 广东医科大学人文管理学院应用心理学系,广东东莞 53808;. 开滦市精神卫生中心,河北唐山 06300)
◇临床研究◇
自杀行为中5-HT基因和GAD1基因的交互作用
黄缤慧1,于振剑2,冯小键1,董树平1,褚成静1,马文有2
(1. 广东医科大学人文管理学院应用心理学系,广东东莞 523808;2. 开滦市精神卫生中心,河北唐山 063001)
目的初步探讨5-羟色胺受体2C(5-HTR2C)基因、单胺氧化酶A(MAOA)基因和谷氨酸脱羧酶(GAD1)基因多态性与自杀行为的关系,并分析基因-基因之间的交互作用。方法对中国人群中21例有自杀行为史病例样本和50例健康对照者进行基因型分型;采用多因子降维法进行交互作用分析。结果对照组符合哈温平衡(HWE)检验,病例组中5-HTR2C位点不符合HWE检验(P<0.05),经过性别矫正检验显示与自杀行为正相关;两组的5-HTR2C基因型频率差别有统计学意义(χ2=6.18,P=0.04);病例组和对照组MAOA、GAD1基因型频数差异均无显著统计学意义(P>0.05)。在MDR模型分析得到最优模型组合为rs5953210-rs769391位点构建的交互模型OR=20.19,95%CI4.19~97.38,P<0.01,交互作用显著。结论5-HTR2C 基因rs3813928、rs518147位点多态性可能与自杀行为存在关联,与GAD1基因rs3749034、rs769391位点和MAOA基因rs5953210、rs979605位点无关联。在MDR模型中,5-HTR2C 基因与MAOA基因在自杀行为发病中具有显著交互效应,可增加自杀行为的发病风险。
自杀行为;多因子降维法;5-HT受体2C基因;单胺氧化酶A;γ-氨基丁酸;谷氨酸脱羧酶交互分析
自杀行为是一种有意识的、自愿结束生命的行为,是多因素导致的社会现象。中国卫生组织报告城市自杀率约为6.86/100 000,农村自杀率为10.01/100 000[1]。关于自杀行为的神经生物学基因关联研究包括色氨酸羟化酶、5-羟色胺受体和转运体和脑源性神经营养因子(brain-derived neurotrophic factors, BDNFs),而主要集中在5-羟色胺(5-hydroxytryptamine, 5-HT)系统。5-HT是中枢神经系统重要的递质,调节5-HT神经递质合成、转运和代谢的相关基因,如5-HT受体基因(已发现14种)[2];俞琼[3]做的Meta分析显示5-HT1A受体与自杀有关联;单胺氧化酶(monoamine oxidase, MAO)[4-5]可降解5-HT为5-羟吲哚乙酸(5-hydroxyindole acetic acid, 5-HIAA)[6];γ-氨基丁酸(gamma-amino-butyric acid, GABA)系统一直以来被认为与精神分裂症的发病密切相关,既往很多研究显示精神分裂症患者GABA系统功能异常[7],国内颜因等[8]也发现GABA的转运体与抗抑郁药物作用密切相关,导致蛋白质表达下调。上述基因功能区位点均有报道,阳性结果居多,但很少有关于其交互分析的报道。
本研究是探讨功能区位点多态性与自杀行为关联,然后采用多因子降维法(multifactor dimensionality reduction, MDR)进行交互作用分析,MDR由RICHIE等[9]提出,是无需明确遗传模式(显性或隐形)且对高维数据敏感的一种非参数统计方法,可得到检验效能较好的交互模型,评估自杀行为的风险基因,为早期识别和干预自杀行为提供客观依据。
1 对象与方法
1.1研究对象病例组:收集自2010年5月至2014年7月,在河北省唐山市各大医院急诊科因自杀未遂转入开滦精神卫生中心的自杀患者。纳入标准:①有自杀行为(包括自杀未遂、自杀意念等)史者;②年龄在20~50岁;③初中及以上文化程度;④同意参加本研究。排除标准:①有药物滥用史者;②有脑器质性疾病或严重躯体疾病患者(癌症、有严重并发症的慢性病等);③色盲或色弱者;④有严重精神疾病如精神分裂症;⑤依从性差者。共获取病例组21人,其中男性12人、女性9人。
对照组:同期同地选择与病例组年龄、性别、受教育年限匹配人员。入组标准:①本人及家庭成员中无自杀行为史(包括:自杀未遂、自杀意念等);②本人及家族无重大精神疾病史、重大慢性疾病者、遗传性疾病。共获取对照组50人,其中男性24人、女性26人。
全部研究对象均采集外周静脉血5 mL,并置于-80 ℃的冰箱内保存。本研究为横断面研究,本方案通过广东医科大学和开滦市精神卫生中心医学伦理委员会批准,批号:PJ2012134。所有实验对象均为右利手汉族人,并签署了实验知情同意书。
1.2实验方法DNA提取方法:采用上海天跟生物科技(北京)有限公司提供的血液样本DNA提取试剂盒(编号Cat.#DP319-02)提取样本DNA,提取步骤依据试剂盒的操作指南。
基因型的检测:将提取并测过浓度的DNA送往公司测序,采用二代测序法SNP检测实验技术、PCR-LDR(ligase detection reaction, LDR)技术,利用高温连接酶实现对基因型进行检测。结合文献和NCBI数据库,利用引物设计软件Primer 3 online version 6.0进行PCR反应上下游引物的设计。PCR反应体系:模板DNA 1 μL,10倍PCR缓冲液0.5 μL,MgCl2(25 mmol/L)1.5 μL,dNTP(10 mmol/L)0.3 μL,Taq酶1.25 U,引物各0.25 μL。PCR系统,20 μL体系为:95 ℃预变性2 min;94 ℃ 30 s,60 ℃ 90 s,65 ℃ 30 s,40个循环;65 ℃延伸10 min;4 ℃保存。6个位点的引物信息见表1。
表1位点PCR扩增所设计的引物
Tab.1 The PCR amplification primer of each SNP

SNP位点上游引物下游引物rs3749034ACTCCCGCCTTTCCTCTGGAGGGAACTAGCGAGAACGArs3813928GGAGGGGTATGCTATGAATCATGGCACCGGATAGAGAGAGrs518147CAAAGGCAGTATCGGGAAGACAAGAGCGTGGTGCAGATTrs5953210TGAAAGCACTAGGTTGAGAGCCTGGAAACCCTGCCACTGrs769391TTGGCTGACTCACGAGATTGGAAACCAGGTTAGCTGCAAGrs979605AAGAAATGGGGATTTTGACAACGGTATTACGCAAGCACTACGC
1.3统计学分析使用SPSS 20.0统计软件进行相应的数据分析。对病例组及对照组两组间年龄、性别、受教育年限、抽烟等人口学资料进行比较,符合正态分布资料,采用独立样本t检验,不符合正态分布的计数资料采用独立样本非参数χ2检验(Fisher精确检验)。用遗传学软件Plink1.07进行Hardy-Weinberg平衡检验、组间基因型频率差异检验,设P=0.05为显著性阈值;用MDR软件进行基因-基因之间的交互作用分析,在所有等级的最佳模型中,选择符号检验显示为有统计学意义(P<0.05)的模型,且为交叉验证一致性越大越好的模型。
2 结 果
2.1两组一般人口学资料的比较病例组和对照组在年龄(P=0.34)、性别(P=0.11)上比较均无统计学差异;,其中有12例自杀未遂患者有过两次或以上的自杀行为,9例一次自杀行为史,均未造成身体严重损伤。两组间教育年限差异显著(P<0.01),两组吸烟人数差异具有统计学意义(表2)。
2.2Hardy-Weinberg平衡检验和基因型频率关联分析所有对照组中的位点基因型分布均符合Hardy-Weinberg平衡检验(P>0.05),对照组中MAOA和GAD1基因型也符合HWE平衡检验(P>0.05),而病例组5-HTR2C基因rs3813928、rs518147位点基因型分布不符合HWE平衡检验(P<0.01),此位点在经过性别校正的加性和隐形模型分析中,显示与自杀行为正相关。
采用Plink软件进行基因型与自杀之间的关联分析,结果显示:5-HTR2C 基因rs3813928、rs518147位点基因型频率差异性具有统计学意义(χ2=6.18,P=0.04;OR=4.14;95%CI1.00~17.32);其余基因位点基因型频率在病例组与对照组的差异均无统计学意义(P>0.05,表3)。
表2病例组和对照组一般情况的比较
Tab.2 Demographic characteristics of the cases and the controls
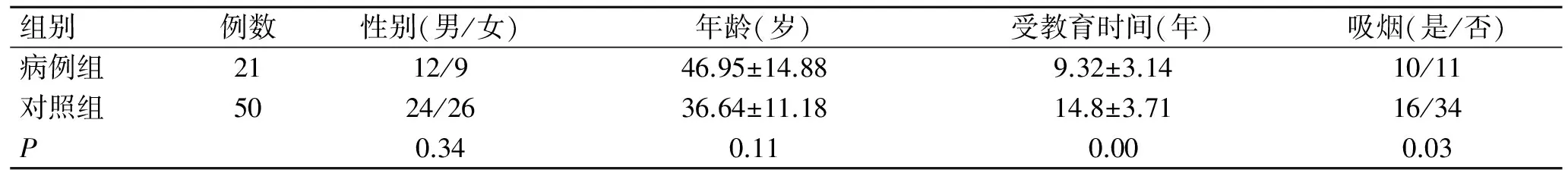
组别例数性别(男/女)年龄(岁)受教育时间(年)吸烟(是/否)病例组2112/946.95±14.889.32±3.1410/11对照组5024/2636.64±11.1814.8±3.7116/34P0.340.110.000.03
表3SNP位点H-WE平衡检验和基因型频率的关联分析
Tab.3 Association between H-WE equilibrium test of SNP and genotype frequencies
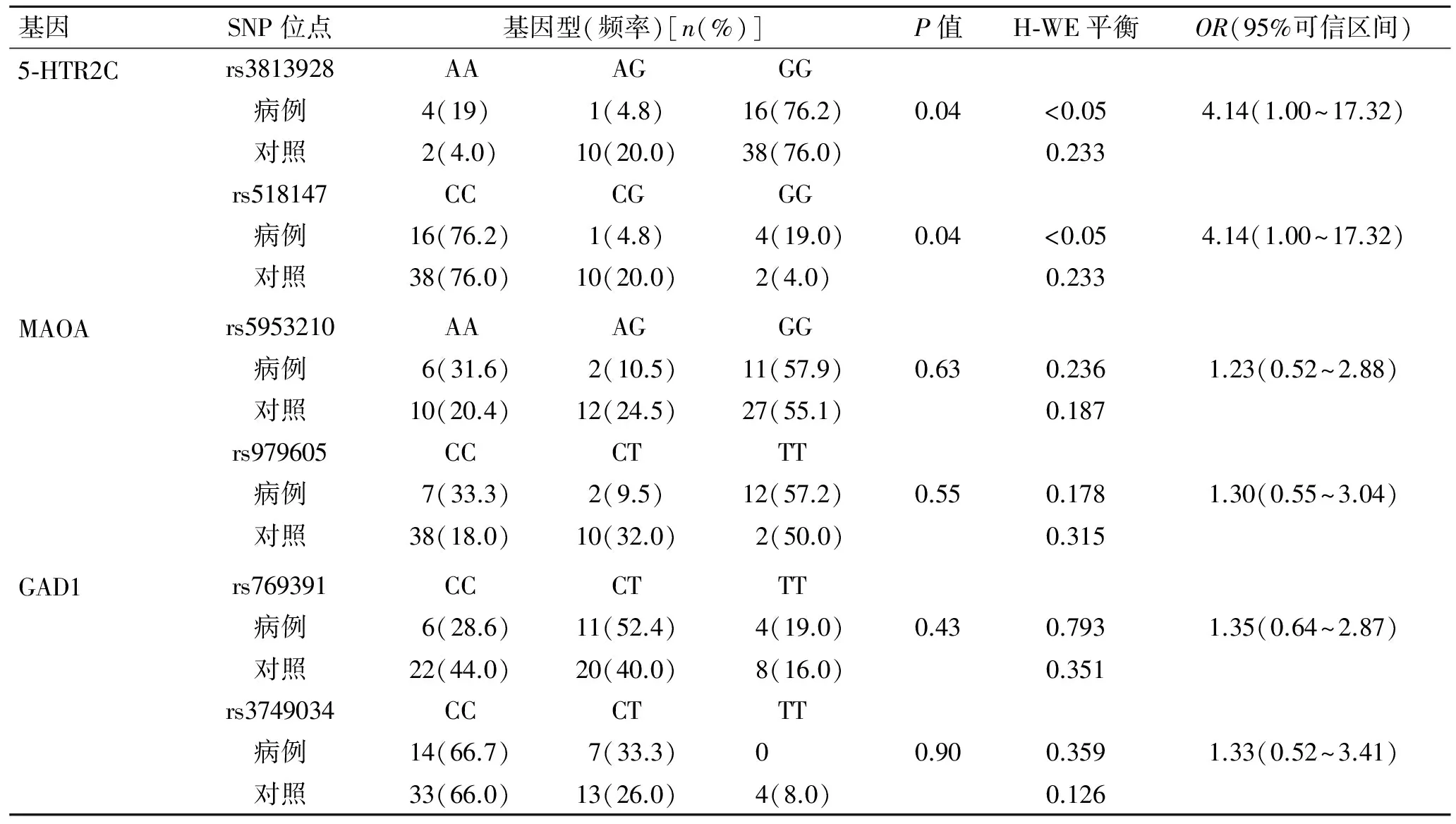
基因SNP位点基因型(频率)[n(%)]P值H⁃WE平衡OR(95%可信区间)5⁃HTR2Crs3813928病例对照 AA4(19)2(4.0) AG1(4.8)10(20.0) GG16(76.2)38(76.0)0.04 <0.050.233 4.14(1.00~17.32)rs518147病例对照 CC16(76.2)38(76.0) CG1(4.8)10(20.0) GG4(19.0)2(4.0)0.04 <0.050.2334.14(1.00~17.32)MAOArs5953210病例对照 AA6(31.6)10(20.4) AG2(10.5)12(24.5) GG11(57.9)27(55.1)0.63 0.2360.1871.23(0.52~2.88)rs979605病例对照 CC7(33.3)38(18.0) CT2(9.5)10(32.0) TT12(57.2)2(50.0)0.55 0.1780.3151.30(0.55~3.04)GAD1rs769391病例对照 CC6(28.6)22(44.0) CT11(52.4)20(40.0) TT4(19.0)8(16.0)0.43 0.7930.3511.35(0.64~2.87)rs3749034病例对照 CC14(66.7)33(66.0) CT7(33.3)13(26.0) TT04(8.0)0.90 0.3590.1261.33(0.52~3.41)
2.3基因-基因交互作用分析MDR方法基于贝叶斯分类理论,具有评估因子组合、预测疾病状态的能力,用于选择合适的环境变量、基因型变量及环境基因变量交互的组合,并报告最佳分类的组合,最后通过多重交叉验证,在所有等级的模型中选择交叉验证一致性最大且检验样本的准确度最高模型,即因子间最佳作用模型。本研究6个位点最佳交互作用模型如表4所示,经总样本置换检验均显示差异具有统计学意义(P<0.05)。经过模型分析,最优二阶模型为rs5953210-rs769391位点构建的交互模型,其交叉检验一致性(9/10)、检验样本准确度最高(0.74)且P<0.01,即MAOA基因与GAD1基因两者交互作用最佳。
表4MDR分析基因-基因交互作用模型
Tab.4 Models of gene-gene interactions

基因型训练样本准确度检验样本准确度交叉检验一致性χ2(P)OR(95%CI)rs9796050.610.478/103.95(0.05)4.47(0.93~21.57)rs5953210,rs7693910.790.749/1020.23(<0.001)20.19(4.19~97.38)rs518147,rs5953210,rs7693910.820.739/1024.47(<0.005)∞
结果为用fisher精确检验后的P值。
MDR检验结果由图1可知:携带MAOA基因rs5953210位点的AA基因型且携带GAD1基因rs769391位点的AA基因型的个体发生自杀行为的风险高;携带MAOA基因rs5953210位点的GG基因型且携带GAD1基因rs769391位点的AG基因型的个体发生自杀行为的风险高;携带MAOA基因rs5953210位点的GG基因型且携带GAD1基因rs769391位点GG基因型的个体发生自杀行为的风险高。

图1rs5953210位点和rs769391位点交互效应的基因型组合表
Fig.1 Interaction between different genotypes of rs769391 and rs5953210 polymorphisms
11=AA,13=AG,33=GG。左侧条带为病例组,右侧条带为对照组,病例组与对照组例数之比>1为高危(深灰色),提示高风险,<1为低危(浅灰色),提示低风险。
MDR分析树状图在模型组合P<0.05有意义。由树状图可知:MAOA基因 rs5953210位点和GAD1基因rs769391位点之间距离更近,可能存在强协同的交互作用,可能提示MAOA基因rs5953210(AG)与GAD1基因rs769391(CT)的共同存在会增加中国人群发生自杀行为的风险(图2)。
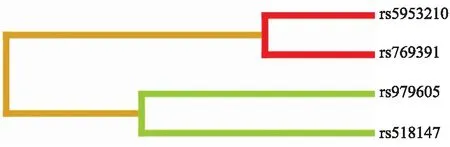
图2最佳模型树状图
Fig.2 Tree diagram of the best genotype models
距离越近的位点,交互作用越强,连线颜色越深,位点间的交互作用越接近协同作用,若连线为浅色,则表示无交互作用。
3 讨 论
自杀是多因素导致的结果,多基因分析方法在分子遗传学的研究中越来越受到重视,交互作用分析为复杂疾病的发病和预后判断提供了新方法[10]。本研究联合分析了5-HT受体、单胺类递质及γ-氨基丁酸(GABA)能抑制性系统相关基因,并观察各自对自杀行为发病风险的独立作用。
本研究5-HTR2C基因位点多态性两组差异显著表明:该基因rs3813928、rs518147位点SNP与自杀行为可能存在关联。5-HTR2C属于G蛋白偶联受体,其受体的基因位于Xq24,位点rs518147位于5-HTR2C 基因5′端非编码区(5′UTR),rs3813928位于基因5-HTR2C上游5′端2KB处,上游功能区位点基因型的不同会影响基因功能的表达[11]。YUCEL[12]研究发现5-HTR2C功能性多态位点rs3813929(-759C/T)会增加自杀行为的风险;BRUMMETT[13]的研究认为5-HTR2C基因功能区位点的多态性会增加女性患上抑郁的风险;有Meta分析证实世界范围内5-HTR2C与自杀行为的关联[14]。有相关白种族人口研究数据表明rs518147符合HWE平衡[15],由于本研究该基因位点不符合HWE平衡,其原因可能一是该位点可能与疾病的发生有关联或是与疾病易感基因连锁,二是样本量的不足,还需要增加样本量进一步证实。其他基因位点无明显关联,推测该位点可能与自杀无明显独立作用,也可能是样本量所限,需进一步证实。
MAOA主要参与5-羟色胺和去甲肾上腺素的降解,从而降低去甲肾上腺素和多巴胺的释放,导致抑郁、冲动暴力行为和精神分裂。本研究中MDR交互作用模型显示MAOA基因rs979605与5-HTR2C基因rs518147交互不显著,这与DE LUCA等[16]的研究相似,他认为这两个基因与自杀行为没有关联。国内外目前关于单胺类递质的研究主要是MAOA基因通过转录MAOA酶,降解突触间隙里的5-HT,进而调节5-HT[17-19],没有发现MAOA影响5-HTR2C功能的途径,因此此相关研究有待继续。
诸多5-HT受体信号通路的研究依旧不能阐明5-HT受体是如何起作用的,越来越多研究关注大脑谷氨酸(glutamic acid, Glu)能和GABA能的作用[20]。对于MAOA基因rs5953210位点与GAD1基因rs769391位点的交互模型表明二者存在协同作用。我们认为,已有研究表明5-HT对Glu能兴奋性突触调节异常,是兴奋性突触过度激活所致,从而导致认知紊乱[21];BARBON研究表明5-HTR2C受体在γ-氨基丁酸能神经元和谷氨酸能神经元上表达[22],而5-HT降解主要需要的就是MAOA酶,推测可能MAOA酶的增加导致5-HT的减少而影响谷氨酸和γ-氨基丁酸的作用机制,GABA水平变化或过高的谷氨酸水平是导致抑郁的直接原因之一[23]。药物研究认为5-HTR2C 受体拮抗剂可以使GABA降低,通过GABAB受体介导而参与增加脑内5-HT含量增加的机制,这经常作为抗抑郁和精神疾病药物的靶点[24-25]。
综上所述,本研究采用病例对照设计,运用MDR分析方法揭示了上述基因-基因之间的交互作用与自杀行为的关联,MDR可以大大降低建模所需的自由度,有效减少统计学中的Ⅱ类错误,有助于发现与自杀行为相关作用基因的通路,为发现导致自杀行为的易感基因提供线索,探索自杀行为基因-基因交互作用的神经生物学发病机制。
本研究存在局限性:①由于自杀未遂史样本收集难度较大,样本量较小,代表性不足,可能存在偏倚。②MDR模型分析常存在不足:降维的同时丢失信息;不能分析主效应;因子间无法明确相互作用的具体模型。③引起自杀的原因极其复杂,除了遗传因素外,还有环境因素和心理因素等。期待下一步能够扩大样本量与地区,研究上述基因与自杀的关联。同时,有必要对影响自杀相关危险因素在患者群体中开展类似的研究。
[1] GATTONE PM. Preventing death by suicide[J]. Epilepsy Behav, 2016, 61:292-293.
[2] DONALDSON ZR, NAUTIYAL KM, AHMARI SE, et al. Genetic approaches for understanding the role of serotonin receptors in mood and behavior[J]. Curr Opin Neurobiol, 2013, 23(3):399-406.
[3] 俞琼,付颖利,冯佳,等. 5-羟色胺1A受体基因多态性与自杀关联性的Meta分析[J]. 吉林大学学报(医学版), 2010, 36(3):1134-1137.
[4] KOLLA NJ, CHIUCCARIELLO L, WILSON AA, et al. Elevated monoamine oxidase-A distribution volume in borderline personality disorder is associated with severity across mood symptoms, suicidality, and cognition[J]. Biol Psychiatry, 2016, 79(2):117-126.
[5] ANTYPA N, SERRETTI A, DAN R, et al. Serotonergic genes and suicide: A systematic review[J]. Eur Neuropsychopharmacol, 2013, 23(10):1125-1142.
[6] ANDREOU D, SODERMAN E, AXELSSON T, et al. Polymorphisms in genes implicated in dopamine, serotonin and noradrenalin metabolism suggest association with cerebrospinal fluid monoamine metabolite concentrations in psychosis[J]. Behav Brain Funct, 2014, 10:26.
[7] DAVIS KN, TAO R, LI C, et al. GAD2 alternative transcripts in the human prefrontal cortex, and in schizophrenia and affective disorders[J]. PLoS One, 2016, 11(2):e0148558.
[8] 颜因,曹莉莎,李敏,等. 氟西汀作用于慢性温和不可预见性应激大鼠海马组织前后的差异蛋白质组学研究[J]. 川北医学院学报, 2016, 31(3):336-341.
[9] LI CF, LUO FT, ZENG YX, et al. Weighted risk score-based multifactor dimensionality reduction to detect gene-gene interactions in nasopharyngeal carcinoma[J]. Int J Mol Sci, 2014,15(6): 10724-10737.
[10] 袁芳,刘盼盼,徐进,等. 基因-基因(环境)交互作用分析方法的比较[J]. 宁波大学学报(理工版), 2012, 25(4):115-119.
[11] QUILTER CR, BAGGA M, MOINIE A, et al. Gene structure and expression of serotonin receptor 5-HTR2C in hypothalamic samples from infanticidal and control sows[J]. BMC Neurosci, 2012, 13:37.
[12] YUCEL Y, COSKUN S, CENGIZ B, et al. Association of polymorphisms within the serotonin receptor genes 5-HTR1A, 5-HTR1B, 5-HTR2A and 5-HTR2C and migraine susceptibility in a Turkish population[J]. Clin Psychopharmacol Neurosci, 2016, 14(3):250-255.
[13] BRUMMETT BH, BABYAK MA, WILLIAMS RB, et al. A putatively functional polymorphism in the HTR2C gene is associated with depressive symptoms in white females reporting significant life stress[J]. PLoS One, 2014, 9.12.
[14] THELMA BEATRIZ GC, ISELA R, ALMA G, et al. Association between 5-HTR2C gene variants and suicidal behaviour: A protocol for the systematic review and meta-analysis of genetic studies[J]. BMJ Open, 2014. 4(9):e005423.
[15] BANLAKI Z, ELEK Z, NANASI T, et al. Polymorphism in the serotonin receptor 2a (HTR2A) gene as possible predisposal factor for aggressive traits [J]. PLoS One, 2015, 10(2):e0117792.
[16] DE LUCA V, THARMALIGAN S, STRAUSS J, et al. 5-HT2C receptor and MAO-A interaction analysis: No association with suicidal behaviour in bipolar patients[J]. Eur Arch Psychiatry Clin Neurosci, 2008, 258(7):428-433.
[17] CERVERA-JUANES R, WILHEM LJ, PARK B, et al. MAOA expression predicts vulnerability for alcohol use[J]. Mol Psychiatry, 2016, 21(4):472-479.
[18] FAN M, LIU B, JIANG X, et al. Meta-analysis of the association between the monoamine oxidase-A gene and mood disorders [J]. Psychiatr Genet, 2010, 20(1):1-7.
[19] LUNG FW, TZENG DS, HUANG MF, et al. Association of the MAOA promoter uVNTR polymorphism with suicide attempts in patients with major depressive disorder[J]. BMC Med Genet, 2011, 12:74.
[20] TAO R, DAVIS KN, LI C, et al. GAD1 alternative transcripts and DNA methylation in human prefrontal cortex and hippocampus in brain development, schizophrenia[J]. Mol Psychiatry, 2017,105.
[21] MANN JJ, OQUENDO MA, WATSON KT, et al. Anxiety in major depression and cerebrospinal fluid free gamma-aminobutyric acid[J]. Depress Anxiety, 2014, 31(10):814-821.
[22] BARBON A, ORLANDI C, LA VL, et al. Antidepressant treatments change 5-HT2C receptor mRNA expression in rat prefrontal/frontal cortex and hippocampus[J]. Neuropsychobiology, 2011, 63(3):160-168.
[23] SMILEY JF, HACKEET TA, BLEIWAS C, et al. Reduced GABA neuron density in auditory cerebral cortex of subjects with major depressive disorder[J]. J Chem Neuroanat, 2016, 76(Pt B):108-121.
[24] ASAOKA N, NISHITANI N, KINOSHITA H, et al. Chronic antidepressant potentiates spontaneous activity of dorsal raphe serotonergic neurons by decreasing GABAB receptor-mediated inhibition of L-type calcium channels[J]. Sci Rep, 2017, 7(1):13609.
[25] SOKOLOWSKI M, BEN YJ, WASSERMAN J, et al. Glutamatergic GRIN2B and polyaminergic ODC1 genes in suicide attempts: associations and gene-environment interactions with childhood/adolescent physical assault[J]. Mol Psychiatry, 2013, 18(9):985-992.
Gene-geneinteractionsofsuicidalbehaviorbymultifactordimensionalityreductionanalysis:Doboth5-HTandGAD1work?
HUANG Bin-hui1, YU Zhen-jian2, FENG Xiao-jian1,DONG Shu-ping1, CHU Cheng-jing1, MA Wen-you2
(1. Psychology Department, School of Humanity and Management of Guangdong Medical University,Dongguan 523808; 2. Mental Health Center of Kailuan City, Tangshan 063001, China)
ObjectiveTo investigate gene-gene interactions of suicidal behavior with single-nucleotide-polymorphism (SNP) in MAOA, GAD1 and 5-HTR2C by multifactor dimensionality reduction.MethodsFor this case-control study, six SNPs were captured in related genes and detected in blood samples obtained from 21 patients with suicidal behavior and 50 healthy individuals. The genotype frequency and allele frequency as well as the Hardy-Weinberg equilibrium (HWE), tests were performed and compared by plink software. The gene-gene interactions models were built by the MDR software.ResultsThe HWE test for case group showed that rs3813928 rs518147 of 5-HTR2C gene was not in line with HWE (P<0.05). However, the additive model analysis after adjustment by gender indicated that the polymorphism had a positive correlation with suicidal behavior in case group. The case and control groups differed significantly only in genotype frequencies of 5-HTR2C gene (χ2=6.18,P=0.04). There was no significant difference in allele and genotype frequencies of the other genes (P>0.05). The best combination model of MDR was rs5953210-rs769391OR=20.19, 95%CI4.19-97.38,P<0.01, with significant interaction.ConclusionThe 5-HTR2C gene rs3813928 and rs518147 polymorphisms may play an important role in the susceptibility to suicidal behavior. The combination of MAOA with GAD1 has a significant interaction which may increase the risk of suicidal behavior.
suicidal behavior; multifactor dimensionality reduction (MDR); 5-HTR2C; MAOA; γ-GABA; GAD1; gene-gene interaction
2016-09-25
2017-07-19
国家自然科学基金资助项目(No.81101021)
Supported by the National Natural Science Foundation of China (No.81101021)
褚成静. E-mail: chchj2004@163.com;马文有. E-mail: mawenyou163@163.com
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171205.1514.006.html(2017-12-05)
R749.3
A
10.7652/jdyxb201801014
(编辑 韩维栋)
