原儿茶醛对大鼠离体肠系膜上动脉血管环的舒张作用及机制
2018-01-10刘欢欢申旭霁陈玉龙西安医学院药学院陕西西安700西安医学院基础医学与转化研究所陕西西安700
张 寒,刘欢欢,贾 敏,张 彦,申旭霁,陈玉龙(. 西安医学院药学院,陕西西安 700;. 西安医学院基础医学与转化研究所,陕西西安 700)
原儿茶醛对大鼠离体肠系膜上动脉血管环的舒张作用及机制
张 寒1,刘欢欢2,贾 敏2,张 彦1,申旭霁1,陈玉龙2
(1. 西安医学院药学院,陕西西安 710021;2. 西安医学院基础医学与转化研究所,陕西西安 710021)
目的观察原儿茶醛(protocatechuic aldehyde, PCA)对大鼠肠系膜上动脉血管环的舒张作用,并探讨其相关机制。方法使用Myograph动态描记系统,分别记录高钾(60 mmol/L)、5-羟色胺(5-HT)、苯肾上腺素(PE)对大鼠离体血管环的收缩作用;观察不同浓度PCA对高钾(60 mmol/L)、5-HT、PE预收缩血管环的舒张作用;用高钾(60 mmol/L) 预收缩血管后,分别用内皮机制抑制剂左旋硝基精氨酸甲酯(L-NAME)、吲哚美辛(Indo)、1H-[1,2,4]恶草灵并[4,3-a]喹喔啉-1-酮(ODQ)以及钾通道阻断剂四氨基吡啶(4-AP)、四乙胺(TEA)、氯化钡(BaCl2)、格列苯脲(Glib)作用于血管环后,观察PCA对预收缩血管环的舒张作用,研究PCA的作用机制。结果PCA在10-6~10-3mol/L浓度范围内,对高钾(60 mmol/L)和5-HT 引起的血管收缩有浓度依赖性的舒张作用(P<0.01);内皮机制抑制剂Indo对PCA引起的舒张有抑制作用(P<0.05);钾离子通道阻滞剂4-AP和BaCl2对PCA引起的舒张有抑制作用(P<0.01)。结论PCA具有舒张血管作用,其作用与抑制钾离子通道和内皮机制有关。
原儿茶醛(PCA);血管环;血管舒张;钾通道;内皮抑制;肠系膜上动脉
缺血性心血管疾病(ischemic cardiovascular disease, ICVD)是由于冠状动脉粥样硬化或血管痉挛,导致冠状动脉狭窄、阻塞,从而引起心绞痛、心肌梗死的一种疾病。目前,心血管病致死率达41.1%,已成为人类生命的第一杀手[1]。
原儿茶醛(protocatechuic aldehyde, PCA)-3,4-二羟基苯甲醛(3,4-dihydroxybenzaldehyde)是从活血化瘀药物丹参中提取的水溶性单体,为丹酚酸B的降解产物之一,分子式为C7H6O3,具有扩张动脉、降低心肌耗氧量、抑制血小板聚集、抗脂质过氧化和清除自由基等作用[2]。然而,PCA对血管舒张功能的调节及分子药理机制研究的相关文献少见报道[3-6]。因此,深入研究PCA对血管舒张功能的作用及机制,对于评估PCA在临床治疗血管疾病具有重要意义。
1 材料与方法
1.1实验动物与仪器体质量250~300 g的SD雄性大鼠(清洁级),购自西安交通大学实验动物中心,许可证号:SCXK(陕)2008-008。实验动物步骤经西安医学院伦理委员会许可。四通道微血管张力测定仪(丹麦DMT公司,型号620);PowerLab八通道生理记录仪(澳大利亚Adinstruments 公司,型号8/35);体视显微镜(日本奥林巴斯公司,型号SZX-T);可调式漩涡混匀仪(美国赛洛捷克公司,型号MX-S);多功能循环恒温水浴(海昌吉地质仪器有限公司,型号HWY-10)。
1.2试剂及药品苯肾上腺素[(R)-(-)-phenylephrine, PE]、5-羟色胺[serotemin, 5-HT]、乙酰胆碱(acetylclohe chloride, ACh)、氯化钡(BaCl2)、氯化四乙胺(TEA-Cl)、四氨基吡啶(4-AP)、格列苯脲(Glib)、左旋硝基精氨酸甲酯(Nω-nitro-L-arginine-methyl-ester, L-NAME)、1H-[1,2,4]-Oxadiazolo[4,3-a]喹喔啉-1-酮(Quinoxalin-1-One, ODQ)、吲哚美辛(indomethacin, Indo)均为美国Sigma公司产品。PCA中药单体购自西安开来生物工程有限公司,经高效液相色谱检测纯度大于98%。PSS营养液(mmol/L)组成:NaCl 118.99、KCl 4.69、MgSO4·7H2O 1.17、KH2PO41.1、CaCl2·2H2O 2.50、NaHCO325.00和葡萄糖5.50;高钾营养液KPSS(mmol/L)是在PSS营养液中将KCl 的含量提高到123.70;无钙营养液是在配制PSS营养液时不加CaCl2,并加入钙离子络合剂EDTA 0.03;3种溶液的pH值均为7.4。
1.3大鼠肠系膜上动脉环的制备、活性检测及内皮完整性检测安乐死(CO2窒息处死)大鼠,仰卧位固定,迅速打开腹腔,取出肠部并分离肠系膜上动脉。置于4 ℃预冷的PSS营养液中,在体视显微镜下剥离脂肪及结缔组织,剪切成2~3 mm长的血管环,根据实验需要制备成完整内皮及去内皮的血管环。将剪切好的血管环挂于已加入5 mL PSS并预热至37 ℃ 并保持恒温的L型张力测定仪上,持续通入含50 mL/L CO2和950 mL/L O2混合气体饱和的PSS溶液中,并进行实验。
血管环稳定30 min,加入高钾溶液(60 mmol/L)刺激血管环2次,2次血管环收缩幅度均比预张力大1 mN且2次收缩幅度相差不大,则说明血管环具有活性,可用于实验。PE(10-5mol/L)预收缩血管环,达最大收缩并稳定后加入ACh(10-5mol/L),若舒张率(指PE收缩最大张力与血管在当前受试药物的累积浓度下张力的差值,除以PE收缩最大张力与PE预收缩血管前静息张力的差值)大于或等于70%,则视为血管环内皮完整[7-8]。
1.4PCA对基础状态下完整内皮肠系膜上动脉的舒张作用取制备好内皮完整的血管环,在基础状态下以累加浓度方式给予PCA(10-6~10-3mol/L),同时设立等体积累加生理盐水对照组。记录并观察PCA对基础状态下完整内皮的肠系膜上动脉血管环的舒张作用。
1.5PCA对高钾、PE、5-HT分别预收缩的肠系膜上动脉的舒张作用制备好的血管环分别给予高钾(60 mmol/L)、PE(10-5mol/L)、5-HT(10-5mol/L)进行预收缩,达最大收缩并稳定后向Myograph浴槽中以累加浓度方式给予PCA(10-6~10-3mol/L),同时设立等体积累加生理盐水对照组。分别记录并观察PCA对高钾预收缩、PE预收缩、5-HT预收缩的完整内皮及去内皮的肠系膜上动脉血管环的舒张作用。
1.6内皮舒张抑制剂L-NAME、Indo、ODQ对PCA舒张血管作用的影响取内皮完整的血管,在分别给予一氧化氮合酶抑制剂L-NAME、环氧合酶抑制剂Indo、鸟苷酸环化酶抑制剂ODQ预孵育20 min后,加人PE(10-5mol/L),达最大收缩并稳定后,向Myograph浴槽中以累加浓度方式给予PCA(10-6~10-3mol/L),同时设立等体积累加PCA(10-6~10-3mol/L)对照组。记录并观察PCA对内皮完整的血管环的舒张作用。
1.7钾通道拮抗剂BaCl2、TEA-Cl、4-AP、Glib对PCA舒张血管作用的影响给予高钾(60 mmol/L)预收缩去内皮血管,达最大收缩并稳定后,分别向Myograph浴槽中加入内向整流钾通道(Kir)阻断剂BaCl2、Ca2+激活的钾通道(KCa)阻断剂TEA-Cl、ATP敏感钾通道(KATP)阻断剂Glib、电压敏感型钾通道(KV)阻断剂4-AP孵育血管,去内皮血管环收缩再次达到平台时,向Myograph浴槽中以累加浓度方式给予PCA(10-6~10-3mol/L),同时设立等体积累加PCA(10-6~10-3mol/L)对照组。记录并观察PCA对去内皮血管环的舒张作用。
1.8统计学分析数据均以SPSS 1.9软件进行统计学分析,组间比较采用T检验,检验水准取0.05。
2 结 果
2.1PCA对基础状态下完整内皮肠系膜上动脉的舒张作用与对照组相比,PCA对基础状态下的肠系膜上动脉完整内皮血管无舒张作用(P>0.05。图1)。
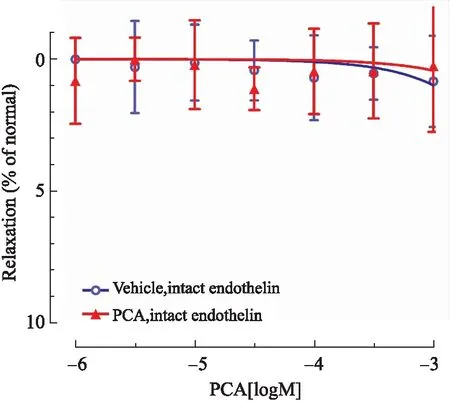
图1PCA对基础状态下完整内皮的肠系膜上动脉的舒张作用
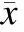
2.2PCA对高钾预收缩肠系膜上动脉的舒张作用在高钾(60 mmol/L)预收缩有完整内皮的肠系膜上动脉中,与对照组相比,当PCA浓度在10-5~10-3mol/L时具有显著地舒张血管作用,其浓度越大舒张血管能力越强(P<0.01);在高钾(60 mmol/L)预收缩去内皮的肠系膜上动脉中,与对照组相比,当PCA在10-5~10-3mol/L时具有显著地舒张血管作用,其浓度越大舒张血管能力越强(P<0.01)。PCA对有完整内皮血管舒张幅度明显强于无内皮组(图2)。
2.3PCA对PE预收缩肠系膜上动脉的舒张作用在PE(10-5mol/L)预收缩有完整内皮的肠系膜上动脉中,与对照组相比,当PCA在10-3mol/L时具有微弱的舒张血管作用(P>0.05);在PE(10-5mol/L)预收缩去内皮的肠系膜上动脉中,与对照组相比,当PCA在10-3mol/L时具有微弱的舒张血管作用(P>0.05);另外,在10-3mol/L时完整内皮的舒张作用稍强于去内皮的舒张作用(图3)。

图2PCA对高钾预收缩肠系膜上动脉(完整内皮或去内皮)的舒张作用
Fig.2 Vasodilating effects of PCA on intact and denuded endothelium superior mesenteric artery ring pre-contracted with high potassium (60 mmol/L)

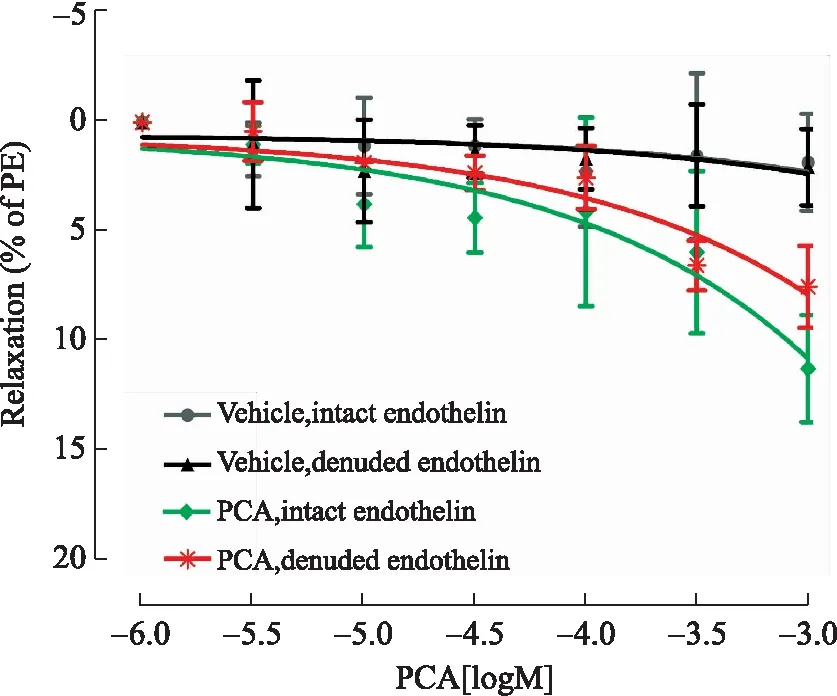
图3PCA对PE预收缩肠系膜上动脉(完整内皮或去内皮)的舒张作用
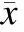
2.4PCA对5-HT预收缩肠系膜上动脉的舒张作用在5-HT(10-5mol/L)预收缩含完整内皮的肠系膜上动脉中,与对照组相比,当PCA在10-4~10-3mol/L浓度范围时具有显著地舒张血管作用,其中浓度越大舒张血管能力越强(P<0.01);在5-HT预收缩无内皮的肠系膜上动脉中,与对照组相比,当PCA在10-5~10-3mol/L时具有显著地舒张血管作用,其中浓度越大舒张血管能力越强(P<0.01);另外,PCA在10-4~10-3mol/L时有完整内皮的舒张作用强于去内皮的舒张作用(图4)。
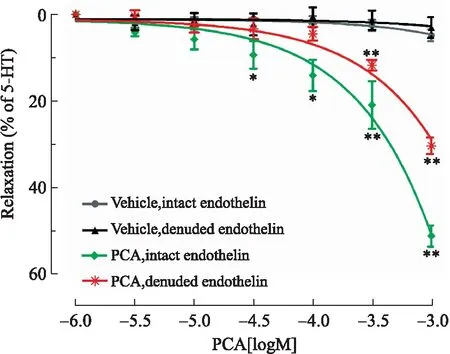
图4PCA对5-HT预收缩肠系膜上动脉(完整内皮或去内皮)的舒张作用
Fig.4 The concentration-response curves of PCA on the vasodilating effect of the rat superior mesenteric artery of intact and denuded endothelium precontracted by 5-HT

2.6钾通道拮抗剂在PCA对高钾预收缩肠系膜上动脉舒张作用中的影响与对照组相比,当PCA在10-4~10-3mol/L浓度范围时,4-AP、BaCl2对高钾(60 mmol/L)预收缩去内皮的肠系膜上动脉血管环的舒张均有抑制作用,且差异有统计学意义(P<0.01);而TEA-Cl、Glib对高钾(60 mmol/L)预收缩的去内皮肠系膜上动脉血管环的舒张无影响(P>0.05,图6)。

图5L-NAME(A)、ODQ(B)、Indo(C)在PCA对PE预收缩完整内皮肠系膜上动脉舒张作用的影响
Fig.5 Effects of L-NAME(A), ODQ(B), Indo(C) treatments on pinocembrin-induced relaxation in endothelium-intact superior mesenteric artery rings on pre-contracted by high potassium
3 讨 论
PCA是丹参水溶性成分之一,为一种酚酸类化合物,具有扩张动脉、降低心肌耗氧量、抑制血小板聚集、抗脂质过氧化、清除自由基以及抗炎和抗细胞凋亡等多种心血管保护作用。其在抗血管痉挛药物的开发研究中备受关注。本研究主要观察了PCA血管舒缩功能的影响,并探讨其初步机制。
血管平滑肌收缩主要依赖胞质钙离子浓度,胞质钙离子浓度主要通过细胞外钙离子内流和胞内肌浆网钙离子释放进行调节。苯肾上腺素和高钾均能够增加胞内钙离子浓度,引起血管收缩。高钾能够使血管平滑肌细胞电压依赖性钙通道开放,促进细胞外液中钙离子或与细胞膜疏松结合的钙离子内流,引起细胞膜去极化,导致血管收缩[9]。苯肾上腺素则作用于血管平滑肌的肾上腺素受体,促使受体调控的钙通道开放而使钙离子内流,同时,也可以通过三磷酸肌醇(IP3)刺激内贮钙离子释放引起血管收缩[10]。另外,5-HT也是导致血管收缩的主要因子,其主要通过与5-HT受体结合,引起血管收缩[11]。本研究显示,PCA对高钾及5-HT预收缩血管具有显著的舒张作用。而对苯肾上腺素引起的预收缩却无作用。这表明,PCA可能通过抑制电压依赖性钙通道介导的细胞外钙离子内流以及抑制5-HT与其受体的结合而发挥舒张血管作用。
血管的张力主要受细胞膜电位的调控,而钾通道活性则是调节血管平滑肌细胞膜电位去极化或超极化的关键。钾离子外流可使血管平滑肌细胞膜电位超极化,从而抑制细胞外钙离子内流,引起血管舒张。在血管平滑肌细胞上主要有4种钾离子通道,包括电压依赖性钾通道(KV)、内向整流钾通道(Kir)、钙激活钾通道(KCa)和ATP敏感钾通道(KATP)。BaCl2能较高选择性的阻断Kir,易造成膜的去极化;4-AP为KV抑制剂[12]。本文结果显示,钾离子通道抑制剂4-AP 和BaCl2对PCA引起的舒张有抑制作用,差异有统计学意义。这表明PCA舒张血管作用与KV和Kir有关。

图64-AP(A)、BaCl2(B)、TEA-Cl(C)、Glib(D)在PCA对高钾预收缩去内皮肠系膜上动脉舒张作用的影响
Fig.6 Effects of 4-AP (A), BaCl2(B),TEA-Cl (C), and Glib (D) treatments on pinocembrin-induced relaxation in endothelium-denuded superior mesenteric artery rings on pre-contracted by high potassium
与PCA组相比,*P<0.05;**P<0.01。
血管内皮细胞可摄取循环血液中的花生四烯酸(arachidonic acid, AA),在环氧合酶的作用下生成前列腺素H2(PGH2),再经前列腺素合成酶的作用生成PGI2,PGI2可以激活腺苷酸环化酶(adenylate cyclase, AC),从而增加胞内环磷腺苷(adenosine cyclophosphate, cAMP)含量使血管舒张[13]。本实验表明PCA的血管舒张作用能被环氧合酶抑制剂Indo所减弱,提示PCA的舒血管机制可能与前列腺素类物质的生成有关。
血管内皮细胞通过与血管壁和管腔细胞之间多个复杂的相互作用来维持血管内环境稳定。其能够通过合成和分泌一氧化氮、前列腺素和内皮衍生的超极化因子等血管活性物质作用于血管平滑肌,在舒张血管中发挥重要作用[14]。PCA不仅对高钾及5-HT预收缩血管具有显著的舒张作用,同时对去内皮血管也具有舒张作用。这表明PCA舒张血管具有部分内皮依赖性,即药物可能通过促进内皮细胞合成和分泌舒血管活性物质,发挥舒血管作用,其深层次机制还需进一步探讨。
综上所述,PCA对高钾和5-HT诱发的血管收缩具有舒张作用,其作用具有部分内皮依赖性。PCA的舒血管作用除过与KV和Kir钾通道有关外,可能还与前列腺素类物质的生成有关。
[1] 刘志学,胡洋. 中国心血管病报告2013[J]. 中国医药导报,2014, 15(9):163-165.
[2] 张翠英,郭丽丽,王阶,等. 原儿茶醛的药理研究进展[J]. 中国实验方剂学杂志, 2013, 19(12):23-24.
[3] 徐德然,王康才,王峥涛,等. 丹参中丹参素、原儿茶醛来源的初步研究[J]. 中国天然药物, 2005, 3(3):148-151.
[4] 邢雅玲,叶志华,钟芝茵,等. 原儿茶醛对脂多糖损伤的血管内皮细胞的作用机制研究[J]. 军事医学科学院刊, 2008, 32(4):344-347.
[5] 韩纯洁,林蓉,刘俊田,等. 原儿茶醛对OX-LDL损伤的血管内皮细胞保护作用[J]. 中药材,2007, 30(12):1541-1543.
[6] 赵艳威,杨宣,董樂瑾,等. 丹参素及原儿茶醛研究进展[J]. 武警医学院学报,2009,18(3):260-263.
[7] CAO YX, ZHANG W, HE JY, et al. Ligustilide induces vasodilatation via inhibiting voltage dependent calcium channel and receptor-mediated Ca2+influx and release[J]. Vasc Phamacol, 2006, 45(3):171-176.
[8] 李金艳,侯晓敏,李江红,等. 橙皮素对离体大鼠胸主动脉环舒张作用和机制研究[J]. 中西医结合心脑血管病杂志, 2014, 12(7):870-873.
[9] 智晓文,苏显明,封卫毅,等. 丹红注射液对大鼠离体肠系膜动脉血管环作用及机制[J]. 中国中药, 2012, 37(17):2607-2611.
[10] 王勋,罗珊珊,蒋嘉烨,等.鸟苷对大鼠胸主动脉血管环的舒张作用及机制[J]. 中国药理学通报, 2011, 27(11):1540-1543.
[11] 李陕区,杨博,许昌泰. 神经递质5-羟色胺研究现状[J]. 临床医学工程,2010, 17(5):145-147.
[12] 黄莹洁. 钾通道抑制剂减弱吉非罗齐对离体大鼠胸主动脉环的舒张作用[D]. 太源:山西医科大学, 2013.
[13] 张洪平,田戈,杨涛,等. 木兰脂素对离体大鼠胸主动脉环血管舒张机制和大鼠肾细胞毒性作用[J]. 中国实验方剂学杂志, 2013, (23):209-212.
[14] 余海滨,王清照,沈俊岭,等. 环维黄杨星D对大鼠胸主动脉内皮完整血管环舒张作用的研究[J]. 中药药理与临床, 2013, 29(4):46-49.
Effectsandmechanismsofmesentericarterialringsvasodilationinducedbyprotocatechuicaldehyde
ZHANG Han1, LIU Huan-huan2, JIA Min2, ZHANG Yan1, SHEN Xu-ji1, CHEN Yu-long2
(1. School of Pharmacy; 2. Institute of Basic and Translational Medicine,Xi’an Medical College, Xi’an 710021, China)
ObjectiveTo investigate the vasodilating effects of protocatechuic aldehyde (PCA) on rat superior mesenteric arterial rings as well as its mechanism.MethodsThe tension of rat superior mesenteric arterial rings was recorded by a sensitive myograph systeminvitro. We measured isometric tension changes in preconstricted rat superior mesenteric artery rings induced by potassium chloride (KCl, 60 mmol/L), serotomin (5-HT, 10-5mol/L), and phenylephrine (PE, 10-5mol/L) after PCA treatment at different concentrations, respectively. We also observed vasodilating effects of PCA on KCl (60 mmol/L) preconstricted rat superior mesenteric arterial rings after incubation with different inhibitors, i.e., L-NAME, Indo, ODQ, 4-AP (KVchannel blocker), TEA (KCachannel blocker), BaCl2(Kir channel blocker), and Glib (KATPchannel blocker), respectively.ResultsPCA (10-6-10-3mol/L) could relax KCl (60 mmol/L) and 5-HT(10-5mol/L) preconstricted rat superior mesenteric arterial rings in a concentration-dependent manner. Indo of endothelial mechanism inhibitor blocked the vasodilating effect of PCA. 4-AP and BaCl2of potassium ion channel inhibitors affected the vasodilatation induced by PCA in KCl (60 mmol/L)-preconstricted rat mesenteric artery.ConclusionPCA can relax KCl (60 mmol/L), or 5-HT preconstricted rat superior mesenteric arterial rings. This effect is associated with the inhibition of potassium channels and endothelial mechanism.
protocatechuic aldehyde (PCA); arterial ring; vasodilatation; potassium channel; endothelial mechanism inhibitor; superior mesenteric artery
2017-03-06
2017-07-11
陕西省教育厅重点科研计划项目(No.16JS096);陕西省自然科学专项基金资助项目(No.14JK1630)
Supported by the Key Research Program of Shaanxi Education Department (No.16JS096) and the Natural Science Foundation of Shaanxi Province (No.14JK1630)
陈玉龙. E-mail: chenyulong_jzs@xiyi.edu.cn
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171024.1623.004.html (2017-10-24)
R331.3
A
10.7652/jdyxb201801008
(编辑 国 荣)
