一氧化氮对自发性高血压大鼠外周血T淋巴细胞亚群的影响
2018-01-10申土旺单莉娅于秀石司军强李新芝马克涛石河子大学医学院新疆地方与民族高发病教育部重点实验室生理学教研室病理生理学教研室新疆石河子832000
申土旺,单莉娅,于秀石,彭 珉,倪 欣,李 丽,司军强,李新芝,马克涛(石河子大学医学院:1. 新疆地方与民族高发病教育部重点实验室;2. 生理学教研室;3. 病理生理学教研室,新疆石河子 832000)
一氧化氮对自发性高血压大鼠外周血T淋巴细胞亚群的影响
申土旺1,2,单莉娅1,2,于秀石1,2,彭 珉1,2,倪 欣1,2,李 丽1,2,司军强1,2,李新芝1,3,马克涛1,2
(石河子大学医学院:1. 新疆地方与民族高发病教育部重点实验室;2. 生理学教研室;3. 病理生理学教研室,新疆石河子 832000)
目的探讨一氧化氮(NO)对调节外周血T淋巴细胞亚群的比值和促炎因子的影响及其对高血压造成的靶器官损伤的作用。方法选取12周龄SHR和WKY大鼠,随机分为WKY组、SHR组和SHR+NO干预组,每组6只,SHR+NO干预组按10 μg/(kg·d)腹腔注射硝普钠(NO供体)4周,WKY组和SHR组用等量生理盐水腹腔注射4周。测量尾动脉血压后,采用HE染色法观察脑基底动脉和肾脏病理学改变;流式细胞术检测外周血CD4+/CD8+和CD4+CD25+T细胞比值;ELISA检测外周血血清肿瘤坏死因子-α(TNF-α)水平。结果与WKY组比较,SHR组大鼠出现脑基底动脉内皮细胞受损、血管壁增厚、肾小球萎缩和炎性细胞浸润,SHR+NO干预组较SHR组大鼠炎性损伤程度减轻;与WKY组比较,SHR组大鼠外周血CD4+/CD8+的比值升高(P<0.01),CD4+CD25+的比值下降(P<0.01),SHR+NO干预组较SHR组CD4+/CD8+的比值降低(P<0.01),CD4+CD25+的比值升高(P<0.05);SHR组大鼠血清中TNF-α表达较WKY组升高(P<0.01),SHR+NO干预组较SHR组TNF-α表达降低(P<0.05)。结论NO通过调节外周血T淋巴细胞亚群的比值,减少促炎因子的释放,进而改善高血压造成的靶器官损伤。
自发性高血压大鼠;T淋巴细胞;一氧化氮(NO);肿瘤坏死因子-α(TNF-α)
高血压是最常见的心血管疾病之一,其发病机制复杂,受遗传和环境等多种因素的共同影响[1]。近来研究表明,高血压是一种慢性低级别炎症反应[2],炎症因子可促进高血压的发生发展[3],且免疫系统失调与高血压发病关系密切[4],其中T淋巴细胞作为主要的免疫细胞,在高血压的发生发展中发挥重要作用,特别是效应T细胞和调节性T淋巴细胞之间的平衡[5-6],对血压升高和相关器官的损害至关重要。
在自发性高血压大鼠(spontaneously hypetensive rats, SHR)中一氧化氮(nitric oxide, NO)合成和释放减少[7]。而NO不仅具有重要的免疫调节功能[8],且在调节炎症方面也发挥重要作用[9]。目前,NO供体药(如硝普钠)已广泛应用于临床高血压的治疗,但其具体机制目前尚不清晰。本实验用HE染色观察大鼠脑基底动脉和肾脏病理学改变,流式细胞术检测大鼠外周血CD4+/CD8+和CD4+CD25+T细胞比值, ELISA技术检测大鼠外周血血清肿瘤坏死因子α(TNF-α)的表达,探讨NO是否通过调节外周血T淋巴细胞亚群的比值和减少促炎因子的释放进而改善高血压造成的靶器官损伤,为NO供体药治疗高血压提供新的实验依据。
1 材料与方法
1.1主要试剂硝普钠购自美国Sigma公司,FITC anti-rat CD3、APC anti-rat CD4、PE anti-rat CD8和PE anti-rat CD25均购自美国Biolegend公司,大鼠淋巴细胞分离液购自北京索莱宝科技有限公司,大鼠TNF-α ELISA试剂盒购自杭州联科生物技术有限公司。
1.2实验动物选取12周龄的SHR和WKY大鼠,购自北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2012-0001。随机分为3组,每组6只,SHR+NO干预组按10 μg/(kg·d)腹腔注射硝普钠4周,WKY组和SHR组等量生理盐水腹腔注射4周。
1.3大鼠尾动脉血压测量使用BP-6无创血压测量仪测量大鼠尾动脉血压,使用前先预热15~20 min,待大鼠安静后,重复测量3次,取其平均值。
1.4流式细胞仪检测外周血T淋巴细胞亚群大鼠麻醉后采集腹主动脉血液3 mL,离心,去上清,加入等体积PBS溶液稀释,混匀,轻铺于等量淋巴细胞分离液上,离心,抽取中间白膜层部分,离心,弃上清,PBS溶液重悬制备淋巴细胞悬液。取淋巴细胞悬液于测定管中,设空白管和同型对照管,按照说明书加入CD3+、CD4+、CD8+、CD25+荧光抗体,充分混匀后室温避光孵育20 min,PBS溶液重悬,上机,使用CELLQuest软件进行检测。
1.5ELISA技术检测大鼠外周血血清TNF-α的表达取腹主动脉血液,2 000 r/min离心5 min,取上层血清,采用ELISA试剂盒检测TNF-α的表达水平,所有操作按照说明书进行。
1.6HE染色观察大鼠脑基底动脉和肾脏病理学改变大鼠麻醉后,断头处死,取其脑和肾组织,100 mL/L中性甲醛溶液固定48 h后,制作石蜡切片(厚度4 μm),进行HE染色,并用光学显微镜观察其病理学改变。
1.7统计学分析采用SPSS 17.0软件进行统计学分析,计量资料以均数±标准差表示,多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结 果
2.1各组大鼠的尾动脉血压与WKY组尾动脉血压[(110.67±6.01)mmHg(1 mmHg=0.133 kPa)]相比,SHR组[(174.32±4.38)mmHg]显著升高,SHR+NO干预组[(125.93±6.75)mmHg]较SHR组明显降低,差异均有统计学意义(P<0.01,图1)。
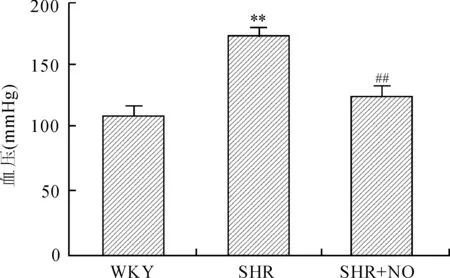
图1各组大鼠的尾动脉血压
Fig.1 The rat tail artery blood pressure of the three groups
与WKY组比较,**P<0.01;与SHR组比较,##P<0.01,n=6。
2.2各组大鼠外周血CD4+和CD8+T细胞表达频率及CD4+/CD8+比值流式细胞仪检测结果显示,WKY组CD4+和CD8+表达比率分别为(65.18±2.54)%和(34.92±2.97)%,SHR组分别为(71.79±2.36)%和(28.90±1.90)%,SHR+NO干预组分别为(67.06±1.48)%和(33.37±1.71)%,SHR组较WKY组均升高,差异具有统计学意义(P<0.01),SHR+NO干预组较SHR组均降低,差异有统计学意义(P<0.01);SHR组CD4+/CD8+比值为2.51±0.25,较WKY组的1.84±0.18升高,差异有统计学意义(P<0.01),SHR+NO干预组为2.03±0.14,较SHR组降低,差异具有统计学意义(P<0.01,图2)。
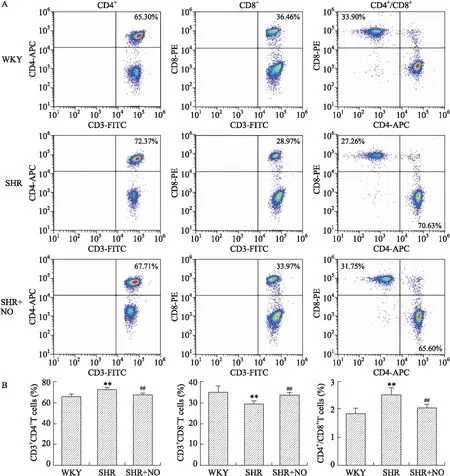
图2各组大鼠外周血CD4+/CD8+T细胞的表达比率
Fig.2 The expression ratio of CD4+/CD8+T cells in peripheral blood of the three groups
A:外周血CD4+、CD8+和CD4+/CD8+的表达;B:外周血CD4+、CD8+和CD4+/CD8+表达的统计学分析。与WKY组比较,
**P<0.01;与SHR组比较,##P<0.01,n=6。
2.3各组大鼠外周血CD4+CD25+T细胞的表达频率流式细胞术检测结果显示,SHR组CD4+CD25+表达[(5.19±0.80)%]低于WKY组[(7.81±1.10)%],差异有统计学意义(P<0.01),SHR+NO干预组为(6.45±0.71)%,高于SHR组,差异有统计学意义(P<0.05,图3)。
2.4各组大鼠外周血血清TNF-α的表达ELISA检测结果显示,SHR组外周血血清TNF-α表达[(9.44±2.14)%]较WKY组[(6.39±0.59)%]升高,差异有统计学意义(P<0.01),SHR+NO干预组[(7.00±1.23)%]较SHR组下降,差异有统计学意义(P<0.05,图4)。
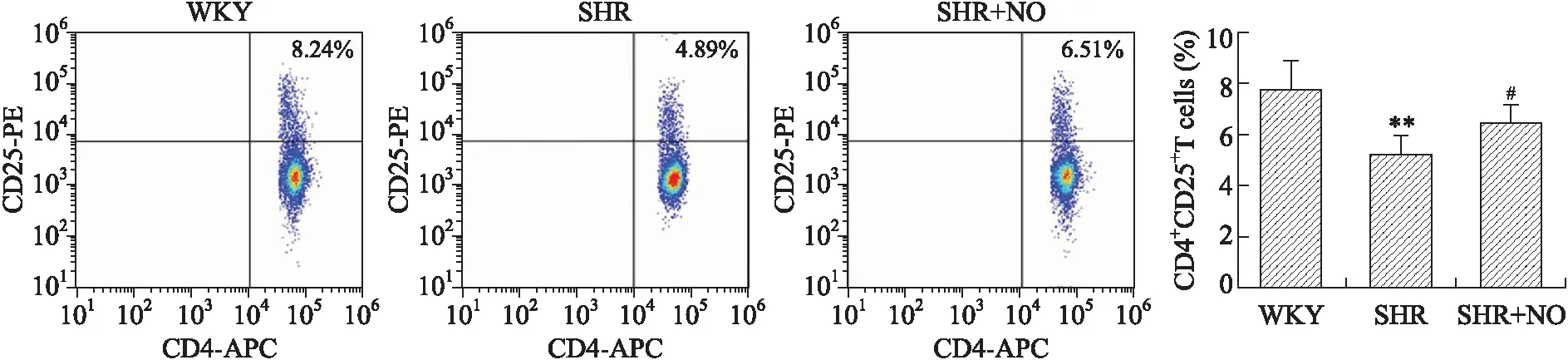
图3各组大鼠外周血CD4+CD25+T细胞的表达比率
Fig.3 The expression ratio of CD4+CD25+T cells in peripheral blood of the three groups
与WKY组比较,**P<0.01;与SHR组比较,#P<0.05,n=6。
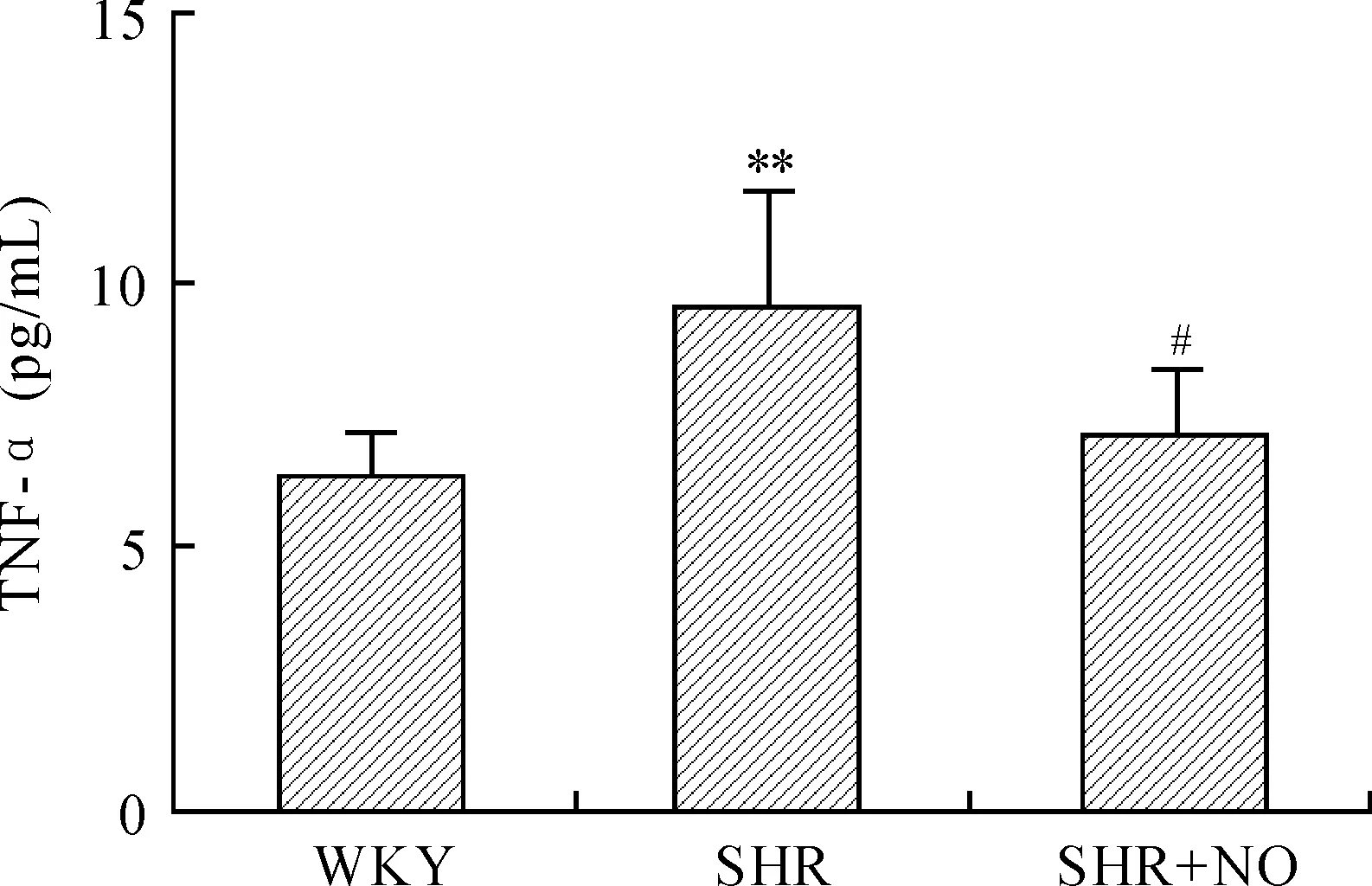
图4各组大鼠外周血血清TNF-α的表达
Fig.4 The expression of TNF-α in the serum of peripheral blood of the three groups
与WKY组比较,**P<0.01;与SHR组比较,#P<0.05,n=6。2.5各组大鼠脑基底动脉和肾脏病理学改变HE染色结果显示,SHR组较WKY组脑基底动脉内皮细胞受损、血管壁增厚、肾小球萎缩,且都有明显的炎性细胞浸润;SHR+NO干预组脑基底动脉内皮受损程度、血管壁增厚程度、肾小球萎缩程度和炎性细胞浸润程度均较SHR组减轻(图5)。
3 讨 论
高血压发病机制复杂,是最常见的慢性疾病之一,影响着约全球三分之一的成年人[10]。研究表明,高血压是一种以T淋巴细胞浸润血管和肾脏为特征的低度炎症性疾病[11]。本实验SHR大鼠脑基底动脉血管壁增厚,内皮受损,肾小球萎缩,炎性细胞浸润明显,这和孙莉等[12]研究结果一致;经NO干预后,SHR脑基底动脉内皮受损程度、血管壁增厚程度和肾脏炎性损伤程度均减轻,这与徐莉等[13]的研究结果相似,表明NO可减轻高血压造成的靶器官炎性损伤。
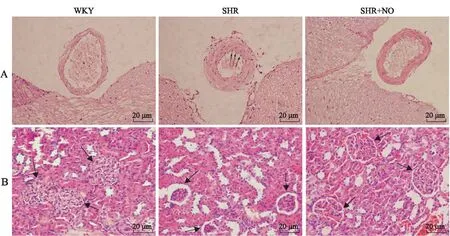
图5各组大鼠脑基底动脉和肾脏的HE染色
Fig.5 Hematoxylin and eosin staining of the rat brain basilar artery and kidney of the three groups (×200)
A:脑基底动脉;B:肾组织。标尺:20 μm。箭头:图A箭头所示为炎性细胞,图B箭头所示为肾小球。
T淋巴细胞是一种重要的免疫细胞,在高血压动物模型中血管和靶器官都显示有免疫细胞的浸润[14]。CD4+T细胞和CD8+T细胞作为T淋巴细胞的主要亚群,在调节机体免疫反应和炎症等方面起重要作用[15]。CD4+T细胞可分为Th1、Th2、Th17和Treg等亚群,其中Th1和Th17型细胞可促进高血压的发生和发展[3,16],而Treg细胞具有缓冲血压和减轻靶器官损害的作用[17]。TNF-α是一种促炎因子,可引起强效收缩血管活性物质内皮素-1的释放增加,导致血压升高[18],而应用TNF-α拮抗剂之后可以降低血压和血管超氧化物的产生[19]。本实验结果表明,SHR外周血CD4+/CD8+比值和TNF-α表达比率显著升高,CD4+CD25+T细胞表达下降,这与本课题组前期研究结果[20-21]相一致,也进一步表明高血压确实发生了免疫炎症反应,而给予NO干预后可下调CD4+/CD8+比值和TNF-α表达水平,上调CD4+CD25+T细胞表达,表明NO可改善高血压免疫炎症反应。
以上研究结果表明,NO可以通过调节高血压外周血T细胞亚群比值和抑制促炎因子释放,改善脑和肾脏等重要靶器官发生的炎性损伤,而本课题组前期研究结果[20-21]也表明缝隙连接蛋白在高血压免疫反应中起了重要作用,由此推测NO可能通过外周血T细胞间缝隙连接来调节T细胞亚群比值和抑制促炎因子释放进而改善靶器官炎性损伤的,但具体是通过何种机制还有待进一步研究证明。总之,本研究有助于进一步研究NO治疗高血压的可能机制,为治疗高血压免疫炎症反应提供新的思路和策略。
[1] 王恩帮,何芳. 缝隙连接与高血压的研究进展[J]. 中国现代医药杂志, 2010, 12(9):122-124.
[2] WENZEL P, KNORR M, KOSSMANN S, et al. Lysozyme M-positive monocytes mediate angiotensin II-induced arterial hypertension and vascular dysfunction[J]. Circulation, 2011, 124(12):1370-1381.
[3] NGUYEN H, CHIASSON VL, CHATTERJEE P, et al. Interleukin-17 causes Rho-kinase-mediated endothelial dysfunction and hypertension[J]. Cardiovasc Res, 2013, 97(4):696-704.
[4] RODRIGUEZ-ITURBE B, PONS H, JOHNSON RJ. Role of the immune system in hypertension[J]. Physiol Rev, 2017, 97(3):1127-1164.
[5] SCHIFFRIN EL. T lymphocytes: A role in hypertension?[J]. Curr Opin Nephrol Hypertens, 2010, 19(2):181-186.
[6] SCHIFFRIN EL. The immune system: Role in hypertension[J]. Can J Cardiol, 2013, 29(5):543-548.
[7] NUMAGUCHI K, EGASHIRA K, TAKEMOTO M, et al. Chronic inhibition of nitric oxide synthesis causes coronary microvascular remodeling in rats[J]. Hypertension, 1995, 26(6 Pt 1):957-962.
[8] MADHU BP, SINGH KP, SAMINATHAN M, et al. Role of nitric oxide in the regulation of immune responses during rabies virus infection in mice[J]. Virusdisease, 2016, 27(4):387-399.
[9] LAI CH, LEE CH, HUNG CY, et al. Oral citrulline mitigates inflammation and jejunal damage via the inactivation of neuronal nitric oxide synthase and nuclear factor-kappaB in intestinal ischemia and reperfusion[J]. J Parenter Enteral Nutr, 2017, 41(3):422-435.
[10] JAMES PA, OPARIL S, CARTER BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults: report from the panel members appointed to the Eighth Joint National Committee (JNC 8)[J]. JAMA, 2014, 311(5):507-520.
[11] MCMASTER WG, KIRABO A, MADHUR MS, et al. Inflammation, immunity, and hypertensive end-organ damage[J]. Circ Res, 2015, 116(6):1022-1033.
[12] SUN L, GAO YH, TIAN DK, et al. Inflammation of different tissues in spontaneously hypertensive rats[J]. Acta Physiologica Sinica, 2006, 58(4):318-323.
[13] 徐莉. 高血压脑出血模型大鼠不同时间段脑损伤程度与NO含量和C9表达的关系[J]. 湖北科技学院学报(医学版), 2014, 28(2):103-105.
[14] MATTSON DL. Infiltrating immune cells in the kidney in salt-sensitive hypertension and renal injury[J]. Am J Physiol Renal Physiol, 2014, 307(5): F499-508.
[15] AMIN K. The role of the T lymphocytes and remodeling in asthma[J]. Inflammation, 2016, 39(4):1475-1482.
[16] ZHANG JD, PATEL MB, SONG YS, et al. A novel role for type 1 angiotensin receptors on T lymphocytes to limit target organ damage in hypertension[J]. Circ Res, 2012, 110(12):1604-1617.
[17] BARHOUMI T, KASAL DA, LI MW, et al. T regulatory lymphocytes prevent angiotensin II-induced hypertension and vascular injury[J]. Hypertension, 2011, 57(3):469-476.
[18] FANG C, LEI J, ZHOU SX, et al. Association of higher resistin levels with inflammatory activation and endothelial dysfunction in patients with essential hypertension[J]. Chin J Med, 2013, 126(4):646-649.
[19] GUZIK TJ, HOCH NE, BROWN KA, et al. Role of the T cell in the genesis of angiotensin II induced hypertension and vascular dysfunction[J]. J Exp Med, 2007, 204(10):2449-2460.
[20] 王爱,张海超,张亮,等. 自发性高血压大鼠外周血CD4+/CD8+T淋巴细胞比率增加且连接子蛋白40(Cx40)和炎症因子水平升高[J]. 细胞与分子免疫学杂志, 2016, 32(2):145-148.
[21] 张海超,王爱,张亮,等. 自发性高血压大鼠肾损伤伴随调节性T淋巴细胞下降及连接蛋白43的表达增强[J]. 免疫学杂志, 2015, 31(11):941-944.
EffectsofNOonTlymphocytesubsetsinperipheralbloodofspontaneouslyhypertensiverats
SHEN Tu-wang1,2, SHAN Li-ya1,2, YU Xiu-shi1,2, PENG Min1,2, NI Xin1,2, LI Li1,2, SI Jun-qiang1,2, LI Xin-zhi1,3, MA Ke-tao1,2
(1. Key Laboratory of Xinjiang Endemic and Ethnic Diseases; 2. Department of Physiology; 3. Department of Pathophysiology, School of Medicine of Shihezi University, Shihezi 832000, China)
ObjectiveTo investigate whether NO can relieve hypertensive cerebrovascular and renal injury by regulating the ratio of peripheral blood T lymphocyte subsets and reducing proinflammatory cytokine release.MethodsTwelve-week SHR and WKY rats were randomly divided into three groups: WKY group, SHR group and SHR+NO intervention group, with 6 rats in each group. Rats in SHR+NO intervention group were injected intraperitoneally with sodium nitroprusside according to 10 μg/(kg·d) for 4 weeks, while WKY group and SHR group were injected intraperitoneally with an equal amount of saline for 4 weeks. After measuring the tail artery blood pressure, basilar artery and renal pathological changes were observed by HE staining; the rates of CD4+/CD8+and CD4+CD25+T cells were detected by flow cytometry; and the expression of TNF-α was detected by ELISA.ResultsThe expressions of CD4+/CD8+and TNF-α in SHR group were significantly higher than those in WKY group (P<0.01) while the rate of CD4+CD25+in SHR group was significantly lower than that in WKY group (P<0.01). The expressions of CD4+/CD8+and TNF-α in SHR+NO intervention group were significantly lower than those in SHR group whereas the rate of CD4+CD25+was significantly higher than that in SHR group (P<0.05).ConclusionNO can improve the target organ damage caused by hypertension by regulating the peripheral blood T lymphocyte subsets ratio and reducing the release of proinflammatory factors.
spontaneously hypertensive rat; T lymphocyte; NO; TNF-α
2017-04-29
2017-07-24
国家自然科学基金资助项目(No.81660271);石河子大学国际合作项目(No.GJHZ201603);石河子大学应用基础研究青年项目(No.2015ZRKXYQ-LH13,2015ZRKXYQ-LH12);兵团中青年科技创新领军人才计划(No.2016BC006)
Supported by the National Natural Science Foundation of China (No.81660271), International Cooperation Project of Shihezi University (No.GJHZ201603), the Basic Research on Application of Shihezi University Youth Project (No.2015ZRKXYQ-LH13, 2015ZRKXYQ-LH12), and Corps Young and Middle-aged Scientific and Technological Innovation Leading Talent Program (No.2016BC006)
李新芝. E-mail: lixinzhi@shzu.edu.cn;马克涛. E-mail: maketao@hotmail.com
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171204.1732.012.html(2017-12-04)
R392.9
A
10.7652/jdyxb201801007
(编辑 国 荣)
