血红素加氧酶-1在胃癌顺铂化疗敏感性中的作用
2018-01-10张彦兵陕西省人民医院肿瘤内科陕西西安70068陕西省肿瘤医院肿瘤内科陕西西安7006陕西省人民医院消化内一科陕西西安70068西安交通大学第一附属医院肝胆外科陕西西安7006
蒋 洁,张彦兵,宗 伟,曹 菲,韩 亮(. 陕西省人民医院肿瘤内科,陕西西安 70068;. 陕西省肿瘤医院肿瘤内科,陕西西安 7006;. 陕西省人民医院消化内一科,陕西西安 70068;. 西安交通大学第一附属医院肝胆外科,陕西西安 7006)
血红素加氧酶-1在胃癌顺铂化疗敏感性中的作用
蒋 洁1,张彦兵2,宗 伟3,曹 菲1,韩 亮4
(1. 陕西省人民医院肿瘤内科,陕西西安 710068;2. 陕西省肿瘤医院肿瘤内科,陕西西安 710061;3. 陕西省人民医院消化内一科,陕西西安 710068;4. 西安交通大学第一附属医院肝胆外科,陕西西安 710061)
目的研究血红素加氧酶-1(HO-1)及其抑制剂在胃癌顺铂(CDDP)化疗中的作用,为胃癌化疗敏感性提供潜在的增敏靶点。方法MTT法检测锌原卟啉IX (ZnPPIX)及CDDP对胃癌细胞株SGC7901增殖能力的影响;Western blot和Real-time PCR分别检测胃癌细胞中HO-1蛋白和mRNA的表达;构建裸鼠皮下种植瘤模型并进一步观察ZnPPIX 及CDDP对胃癌成瘤能力的影响。结果CDDP联合ZnPPIX干预胃癌细胞明显抑制肿瘤细胞的增殖率(P<0.05);同时,CDDP胃癌细胞中HO-1 mRNA水平和蛋白的表达增加(P<0.05)。而CDDP联合ZnPPIX干预细胞组的HO-1的表达较对照组明显降低(P<0.05)。荷瘤实验结果显示,CDDP可抑制胃癌皮下种植瘤的生长,肿瘤体积和质量明显降低。结论HO-1抑制剂ZnPPIX可增强CDDP对胃癌的化疗敏感性,有可能成为潜在的胃癌CDDP化疗方案的增敏剂。
胃癌;顺铂(CDDP);血红素加氧酶-1(HO-1);锌原卟啉IX (ZnPPIX);化疗敏感性
血红素加氧酶-1(heme oxygenase-1, HO-1)又称热休克蛋白32,是催化血红素氧化降解的起始酶和限速酶,参与体内多种抗炎及抗氧化过程[1-2],与恶性肿瘤凋亡、免疫逃逸和氧化应激等都有密切关系[3]。HO-1高表达也可能与肿瘤预后不良、转移及肿瘤耐药相关[4-5]。HO-1发挥活性的作用底物本质上是铁原卟啉(FePP),而锌原卟啉IX(ZnPPIX)作为HO-1的特异性抑制剂,能够明显抑制HO-1的表达[6-7]。文献报道,锌原卟啉可促进乳腺癌细胞凋亡,增强肝癌细胞的化疗敏感性[8-9]。HO-1在胃癌组织中表达升高[10]。逐步深入的相关研究显示,ZnPPIX通过抑制血管发生而抑制胃癌裸鼠移植瘤模型的生长[11-12]。目前,关于锌原卟啉对胃癌细胞的研究较少。本课题组在前期的研究中发现HO-1抑制剂ZnPPIX对胃癌细胞增殖和侵袭能力具有明显的抑制作用。本实验探讨HO-1及其抑制剂ZnPPIX对胃癌细胞株SGC7901化疗敏感性的影响,并初步观察顺铂(cisplatin, CDDP)与HO-1的相互作用,分别从细胞水平及动物模型中观察胃癌生长能力的变化。
1 材料与方法
1.1材料人胃癌细胞株SGC7901由本实验室提供。胎牛血清、DMEM培养基(Gibco公司);HO-1抑制剂ZnPPIX、内参GAPDH抗体以及二抗(Abcom及Santa Cruz公司)。常规肿瘤细胞培养方法培养SGC7901,取对数生长期细胞进行实验。
1.2MTT法检测肿瘤细胞的增殖能力活细胞线粒体内的琥珀酸脱氢酶能使外源性的MTT(噻唑蓝)还原,形成不溶于水的蓝紫色针状结晶并沉积在细胞中,DMSO可溶解这种蓝紫色结晶,通过酶联免疫检测仪测定其吸光度值以间接反映活细胞数量。为了证明HO-1和CDDP在胃癌化疗中的作用,实验分为空白对照组、CDDP组(5 μg/mL)、ZnPPIX组(100 μmol/L)和CDDP联合ZnPPIX组。将8×103个肿瘤细胞接种于96孔培养板中,各组分别培养24、48、72 h。每孔加入MTT溶液培养,弃去原液,每孔加入DMSO,置于摇床上低速振荡;在酶联免疫检测仪上测定各孔吸光度(A)值。计算平均增殖率,增殖率=实验孔A值/对照孔A值。
1.3Westernblot检测胃癌细胞HO-1蛋白的表达实验分为空白对照组、CDDP组(5 μg/mL)、ZnPPIX组(100 μmol/L)和CDDP联合ZnPPIX组。干预48 h,加入细胞裂解液RIPA提取细胞总蛋白。BCA法测定蛋白浓度。将20 μL样品依次加入制好的120 g/L SDS-PAGE胶中电泳后,采用半干转膜法转膜1 h。TBST洗膜2次后加入HO-1一抗(1∶500),4 ℃孵育过夜。再次洗膜2次加入二抗(1∶1 000)常温孵育2 h。洗膜后暗室内加入ECL化学发光液,显影后应用凝胶显影系统拍照并分析蛋白表达水平。
1.4Real-timePCR检测HO-1mRNA的表达变化分组同1.3,分别作用48 h,参照操作说明提取各组细胞DNA。HO-1 mRNA引物序列分别为CAGGCAGAGGGTGATAGAAGAGG,CTGGGAGCG-GGTGTTGAGTG;GAPDH为内参对照,引物序列分别为ATCGTGCGTGACATTAAGGAGAAG,AG-GAAGGAAGGCTGGAAGAGTG。Real-time PCR反应条件:95.0 ℃预变性1 min后进入40个循环(95.0 ℃变性15 s;55.0 ℃退火15 s;72.0 ℃延伸45 s)。琼脂糖凝胶电泳,计算机对电泳条带进行扫描分析(Gel Works分析),HO-1 mRNA相对表达量=HO-1 mRNA吸光度/内参GAPDH吸光度。
1.5荷瘤裸鼠模型的构建筛选生长状况良好的6周龄雌性裸鼠,每只裸鼠体质量20 g左右。胃癌细胞制成单细胞悬液,计数并调整细胞密度为108/mL。微量注射器吸取单细胞悬液0.1 mL,水平20°进针注射入裸鼠臀部皮下。荷瘤裸鼠模型构建7 d进行分组,为空白对照组、CDDP组、CDDP联合ZnPPIX组和ZnPPIX组,腹腔注射药物干预,给药剂量分别为CDDP 25 mg/kg、ZnPPIX 5 mg/kg,间日给药。观察裸鼠及肿瘤生长情况,术后21 d测量肿瘤重量,统计相关数据。
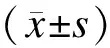
2 结 果
2.1HO-1抑制剂增强CDDP对胃癌细胞的抑制作用MTT检测结果(图1)显示,在各干预时间点,CDDP与对照组相比,均能够显著抑制胃癌细胞的增殖能力(P<0.05)。CDDP(5 μg/mL)联合应用ZnPPIX(100 μmol/L)组更明显地抑制肿瘤细胞的增殖率,差异均具有统计学意义(P<0.05);而单独应用ZnPPIX组的细胞增殖抑制程度与对照组相比差异具有统计学意义(P<0.05),但其增殖抑制率明显低于CDDP或联合干预组。
2.2各组细胞HO-1的mRNA和蛋白表达的变化Real-time PCR和Western blot检测结果显示,CDDP组胃癌细胞中HO-1的表达较对照组增加,差异具有统计学意义(P<0.05)。而作为HO-1特异性抑制剂的ZnPPIX作用时,胃癌细胞中HO-1的表达明显抑制,差异具有统计学意义(P<0.05)。而CDDP联合ZnPPIX干预细胞组中HO-1的表达较对照组及CDDP组减弱,差异有统计学意义(P<0.05,图2)。这说明CDDP可促进胃癌细胞HO-1表达增高,而这种促进作用可被ZnPPIX有效逆转。提示HO-1在胃癌CDDP化疗中有重要作用。

图1HO-1抑制剂对胃癌细胞CDDP化疗敏感性的影响
Fig.1 Effects of ZnPPIX on the chemosensitivity of gastric cancer cells
与对照组(Control)比较,*P<0.05。

图2CDDP对胃癌细胞中HO-1表达的影响
Fig.2 Effects of CDDP on the expression of HO-1 in gastric cancer cells
A:mRNA的表达情况比较;B:Western blot检测结果。与对照组(Control)比较,*P<0.05;与CDDP组比较,#P<0.05。
2.3CDDP联合ZnPPIX抑制皮下种植瘤的生长动物实验结果(图3)显示,对照组平均瘤重1.51 g,CDDP组0.90 g,CDDP联合ZnPPIX组0.53 g,单独应用ZnPPIX组1.34 g。CDDP较对照组抑制胃癌种植瘤的生长,而CDDP联合ZnPPIX组较对照组及CDDP组显著抑制了肿瘤的增长,差异均具有统计学意义(P<0.05)。而单独应用ZnPPIX组与对照组比较差异无统计学意义(P>0.05)。可见HO-1抑制剂ZnPPIX在胃癌CDDP化疗中起到明显的增敏作用。

图3HO-1抑制剂对裸鼠胃癌皮下种植瘤CDDP化疗敏感性的影响
Fig.3 Effects of ZnPPIX on the chemosensitivity in nude mice
A:裸鼠皮下成瘤后的肿瘤形态;B:统计分析各组种植瘤瘤体质量。与对照组(Control)比较,*P<0.05;与CDDP组比较,#P<0.05。
3 讨 论
HO-1是血红素分解代谢的关键限速酶,是HO家族中的一员,在多种肿瘤组织中的表达升高,并参与肿瘤的侵袭和转移,与肿瘤的恶性进展密切相关。有实验已经发现,HO-1在胃癌的进展过程中扮演重要角色[13-14]。本研究也发现,HO-1对胃癌细胞的增殖和侵袭有促进作用,而其抑制剂ZnPPIX可明显抑制肿瘤的生长活性。
CDDP属于胃癌化疗的经典药物。有研究发现在多种肿瘤进展及治疗中,CDDP化疗机制涉及到HO-1及其通路分子,并增强其化疗敏感性[15-18]。在本实验中,我们探讨HO-1及其抑制剂ZnPPIX对胃癌细胞株SGC7901化疗敏感性的影响,并探究CDDP对HO-1表达的影响,从细胞学和体内实验两个层面进一步验证课题假设。结果发现,ZnPPIX可增强CDDP对胃癌的化疗作用,并且在细胞学实验中发现CDDP可明显促进胃癌细胞HO-1的表达,而应用ZnPPIX可明显逆转这种促进作用。故得出HO-1抑制剂通过增敏CDDP的化疗效果发挥作用。在体内实验中,构建裸鼠皮下种植瘤模型,应用不同药物干预裸鼠后发现,CDDP联合ZnPPIX后显著抑制了胃癌皮下种植瘤的增长能力,从而在体内进一步验证了体外研究结果。
然而,胃癌的化疗过程和机制较为复杂。药物的联合应用、药物的剂量、给药的途径和给药方式,都能够影响到化疗药物对胃癌的治疗效果,所以应用CDDP单药模拟胃癌化疗过程具有一定局限性。本课题主要研究HO-1抑制剂对CDDP化疗的增敏作用,故应用单药化疗方案。在后期的研究中,仍需将理想的模拟人体胃癌化疗过程作为建模目标。同时,在本实验细胞学研究中CDDP可影响HO-1的表达,但其内在机制如何,在后期的实验中仍需进一步论证及阐明。本课题中,ZnPPIX可逆转CDDP对HO-1的促进作用,而不是抵消此种促进作用,其中量效关系在下一步实验中仍需探讨。体内实验作为体外实验的补充性论证,在观察胃癌细胞在体内成瘤的过程中,各干预组药物在体内的代谢及对肿瘤生长产生影响的内在机制仍需进行病理和生化相关研究。
[1] KOZAKOWSKA M, DULAK J, JOZKOWICZ A. Heme oxygenase-1—more than the cytoprotection[J]. Postepy Biochem, 2015, 61(2):147-158.
[2] RYTER SW, CHOI AM. Targeting heme oxygenase-1 and carbon monoxide for therapeutic modulation of inflammation[J]. Transl Res, 2016, 167(1):7-34.
[3] LUO H, SHAO Y, YAO N, et al. Association of heme oxygenase-1 polymorphisms with cancer risk: A systematic review and meta-analysis[J]. J Buon, 2015, 20(4):1142-1153.
[4] CHAU LY. Heme oxygenase-1: Emerging target of cancer therapy[J]. J Biomed Sci, 2015, 22(1):22-29.
[5] ZHAO H, OZEN M, WONG RJ, et al. Heme oxygenase-1 in pregnancy and cancer: Similarities in cellular invasion, cytoprotection, angiogenesis, and immunomodulation[J]. Front Pharmacol, 2014, 5(5):295-305.
[6] FANG J, NAKAMURA H, IYER AK. Tumor-targeted induction of oxystress for cancer therapy[J]. J Drug Target, 2007, 15(7):475-486.
[7] FANG J, SEKI T, MAEDA H. Therapeutic strategies by modulating oxygen stress in cancer and inflammation[J]. Adv Drug Deliv Rev, 2009, 61(4):290-302.
[8] 张隽开,王忠裕,巩鹏,等. ZnPP Ⅸ对肝癌耐药细胞株Bel/Fu表达HO-1、GST-π及化疗敏感性的影响[J]. 中国普外基础与临床杂志, 2011, 18(5):503-506.
[9] 刘胜春,姚榛祥,孙正魁. 锌原卟啉对种植性乳腺癌细胞凋亡的影响[J]. 中华实验外科杂志, 2006, 23(5):525-527.
[10] YIN Y, LIU Q, WANG B, et al. Expression and function of heme oxygenase-1 in human gastric cancer[J]. Exp Biol Med (Maywood), 2012, 237(4):362-371.
[11] MOTOVALI BM, HAMIDY M. Association between GT-repeat polymorphism at heme oxygenase-1 gene promoter and gastric cancer and metastasis[J]. Tumour Biol, 2015, 36(6):4757-4762.
[12] SHANG FT, HUI LL, AN XS, et al. ZnPPIX inhibits peritoneal metastasis of gastric cancer via its antiangiogenic activity[J]. Biomed Pharmacother, 2015, 71(1):240-246.
[13] MIAO RZ, LIU LQ, CHEN L, et al. Activity of heme oxygenase-1 affects expression levels of hypoxia inducible factor-1 geneinvitro[J]. Chin Med J (Engl), 2012, 125(7):1310-1315.
[14] GOBERT AP, VERRIERE T, ASIM M, et al. Heme oxygenase-1 dysregulates macrophage polarization and the immune response to Helicobacter pylori[J]. J Immunol, 2014, 193(6):3013-3022.
[15] WU S, ZHANG T, DU J. Ursolic acid sensitizes cisplatin-resistant HepG2/DDP cells to cisplatin via inhibiting Nrf2/ARE pathway[J]. Drug Des Devel Ther,2016,10(1):3471-3481.
[16] LV X, SONG DM, NIU YH, et al. Inhibition of heme oxygenase-1 enhances the chemosensitivity of laryngeal squamous cell cancer Hep-2 cells to cisplatin[J]. Apoptosis, 2016, 21(4):489-501.
[17] JO EJ, PARK SJ, KIM BC. Propyl gallate sensitizes human lung cancer cells to cisplatin-induced apoptosis by targeting heme oxygenase-1 for TRC8-mediated degradation[J]. Eur J Pharmacol, 2016, 788(10):321-327.
[18] WANG LH, LI Y, YANG SN, et al. Gambogic acid synergistically potentiates cisplatin-induced apoptosis in non-small-cell lung cancer through suppressing NF-κB and MAPK/HO-1 signalling[J]. Br J Cancer, 2014, 110(2):341-352.
Effectsofhemeoxygenase-1oncisplatinchemosensitivityingastriccancer
JIANG Jie1, ZHANG Yan-bing2, ZONG Wei3, CAO Fei1, HAN Liang4
(1. Department of Medical Oncology, Shaanxi Provincial People’s Hospital, Xi’an 710068; 2. Department of Medical Oncology, Shaanxi Provincial Tumor Hospital, Xi’an 710061;3. the First Department of Gastroenterology, Shaanxi Provincial People’s Hospital,Xi’an 710068; 4. Department of Hepatobiliary Surgery, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
ObjectiveTo explore the roles of heme oxygenase-1 (HO-1) and protoporphyrin zinc IX (ZnPPIX), its inhibitor, in cisplatin chemotherapy for gastric cancer so as to provide potential targets for chemosensitivity in gastric cancer.MethodsGastric cancer cell line SGC7901 was usedinvitro. MTT assay was carried out to determine the effects of ZnPPIX and CDDP on the proliferation in gastric cancer cells. The expression of HO-1 in gastric cancer cells was measured by Real-time PCR and Western blot, respectively. The gastric cancer xenografts in nude mice were used to study the effects of ZnPPIX and CDDP in gastric cancer on tumor formationinvivo.ResultsThe proliferation of cancer cells, interfered by CDDP in combination with ZnPPIX, could be significantly inhibited (P<0.05). Moreover, CDDP could increase the expression of HO-1 in gastric cancer cells, which was reversed by ZnPPIX (P<0.05). The animal experiment showed that CDDP could inhibit gastric cancer growth in nude mice and reduce tumor volume and weight.ConclusionZnPPIX could enhance the chemosensitivity of CDDP in gastric cancer, which may be a potential sensitizer of cisplatin-based chemotherapy in gastric cancer.
gastric cancer; cisplatin (CDDP); heme oxygenase-1 (HO-1); protoporphyrin zinc IX (ZnPPIX); chemosensitivity
2017-04-19
2017-07-03
陕西省自然科学基金资助项目(No.2014JM4141)
Supported by the Natural Science Foundation of Shaanxi Province (No.2014JM4141)
韩亮,主治医师. E-mail: hanliangxjtu@163.com.
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171204.1755.018.html(2017-12-04)
R735.2
A
10.7652/jdyxb201801012
(编辑 国 荣)
