β2受体阻滞剂诱导胰腺癌细胞G1/S期阻滞的实验研究
2018-01-10沙焕臣雷建军马清涌西安交通大学第一附属医院肝胆外科陕西西安710061
张 东,沙焕臣,雷建军,王 铮,马清涌(西安交通大学第一附属医院肝胆外科,陕西西安 710061)
β2受体阻滞剂诱导胰腺癌细胞G1/S期阻滞的实验研究
张 东,沙焕臣,雷建军,王 铮,马清涌
(西安交通大学第一附属医院肝胆外科,陕西西安 710061)
目的研究β2受体阻滞剂ICI118,551诱导胰腺癌细胞G1/S期阻滞及其相关机制。方法应用β2受体阻滞剂ICI118,551和β1受体阻滞剂美托洛尔干预胰腺癌细胞,通过流式细胞仪检测细胞周期、Western blot技术检测β2受体阻滞剂对细胞周期调节蛋白Cyclin D1和Cyclin E表达的影响,EMSA技术检测核转录因子NF-κB的活性,构建裸鼠肾包膜下移植瘤模型检测肿瘤增殖情况。结果ICI118,551可显著诱导胰腺癌细胞G1/S期阻滞,并显著优于美托洛尔组(P<0.05);ICI118,551干预组抑制Cyclin D1和Cyclin E的表达,并可抑制NF-κB的活性;裸鼠肾包膜下移植瘤实验显示ICI118,551可显著抑制胰腺癌细胞的增殖。结论β2受体阻滞剂ICI118,551可有效诱导胰腺癌细胞G1/S期阻滞,抑制胰腺癌细胞的增殖。
β2受体阻滞剂ICI118,551;G1/S期阻滞;Cyclin D1;Cyclin E
吸烟是胰腺癌发生的独立危险因素之一[1],与胰腺癌的发生具有相关性。4-(甲基亚硝胺基)-1-(3-吡啶)-1-丁酮[4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone, NNK]是烟草致癌物的衍生物,可高效并特异地结合β2肾上腺素能受体(β2受体)并激活β2受体下游信号通路,促进胰腺癌的恶性进展[2]。β2受体阻滞剂可抑制胰腺癌细胞Src酪氨酸激酶和Ras依赖的MAPKs通路,降低核转录因子CREB、NF-κB和AP-1的活性,抑制下游分子VEGF、MMP-2、MMP-9和COX-2的表达,从而可抑制胰腺癌细胞的增殖及转移[3-4]。
ICI118,551是具有反向激活作用的β2受体抑制剂,可特异性地结合细胞膜表面的β2受体并对胰腺癌细胞周期产生抑制作用[5]。G1/S期转换是重要的细胞周期调控点,细胞周期调节蛋白D1(Cyclin D1)是细胞由G1期向S期转换的重要调节蛋白[6]。ICI118,551可能通过抑制β2受体所介导的相关信号传导通路抑制核转录因子NF-κB的表达,进一步调节Cyclin D1和Cyclin E蛋白的表达,从而诱导胰腺癌细胞周期G1/S期阻滞[7]。本研究旨在揭示β2受体特异性阻滞剂ICI118,551对胰腺癌细胞周期的影响及其机制。
1 材料与方法
1.1材料MIA PaCa-2与BxPC-3胰腺癌细胞株购自美国ATCC细胞中心;高糖DMEM培养基及小牛血清购自Gibco公司;ICI118,551和美托洛尔购自Sigma公司;PI试剂购自BD公司;Anti-Cyclin D1、Anti-Cyclin E购自Cell Signal公司;Anti-β-actin购自ABCAM公司。
1.2胰腺癌细胞的培养应用含100 mL/L小牛血清及含青霉素和链霉素的高糖DMEM培养液在50 mL/L CO2、37 ℃培养箱中培养MIA PaCa-2与BxPC-3细胞。利用100 μmol/L的β2受体阻滞剂ICI118,551和β1受体阻滞剂美托洛尔分别干预MIA PaCa-2与BxPC-3细胞24 h。
1.3流式细胞仪检测细胞周期取对数生长期的细胞,以每孔1×106个细胞接种于6块6孔细胞培养板中,每孔体积1 mL;利用100 μmol/L ICI118,551和100 μmol/L美托洛尔干预细胞24 h后收获细胞,700 mL/L冰乙醇固定细胞并在4 ℃过夜。400 r/min离心5 min收集细胞,每离心管内加入100 μL染色缓冲液,吹打细胞后加入RNase,37 ℃水箱孵育30 min。将细胞移入流式管,每管加入PI 10 μL,避光孵育30 min后上机检测。细胞各周期百分比利用ModFit计算机软件进行分析。
1.4裸鼠肾包膜下移植瘤模型细胞增殖的检测BxPC-3和MIA PaCa-2细胞制成1×108细胞悬液,4 ℃保存。经裸鼠腹腔注射2 g/L戊巴比妥纳麻醉。置裸鼠于俯卧位,常规消毒铺无菌巾后,自右侧肾脏区域平行脊椎切开7 mm切口。将肾脏拖出后轻提肾包膜,以16号细针将细胞悬液50 μL接种于肾囊膜下,成功后还纳肾脏于腹腔,逐层关腹。分为两种细胞株分别设置PBS对照组及ICI118,551干预组,每组10只裸鼠。每日观察裸鼠的一般情况:包括饮食、活动情况、被毛、体质量等;2 d后每组裸鼠每日按组分别给予腹腔注射PBS液和ICI118,551,干预剂量为5 mg/kg。术后10 d处死裸鼠,开腹并切取肾脏,测量瘤体长径与宽径,瘤体大小=(长径+宽径)/2。将荷瘤肾固定于4 g/L 多聚甲醛中性固定液中,常规行HE 染色,显微镜下观察移植瘤侵袭肾脏的深度。
1.5EMSA检测NF-κB的表达提取核蛋白,经BCA蛋白质定量试剂盒测定核蛋白的浓度。探针NF-κB:5′-AGTTGAGGGGACTTTCCCAGGC-3′,3′-TCAACTCCCCTGAAAGGGTCCG-5′;制50 mL/L的PAGE胶后室温下避光孵育20 min,之后加入3 μL核蛋白,利用10×Orange Loading Buffer 2.2 μL上样,Bio-Rad电泳后上机检测,检测结果利用Odyssey Infrared Imaging System软件分析。
1.6Westernblot检测细胞周期的相关分子提取ICI118,551和美托洛尔干预后胰腺癌细胞总蛋白,SDS蛋白质聚丙烯酰胺凝胶电泳后转至NC膜,利用Anti-Cyclin D1及Anti-Cyclin E抗体检测目的蛋白,ECL发光剂并在暗室内曝光,全自动凝胶成像系统显示结果并分析。
1.7统计学分析使用SPSS 24.0进行数据分析。数据以均数±标准差表示,应用t检验进行统计检验;组间的比较应用析因分析进行统计检验,进一步两两比较采用LSD-t法,数据符合正态性及方差齐性。所有假设检验的检验水准α设定为0.05,以P<0.05 为差异具有统计学意义。
2 结 果
2.1β受体阻滞剂诱导胰腺癌细胞G1/S期阻滞使用流式细胞仪检测β受体阻滞剂美托洛尔和ICI118,551(100 μmol/L)对胰腺癌细胞株MIA PaCa-2与BxPC-3细胞周期的影响。如图1所示,在G0-G1期,β受体阻滞剂不同程度上增加了胰腺癌细胞G1期的比值(P<0.05);而在S期,β受体阻滞剂不同程度上减低了胰腺癌细胞S期的比值(P<0.05);就单独效应而言,β2受体阻滞剂增加G1期比值和减低S期比值都显著高于β1受体阻滞剂(P<0.05,表1)。
在两株细胞之间,β受体阻滞剂对BxPC-3的G1/S期阻滞效应优于MIA PaCa-2(P<0.05),在β2受体阻滞剂组更加显著(表1)。k-ras基因起着重要作用,Ras是胰腺癌细胞周期的重要调控分子,由于BxPC-3细胞是k-ras野生型细胞株,故对于BxPC-3细胞的G1/S期阻滞效应作用相对较强。
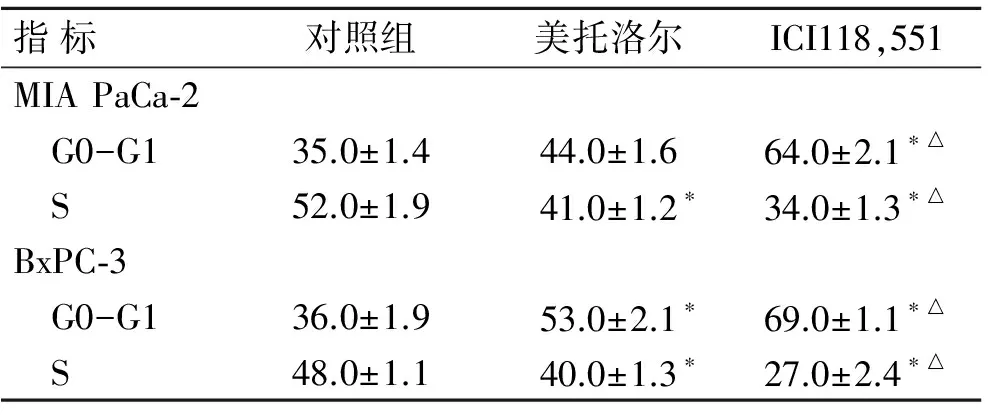
2.2ICI118,551抑制裸鼠肾包膜下胰腺癌移植瘤的增殖利用MIA PaCa-2和BxPC-3细胞构建裸鼠肾包膜下移植瘤模型,构建成功后,给予ICI118,551干预裸鼠,检测胰腺癌细胞的生长能力。如图2所示,在对照组,即未给予干预条件下,MIA PaCa-2和BxPC-3细胞成瘤,并侵袭肾小球和肾小管,产生压迫、包绕和侵蚀肾小球和肾小管效应,并可进一步浸入肾髓质;而在ICI118,551组,其细胞侵袭的深度和肿块的大小与对照组相比较存在统计学差异(P<0.05),明显抑制细胞的增殖、生长和侵袭能力。

图1β受体阻滞剂诱导胰腺癌细胞G1/S期阻滞
Fig.1 β-adrenergic antagonists induced G1/S phase arrest in MIA PaCa-2 and BxPC-3 cell lines
A:美托洛尔和ICI118,551干预胰腺癌MIA PaCa-2和BxPC-3细胞后细胞周期检测;B:细胞周期检测统计分析图。
表1β受体阻滞剂对胰腺癌细胞周期的影响
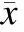
与对照组比较,*P<0.05;与美托洛尔组比较,△P<0.05。
2.3β受体阻滞剂抑制胰腺癌细胞NF-κB的活性EMSA结果显示,两种β受体阻滞剂均可抑制NF-κB的活性(图3),美托洛尔和ICI118,551可抑制NF-κB的活性(P<0.05),但ICI118,551抑制效应大于美托洛尔(P<0.05)。
2.4β受体阻滞剂抑制胰腺癌细胞CyclinD1和CyclinE蛋白的表达利用Western blot检测β受体阻滞剂干预胰腺癌细胞株Cyclin D1和Cyclin E蛋白的表达(图4)。细胞周期指标Cyclin D1和Cyclin E检测结果显示,β2受体阻滞剂抑制了胰腺癌细胞株Cyclin D1和Cyclin E的表达(P<0.05)。β2受体阻滞剂对胰腺癌细胞株BxPC-3的Cyclin D1和Cyclin E的抑制效应要高于MIA PaCa-2(P<0.05)。
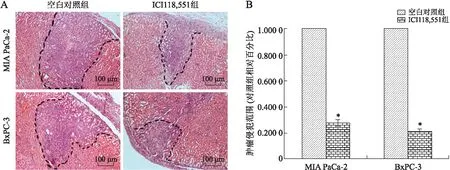
图2ICI118,551抑制裸鼠肾包膜下胰腺癌移植瘤的增殖
Fig.2 ICI118,551 inhibited the proliferation of pancreatic cancer cells in the renal capsule xenografts in nude mice
A:胰腺癌MIA PaCa-2和BxPC-3细胞构建裸鼠肾包膜下移植瘤模型,ICI118,551干预后移植瘤生长变化;B:肾包膜下移植瘤增殖的统计分析图。

图3β受体阻滞剂抑制胰腺癌细胞NF-κB的活性
Fig.3 β-adrenergic antagonists inhibited the activation of NF-κB
A:美托洛尔和ICI118,551干预胰腺癌MIA PaCa-2和BxPC-3细胞后NF-κB活性检测;B:NF-κB活性检测的统计分析图。
3 讨 论
本研究数据显示,ICI118,551有效诱导了胰腺癌MIA PaCa-2与BxPC-3细胞周期G1/S期阻滞,这可能是通过抑制Ras通路达到G1/S期阻滞效应[8]。
β1受体阻断剂美托洛尔的G1/S阻滞效应弱于特异性β2受体阻断剂ICI118,551,提示β2受体在调节胰腺癌细胞周期中发挥主要作用[9]。首先,β2受体在两种胰腺癌细胞株中的mRNA和蛋白水平的表达高于β1受体;同时,放射免疫法结果提示β2受体的表达和β1受体相比较占大约65%,而β1受体表达只占35%[10];其次,β2受体激动剂可激活Ras和Src酪氨酸激酶依赖的MAPKs通路,k-ras基因的突变在胰腺癌中是普遍存在的[11]。在本研究中,MIA PaCa-2的k-ras基因为突变型,而BxPC-3的k-ras基因为野生型;通过本组数据可以得出β2受体阻滞剂可更高效抑制k-ras基因野生型的BxPC-3细胞,k-ras基因突变型的MIA PaCa-2的抑制效率要低于BxPC-3细胞,β2受体阻滞剂对不同k-ras基因类型的敏感性具有差别;另外,相关研究报道NNK可以诱导k-ras基因突变,持续激活β2受体可以增进激活MAPKs通路[12]。所以,ICI118,551抑制MAPKs通路,通过相关信号通路,发生G1/S期阻滞并使胰腺癌细胞生存能力下降。研究显示ICI118,551有效地抑制了NF-κB的激活,文献提示抑制β2受体的同时也进一步抑制了β2受体的转激活能力和EGFR,导致胰腺癌细胞增殖。基于以上分析,β受体阻断剂主要是通过抑制胰腺癌MIA PaCa-2与BxPC-3细胞β2受体发挥抑制作用[13]。
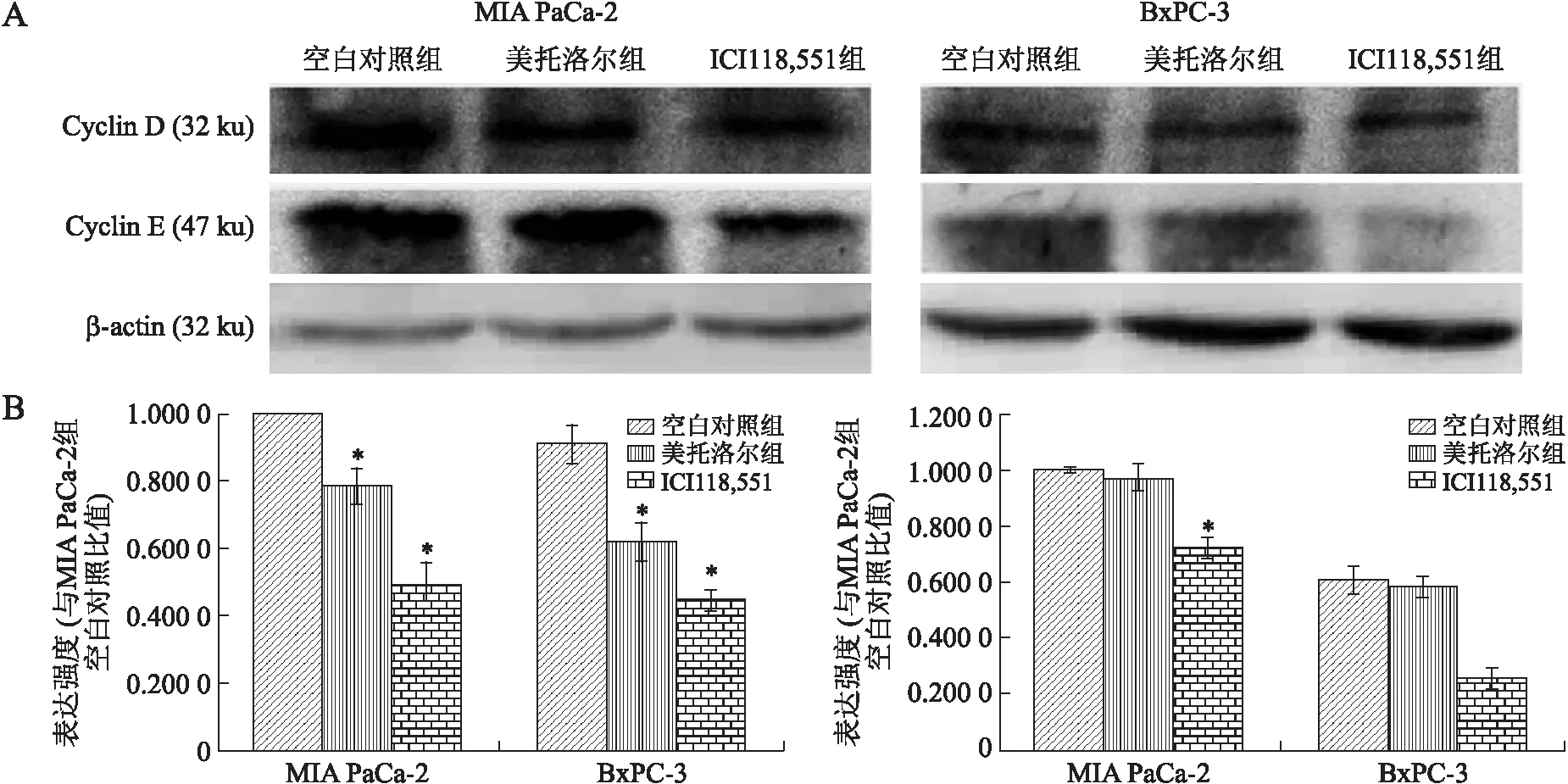
图4β受体阻滞剂抑制胰腺癌细胞CyclinD1和CyclinE蛋白的表达
Fig.4 β-adrenergic antagonists suppressed the expressions of Cyclin D1 and Cyclin E
A:美托洛尔和ICI118,551干预胰腺癌MIA PaCa-2和BxPC-3细胞后Cyclin D1和Cyclin E表达;B:Cyclin D1和Cyclin E表达检测统计分析图。
G1/S期转导调节点是细胞周期重要的调控点,Cyclin D1是G1/S期转导的重要调控分子,是细胞由G1期向S期转换的关键调节分子。在G1期的早期,Cyclin D1的表达持续性增加,并促使Cyclin E的表达持续性增加,参与G1/S期转导,使细胞进入复制期开始DNA复制。Ras/ERK/MAPKs通路、Ras/PI3K/Akt通路和核转录因子NF-κB的激活可使Cyclin D1和Cyclin E的表达增加,促使细胞复制。ICI118,551干预胰腺癌细胞后,使 Cyclin D1和Cyclin E的表达显著性的下调,ERK、Akt的表达和核转录因子NF-κB的活性显著下降,这就导致胰腺癌细胞停滞在G1/S期,无法完成细胞DNA的复制,发生了G1/S期阻滞效应[13-14]。在本实验中,因两种细胞株k-ras基因的表现型不同,ICI118,551诱导细胞周期G1/S期阻滞效应在BxPC-3细胞中较为显著。因此,k-ras基因和Ras是β2受体阻滞剂调节胰腺癌G1/S期阻滞中的关键分子及节点[15]。
流行病学和实验研究资料显示,长期应用β受体阻滞剂治疗心血管疾病的人群,其前列腺癌、乳腺癌和结肠癌等腺癌的发生率明显降低,长期应用β受体激动剂的人群可使肺癌和胰腺癌的发生率增加[16]。同时研究表明吸烟、糖尿病和心理应激等心血管系统疾病的相关危险因素已与胰腺癌的发生密切相关[17], β2受体阻滞剂已在心血管疾病中广泛应用。β2受体可能为胰腺癌预防和治疗的潜在分子靶点。
[1] SCHAAL C, CHELLAPPAN SP. Nicotine-mediated cell proliferation and tumor progression in smoking-related cancers[J]. Mol Cancer Res, 2014, 12(1):14-23.
[2] SCHULLER HM. Effects of tobacco constituents and psychological stress on the beta-adrenergic regulation of non-small cell lung cancer and pancreatic cancer: Implications for intervention[J]. Cancer Biomark, 2013, 13(3):133-144.
[3] ZHANG D, MA QY, HU HT, et al. β2-adrenergic antagonists suppress pancreatic cancer cell invasion by inhibiting CREB, NFκB and AP-1[J]. Cancer Biol Ther, 2010, 10(1):19-29.
[4] SCHULLER HM, AL-WADEI HA. Beta-adrenergic signaling in the development and progression of pulmonary and pancreatic adenocarcinoma [J]. Curr Cancer Ther Rev, 2012, 8(2):116-127.
[5] ZHANG D, LEI J, MA J, et al. β2-adrenogenic signaling regulates NNK-induced pancreatic cancer progression via upregulation of HIF-1α [J]. Oncotarget, 2016, 7(14):17760-17772.
[6] SHAN T, MA J, MA Q, et al. β2-AR-HIF-1α: A novel regulatory axis for stress-induced pancreatic tumor growth and angiogenesis[J]. Curr Mol Med, 2013, 13(6):1023-1034.
[7] ZHANG D, MA Q, WANG Z, et al. β2-adrenoceptor blockage induces G1/S phase arrest and apoptosis in pancreatic cancer cells via Ras/Akt/NFκB pathway[J]. Mol Cancer, 2011, 10:146.
[8] HUANG XY, WANG HC, YUAN Z, et al. Norepinephrine stimulates pancreatic cancer cell proliferation, migration and invasion via β-adrenergic receptor-dependent activation of P38/MAPK pathway[J]. Hepatogastroenterology, 2012, 59(115):889-893.
[9] SCHULLER HM, AL-WADEI HA, ULLAH MF, et al. Regulation of pancreatic cancer by neuropsychological stress responses: a novel target for intervention[J]. Carcinogenesis, 2012, 33(1):191-196.
[10] AL-WADEI MH, AL-WADEI HA, SCHULLER HM. Effects of chronic nicotine on the autocrine regulation of pancreatic cancer cells and pancreatic duct epithelial cells by stimulatory and inhibitory neurotransmitters[J]. Carcinogenesis, 2012, 33(9):1745-1753.
[11] KIM-FUCHS C, LE CP, PIMENTEL MA, et al. Chronic stress accelerates pancreatic cancer growth and invasion: A critical role for beta-adrenergic signaling in the pancreatic microenvironment[J]. Brain Behav Immun, 2014, 40:40-47.
[12] 徐军,穆维靖,沙焕臣,等. β2受体阻滞剂对胰腺癌细胞侵袭能力的影响及其机制 [J]. 西安交通大学学报(医学版), 2012, 33(5):549-554.
[13] HEFNER J, CSEF H, KUNZMANN V. Stress and pancreatic carcinoma—β-adrenergic signaling and tumor biology[J]. Dtsch Med Wochenschr, 2014, 139(7):334-338.
[14] 张涓娟,蒲宇,李勇,等. PI3K/AKT和MAPK/ERK1/2信号通路对胰腺癌PANC-1细胞VEGF表达的影响 [J]. 川北医学院学报, 2014, 29(1):45-48.
[15] SHAN T, MA Q, ZHANG D, et al. β2-adrenoceptor blocker synergizes with gemcitabine to inhibit the proliferation of pancreatic cancer cells via apoptosis induction[J]. Eur J Pharmacol, 2011, 665(1-3):1-7.
[16] PARTECKE LI, SPEERFORCK S, KDING A, et al. Chronic stress increases experimental pancreatic cancer growth, reduces survival and can be antagonised by beta-adrenergic receptor blockade[J]. Pancreatology, 2016, 16(3):423-433.
[17] SCHULLER HM, AL-WADEI HA. Neurotransmitter receptors as central regulators of pancreatic cancer[J]. Future Oncol, 2010, 6(2):221-228.
ExperimentalstudyonthepancreaticcancerG1/Sphasearrestbyβ2-adrenergicantagonist
ZHANG Dong, SHA Huan-chen, LEI Jian-jun, WANG Zheng, MA Qing-yong
(Department of Hepatobiliary Surgery, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
ObjectiveTo investigate the effects of β2-adrenergic antagonist ICI118,551 on pancreatic cancer cell G1/S phase arrest and its action mechanism.MethodsThe cell cycle indexes were determined by the flow cytometry assay; the expressions of Cyclin D1 and Cyclin E were analyzed by Western blot; the activation of NF-κB was measured by electrophoretic mobility shift assay; the proliferation of PanCa cells was determined by BALB/c athymic nude mice subrenal capsular assay.Resultsβ2-adrenergic antagonist ICI118,551 significantly induced G1/S phase arrest compared with β1-adrenergic antagonist metoprolol in MIA PaCa-2 and BxPC-3 cell lines. ICI118,551 inhibited the expressions of Cyclin D1 and Cyclin E and reduced the activation of NF-κB. The proliferation of PanCa cells was strongly suppressed in the renal capsule xenografts in mice after ICI118,551 treatment.ConclusionThe blockage of β2-adrenoceptor markedly induces PanCa cells to arrest at G1/S phase and inhibits the proliferation of pancreatic cancer cells.
ICI118,551; G1/S phase arrest; Cyclin D1; Cyclin E
2017-05-28
2017-09-04
国家自然科学基金资助项目(No.81302153)
Supported by the National Natural Science Foundation of China (No.81302153)
马清涌,教授,博士生导师. E-mail: qyma56@mail.xjtu.edu.cn
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171204.1747.014.html(2017-12-04)
R735.9
A
10.7652/jdyxb201801009
(编辑 韩维栋)
