钙离子载体A23187对转化生长因子β1刺激的肝星状细胞增殖、周期及凋亡蛋白caspase-3表达的影响
2018-01-10李雅楠肖永红华北理工大学公共卫生学院临床医学院河北唐山063000
李雅楠,闫 宇,王 铭,刘 芳,肖永红(华北理工大学:. 公共卫生学院;. 临床医学院,河北唐山 063000)
钙离子载体A23187对转化生长因子β1刺激的肝星状细胞增殖、周期及凋亡蛋白caspase-3表达的影响
李雅楠1,闫 宇2,王 铭1,刘 芳1,肖永红1
(华北理工大学:1. 公共卫生学院;2. 临床医学院,河北唐山 063000)
目的研究钙离子载体A23187对转化生长因子β1(TGF-β1)刺激的肝星状细胞增殖、周期及凋亡蛋白caspase-3表达的影响。方法将液氮保存下的肝星状细胞株,于37 ℃、50 mL/L CO2孵箱中进行复苏传代培养,同步化后将细胞分为5组:空白组、TGF-β1(5 ng/mL)组、TGF-β1+低、中、高剂量钙离子载体A23187组,即5 ng/mL TGF-β1刺激24 h,再分别加入1、2、4 μmol/L不同剂量钙离子载体A23187作用24 h后,用MTT比色法检测细胞增殖,流式细胞仪检测细胞周期,蛋白免疫印记测定凋亡蛋白caspase-3表达。结果不同浓度钙离子载体A23187均能显著抑制细胞增殖(P<0.05),且随着剂量的增加,细胞的相对增殖率(RGR)降低,低、中、高剂量组分别为85.93%、61.71%、48.43%,组间两两比较差异均有统计学意义(P<0.05);不同处理组G1期细胞比例、S+G2期细胞比例差异均有统计学意义(P<0.05),钙离子载体A23187剂量越大,G1期细胞比例越高,S+G2期细胞比例越低(P<0.05)。随着钙离子A23187浓度的增加,细胞内caspase-3蛋白表达明显增加(P<0.05)。结论钙离子载体A23187可能通过阻滞大鼠肝星状细胞由G1期进入S期和G2期,抑制细胞增殖,同时上调凋亡蛋白caspase-3的表达。
肝星状细胞;钙离子载体A23187;增殖;周期;caspase-3
肝纤维化是慢性肝病最重要的病理特征,也是慢性肝炎、肝硬变等进一步发展恶化的重要原因[1]。肝星状细胞(hepatic stellate cell, HSC)是肝纤维化时细胞外基质过多产生和沉积的主要细胞来源,是发生肝纤维化的中心环节[2-3]。而转化生长因子β1(transforming growth factor beta-1, TGF-β1)可以激活HSC并增加多种促纤维化因子的表达,在肝纤维化中起重要作用[4]。由于肝纤维化是肝硬化的前趋阶段,且可以逆转,抑制HSC增殖或促进其凋亡可以逆转肝纤维化的发生。近年来,针对诱导活化的HSC凋亡成为研发抗肝纤维化药物的热点。钙离子载体A23187在细胞凋亡中的作用受到普遍关注[5]。钙离子载体A23187是一种钙动员剂,可使细胞膜的钙离子通道开放,提高细胞内Ca2+浓度,可能与钙蛋白酶(caspases)有关。本研究用钙离子载体A23187作用于经TGF-β1刺激的HSC,观察细胞增殖、周期及凋亡蛋白caspase-3的表达情况,为肝纤维化的治疗提供新的靶点。
1 材料与方法
1.1细胞株表型为活化的 HSC株,从四氯化碳刺激的大鼠中分离并获得永生性。
1.2药品与试剂钙离子载体A23187(批号:52665-69-7),购于美国Cayman公司;二甲基亚砜(DMSO);青霉素、链霉素混合液(双抗),美国Sigma公司生产;胎牛血清、DMEM高糖培养基、磷酸盐缓冲液、含2.5 mL/L乙二胺四乙酸(EDTA)胰蛋白酶,购于美国BI公司;TGF-β1,批号:PHG9204,购自美国Gibco公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT),购自日本东京化工公司;碘化丙啶(PI)荧光染料(杭州联科生物公司),4 ℃储存;RNA酶(杭州联科生物公司),-20 ℃存放。十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶配制试剂盒,上海碧云天公司生产;蛋白酶抑制剂、RIPA裂解液,均购自武汉贝博生物公司;二辛可宁酸(BCA)蛋白定量试剂盒,杭州联科生物公司生产;兔抗鼠caspase-3一抗、辣根过氧化物酶(HRP)标记的山羊抗兔二抗,均为美国Arigo公司生产。
1.3主要仪器3111细胞孵育箱,购自美国Thermo公司;FACScalibur流式细胞仪,购于美国贝帝公司;AC2-4S1生物安全柜,购自新加坡ESCO公司;TS100-F倒置相差显微镜,购自日本Nikon公司;U-niversal HoodⅡ凝胶成像分析仪,iMark酶标仪,均购自日本BIO-RAD公司;多功能电泳仪、电转仪,购自北京六一仪器厂。
1.4方法
1.4.1细胞培养 将存放于液氮中的HSC复苏传代培养于含有60 mL/L胎牛血清、10 g/L双抗(100 U/mL青霉素、100 μg/mL链霉素)DMEM高糖培养基中,在37 ℃、50 mL/L CO2孵箱中进行孵育。当细胞长满密度达到80%时,胰蛋白酶进行传代并接种在细胞培养瓶中。
1.4.2细胞分组及处理 细胞用无血清DMEM培养基同步化培养24 h后,分为5组:空白组,TGF-β1组,TGF-β1+低、中、高剂量钙离子载体A23187组。空白组加入无血清培养基培养48 h;TGF-β1组加入5 ng/mL TGF-β1作用细胞48 h;TGF-β1+低、中、高剂量钙离子载体A23187组先用5 ng/mL TGF-β1作用细胞24 h,再分别加入1、2、4 μmol/L钙离子载体A23187,培养24 h后检测各项指标的改变。
1.4.3MTT比色法检测HSC增殖[6]细胞经常规培养后,以2.5×104/孔的密度于96孔板中,每孔200 μL细胞悬液;每组设置5个复孔,并在37 ℃、50 mL/L CO2孵箱中进行孵育48 h;在培养结束前,每孔加入20 μL MTT避光孵育4 h,4 h之后去上清液,加入200 μL DMSO,避光震荡10 min;酶标仪490 nm波长处读取吸光度值(A490),计算细胞相对增殖率(relative growth rate, RGR),RGR=实验组A490/对照组A490×100%
1.4.4流式细胞仪检测HSC细胞周期[7]经过药物处理后,2.5 g/L胰酶消化细胞,使之变成单个细胞,离心收集细胞,弃上清;用预冷的PBS洗细胞2~3次,加入750 mL/L乙醇到细胞沉淀中,于4 ℃过夜;离心收集细胞,用预冷的PBS洗细胞2~3次,使细胞重悬,加入500 μL PBS和50 μL PI;重悬;然后加入2 μL RNA酶,最后上流式细胞仪检测细胞周期。
1.4.5Western blot方法检测HSC内caspase-3蛋白的表达[8]经过处理后的细胞,去原有的培养基,预冷的PBS洗2~3遍,将培养皿置于冰上,加入配置好的细胞裂解液(蛋白酶抑制剂:RIPA裂解液=1∶250)200 μL,冰浴10~30 min;细胞裂解后,4 ℃ 12 000 r/min离心15 min,取上清,BCA试剂盒定量检测蛋白浓度,100 ℃煮5 min,储存于-20 ℃备用。等量上样,用100 g/L SDS-PAGE凝胶电泳检测caspase-3蛋白,用湿转法进行转到PVDF膜上,封闭后,加入一抗caspase-3(1∶1 000)4 ℃过夜,TBST洗3遍;二抗(1∶5 000)37 ℃孵育1 h后,TBST洗3遍,之后显影,将ECL发光剂A、B等量混合,依据每个条带100 μL,使用凝胶成像器观察。

2 结 果
2.15组细胞的增殖情况MTT比色法结果显示,TGF-β1组与空白组相比A值显著增高(P<0.05),分别为(1.85±0.11)、(1.28±0.13);不同浓度钙离子载体A23187均显著抑制细胞增殖(P<0.05),且随着剂量的增加,细胞RGR降低,低、中、高剂量钙离子载体A23187组分别为85.93%、61.71%、48.43%,组间两两比较差异均有统计学意义(P<0.05,表1)。
2.2不同处理组对细胞周期的影响流式细胞仪检测细胞周期,结果见图1。经统计分析显示,各组间细胞周期变化均有统计学差异(P<0.05);与空白组相比,TGF-β1组G1期细胞比例降低,S+G2期细胞比例升高(P<0.05);而不同剂量钙离子载体A23187组干预细胞后G1期细胞比例较TGF-β1组升高,S+G2期细胞比例降低(P<0.05),且随着钙离子载体A23187剂量的增加,G1期细胞比例越高,S+G2期细胞比例越低(P<0.05,表2)。
表1不同处理组肝星状细胞吸光度的改变
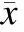

与空白组比较,*P<0.05;与TGF-β1组比较,#P<0.05;与 TGF-β1+低剂量A23187组比较,□P<0.05;与TGF-β1+中剂量A23187组比较,△P<0.05。


图1 不同处理组细胞周期的流式细胞图Fig.1Flowcytometrycellcycleindiffer⁃enttreatmentgroupsA:空白组;B:TGF⁃β1组;C、D、E:TGF⁃β1+低、中、高剂量钙离子载体A23187组。
表2不同处理组肝星状细胞周期的变化
与空白组比较,*P<0.05;与TGF-β1组比较,#P<0.05;与TGF-β1+低剂量A23187组比较,△P<0.05;与TGF-β1+中剂量A23187组比较,□P<0.05。
2.3不同处理组HSC中凋亡蛋白caspase-3的表达不同处理组肝星状细胞caspase-3蛋白凝胶电泳见图2。经统计学分析,空白组和TGF-β1组HSC中caspase-3蛋白的平均灰度值分别为0.35±0.03和0.30±0.01,两组比较无统计学差异(P>0.05);低、中、高剂量的钙离子载体A23187组HSC中caspase-3蛋白的平均灰度值分别为(0.64±0.03)、(0.94±0.03)、(1.33±0.06),且随着钙离子载体A23187剂量的增加,caspase-3蛋白表达水平升高,两两比较差异具有统计学意义(P<0.05)。
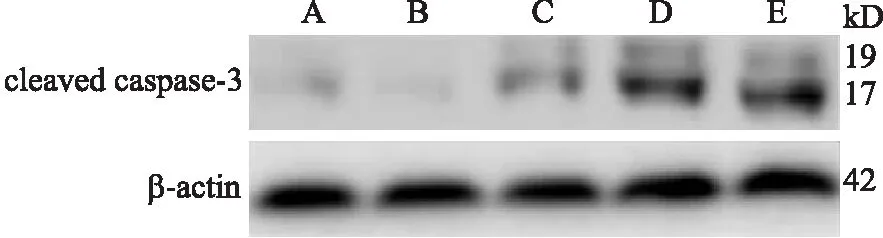
图2Westernblot方法检测各处理组HSC中caspase-3蛋白的表达
Fig.2 Western blot was used to detect the expression of caspase-3 protein in HSC
A:空白组;B:TGF-β1组;C、D、E:TGF-β1+低、中、高剂量钙离子载体A23187组。
3 讨 论
肝纤维化是各种肝细胞毒性物质对肝脏慢性或重复性损伤所引起肝脏的病理性改变,最终导致肝硬化甚至肝癌。在肝纤维化形成的过程中,HSC增殖和激活是发病的中心环节[2-3]。近年来,有关HSC研究日渐增多,但尚需进一步研究以探明其准确的调控机制。HSC在TGF-β1刺激下,间质出现大量胶原纤维,提示成纤维细胞主要是通过自身的异常增殖以及分泌大量含胶原纤维成分的细胞外基质来参与肝纤维化的发展[9]。TGF-β1刺激HSC可作为体外的肝纤维化模型,可以用于进行HSC基因表达调控、抗纤维化药物作用及纤维化发生机制等研究。有文献报道,钙离子载体A23187通过NADPH氧化酶途径或者线粒体通透性转变(MPT)从而增加产生ROS继而导致多种细胞凋亡[10]。本研究用不同剂量钙离子载体A23187作用于经TGF-β1刺激的HSC,MTT结果显示,低、中、高剂量载体A23187增殖率分别为85.93%、61.71%、48.43%,说明钙离子载体A23187明显抑制HSC增殖。流式细胞仪检测HSC周期结果显示,HSC经TGF-β1作用后,G1期细胞比例降低,S+G2期细胞比例升高。并且有研究表明,TGF-β1在体内外均能抑制多种细胞包括正常细胞和肿瘤细胞的生长,并使这些细胞停滞在细胞周期的G1期[11]。由于G1期是决定细胞继续进入细胞周期还是停滞或退出细胞周期的一个重要时期,因此TGF-β1与细胞的增殖、分化、衰老、凋亡、转化等密切相关。A23187是钙离子载体的代表,能与Ca2+形成稳定的复合物,充当流动的载体,它可使细胞膜上的钙离子通路开放,导致细胞内Ca2+浓度增高。Ca2+和钙调蛋白能活化蛋白激酶,引起细胞周期在G2期的阻抑,进而导致细胞凋亡[12]。且本研究结果显示,不同剂量钙离子载体A23187干预细胞后G1期细胞比例较TGF-β1组升高,S+G2期细胞比例降低。且随着钙离子载体A23187剂量的增加,G1期细胞比例亦升高,S+G2期细胞比例降低。上述结果提示钙离子载体A23187可以提高HSC细胞周期中G1期细胞比例,减少S和G2期细胞比例,有效的阻止细胞由G1期进入S和G2期,从而抑制HSC增殖,促进HSC凋亡。
caspase-3是凋亡过程中最重要的蛋白酶,是caspase级联下游中最关键的凋亡执行者,在各种因素启动的凋亡程序中起最后的枢纽作用[13]。在本研究中,Western blot结果显示,随着钙离子载体A23187剂量的增加,caspase-3蛋白表达增加,提示钙离子载体A23187能抑制细胞增殖,增加凋亡蛋白caspase-3表达,促进HSC凋亡。用钙离子载体A23187干预可能为抗纤维化的治疗带来了新的提示。
[1] 张梦然,成军. 肝纤维化研究进展[J]. 国际消化病杂志, 2014, 34(6):374-379.
[2] 黄艳,黄成,李俊. 肝纤维化病程中Kupffer细胞分泌的细胞因子对肝星状细胞活化增殖、凋亡的调控[J]. 中国药理学通报, 2010, 26(1):9-13.
[3] 唐桂连. 肝星状细胞与肝纤维化[J]. 国际消化病杂志, 2012, 32(5):270-273.
[4] ZHOU WC, ZHANG QB, QIAO L. Pathogenesis of liver cirrhosis[J]. World J Gastroenterol, 2014, 20(23):7312-7324.
[5] 张孝文,孔维佳. 钙离子载体A23187对喉癌细胞株胞内游离钙浓度及凋亡的影响[J]. 临床耳鼻咽喉杂志, 2005, 19(11):507-509.
[6] 李娜,祝聪聪,肖永红,等. PI3K抑制剂对四氯化碳刺激的肝星状细胞增殖和Ι型胶原表达的影响[J]. 西安交通大学学报(医学版), 2013, 34(2):164-167.
[7] 王悦,计阿丹,肖永红. 17β-雌二醇对小鼠肺成纤维细胞细胞周期的影响[J]. 郑州大学学报(医学版), 2014, 49(4):530-532.
[8] 武超,许杜娟,杨翠,等. 黄芪皂苷Ⅱ增加5-氟尿嘧啶对人肝癌细胞株Hep G2增殖抑制作用[J]. 安徽医科大学学报, 2016, 51(1):78-81.
[9] 李志庆,苏长青,杨家和. 转化生长因子β1在肝纤维化发生发展中的作用及靶向干预策略[J]. 诊断学理论与实践, 2011, 10(4):375-379.
[10] KAJITANI N, KOBUCHI H, FUJITA H, et al. Mechanism of A23187-induced apoptosis in HL-60 cells: Dependency on mitochondrial permeability transition but not on NADPH oxidase[J]. Biosci Biotechnol Biochem, 2007, 71(11):2701-2711.
[11] JEON WK, CHOI J, PARK SJ. The proinflammatory LTB4/BLT1 signal axis confers resistance to TGF-β1-induced growth inhibition by targeting Smad3 linker region[J]. Oncotarget, 2015, 6(39):41650-41666.
[12] BORAHAY MA, KILIC GS, YALLAMPALLI C. Simvastatin potently induces calcium-dependent apoptosis of human leiomyoma cell[J]. J Biol Chem, 2014, 289(51):35075-35086.
[13] CHEN DL, ENGLE JT, GRIFFIN EA, et al. Imaging caspase-3 activation as a marker of apoptosis-targeted treatment response in cancer[J]. Mol Imaging Biol, 2015, 17(3):384-393.
EffectsofcalciumionophoreA23187onproliferation,cycleandexpressionofcaspase-3inhepaticstellatecellsstimulatedbytransforminggrowthfactor-β1
LI Ya-nan1, YAN Yu2, WANG Ming1, LIU Fang1, XIAO Yong-hong1
(1. College of Public Health; 2. College of Clinical Medicine North China University of Science and Technology, Tangshan 063000, China)
ObjectiveTo study the effect of calcium ionophore A23187 on the proliferation, cycle and expression of caspase-3 in rat hepatic stellate cells by stimulated transforming growth factor Bata1 (TGF-β1).MethodsHepatic stellate cells were cultured in 37 ℃ and 50 mL/L CO2incubator. The cells were divided into 5 groups: blank group, TGF-β1(5 ng/mL) group, TGF-β1+low-, medium- and high- dose calcium ionophore A23187 groups: 5 ng/mL TGF-β1stimulation for 24 h, and then 1 μmol/L, 2 μmol/L and 4 μmol/L of calcium ion carrier A23187 was added and treated for 24 h. The cells proliferation was detected by MTT. The cell cycle was detected by flow cytometry and the expression of caspase-3 was detected by immunoblotting.ResultsDifferent concentrations of calcium ionophore A23187 could significantly inhibit the proliferation of cells (P<0.05). And the dose of calcium ionophore A23187 increased; RGR in the low-, medium- and high- dose groups was 85.93%, 61.71%, and 48.43% (P<0.05). There was significant difference between the two groups (P<0.05). The higher the dose of calcium ionophore A23187, the higher the proportion of G1 phase cells, the lower the ratio of S+G2 cells (P<0.05), with significant difference (P<0.05). With the increase of calcium ionophore A23187 concentration, the expression of caspase-3 protein increased significantly (P<0.05).ConclusionCalcium ionophore A23187 prevents hepatic stellate cells from G1 phase to S phase and G2 phase, inhibits its proliferation and up-regulates the expression of caspase-3.
hepatic stellate cell; calcium ionophore A23187; proliferation; cycle; caspase-3
2017-04-04
2017-07-12
河北省自然科学基金资助项目(No.H2015209043)
Supported by the Natural Science Foundation of Hebei Province (No.H2015209043)
肖永红,教授,硕士生导师. E-mail: kycxyh@ tom. com
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171219.1928.002.html(2017-12-19)
R575.5
A
10.7652/jdyxb201801013
(编辑 卓选鹏)
