腹腔注射右美托咪定后小鼠大脑响应区域初探
2022-11-01许德娇岑华蕊王烈成
李 昊,许德娇,岑华蕊,程 娟,王烈成
右美托咪定(dexmedetomidine,Dex)作为一种高选择性的α2肾上腺素受体激动剂,它可产生与正常睡眠相似、可唤醒的效果,具有镇静、镇痛、抗焦虑和应激保护作用[1]。Dex可使机体体温和血压在安全范围内有一定的下降;Dex通过激活蓝斑(locus coeruleus,LC)的下行抑制系统发挥镇痛作用,由脊髓α2受体介导[2];具有神经保护作用[3],在抵抗应激、炎症和脑损伤中具有器官保护作用[4]。目前该药物已经被广泛应用于临床。催产素(oxytocin,OXT)是一种神经肽,具有多种功能,包括收缩子宫,尤其以妊娠子宫更加敏感;在哺乳期可以促进分泌乳汁;具有神经保护作用,在抗焦虑、降低炎症反应、学习和记忆中发挥作用[5]。Dex是否可以作用在OXT神经元,尚未见报道。该实验研究Dex对丘脑室旁核(paraventricular nucleus of hypothalamus,PVN)、丘脑室上核(supraoptic nucleus,SON)脑区的c-Fos阳性神经元细胞和OXT神经元共标记情况,进一步探究Dex是否会增强OXT释放进而增强神经保护和抗炎作用。
1 材料与方法
1.1 实验材料
1.1.1实验动物 成年SPF小鼠(C57BL/6J),年龄8~10周(体质量21~26 g),采购于浙江维通利华实验动物技术有限公司。小鼠可自由获得标准饲料和无菌水,在室温(26±1) ℃,湿度40%~70%,光/暗循环12 h/12 h(从08:00—20:00开灯)。符合安徽医科大学动物伦理委员会要求(伦理号:20190235),并在实验中努力减少小鼠的数量及减轻它们所经历的任何疼痛或者不适。
1.1.2药品与试剂 右旋美托咪定注射液购自江苏恒瑞医药股份有限公司;兔源一抗c-Fos抗体、鼠源一抗c-Fos抗体购自美国Abcam公司;兔源一抗AVP抗体、兔源一抗OXT抗体购自美国ImmunoSta公司;羊抗兔和羊抗鼠二抗均购自美国Alexa Fluor分子探针公司;山羊血清封闭液、Fluoromount水性封片剂购自德国Sigma-aldrich公司。曲拉通X-100 购自上海昂一生物公司。
1.1.3实验仪器 灌流蠕动泵(河北齐力恒流泵有限公司);冷冻切片机(德国徕卡公司);小鼠脑槽仪(深圳瑞沃德公司);荧光倒置显微镜、玻片扫描仪(日本奥林巴斯公司);共聚焦显微镜(德国蔡司公司)。
1.2 方法
1.2.1实验动物分组及给药方式 取8~10周C57小鼠18只,随机分为Saline组和Dex组,给药方式为腹腔注射(ip),每只小鼠注射剂量为:0.1 ml/10 g。其中,Saline组给予生理盐水,Dex组给予Dex(100 μg/kg)。
1.2.2小鼠完整大脑取材 小鼠在下午15:00给药前使用0.04 %异氟烷吸入麻醉后,迅速进行腹腔注射。然后将小鼠在笼中放置120 min后,使用戊巴比妥钠(80 mg/kg)将小鼠麻醉,再依次用0.01 mol/L磷酸盐缓冲液(PBS)、4%多聚甲醛(PFA)通过心脏灌流对大脑固定,剥离颅骨取脑后放入蔗糖溶液脱水3 d。
1.2.3小鼠大脑全脑冰冻切片 首先将脱水完整的大脑放在脑槽仪下沿冠状面均切成两部分,切后光滑面作为底座,使用OCT包埋剂包埋后放在冰冻切片机的冰座台上。冷冻完成后进行全脑厚度40 μm一层的切片,按顺序放入含有0.01 mol/L PBS溶液的24孔板中。
1.2.4免疫荧光
1.2.4.1c-Fos免疫荧光染色 取出脑片放入孔板中,用PBS漂洗脑片3次(每次10 min),5%山羊血清在PBST(0.05% Triton X-100)放入37 ℃水浴锅封闭1 h,加入相应兔来源的c-Fos单一抗体(1 ∶4 000)于4 ℃孵育过夜。PBS漂洗3次,加入相应兔源绿色荧光二抗室温避光孵育2 h。PBS漂洗3次,细胞核用DAPI(1 ∶2 000)孵育20 min。PBS漂洗1次。
1.2.4.2c-Fos和OXT神经元免疫荧光共染色 挑选、漂洗、封闭脑片同1.2.4.1加入鼠来源的c-Fos单一抗体(1 ∶1 000)和兔来源的OXT神经元抗体(1 ∶2 000),于4 ℃孵育过夜。PBS漂洗3次,加入相应兔源红色荧光和鼠源绿色荧光二抗室温避光孵育2 h。PBS漂洗3次。
1.2.5免疫荧光成像后阳性细胞计数方法 本课题中免疫荧光分为两部分。第一部分大脑脑区的c-Fos细胞表达是利用奥林巴斯玻片扫描仪显微成像。第二部分特定脑区的c-Fos细胞和OXT神经元共标记是利用蔡司共聚焦显微成像。对于玻片扫描仪显微成像后的脑片利用Image J软件通道拆分和划定的脑区自动计数,为保证计数精确,再人工对每个自动计数的阳性细胞数进行校准。对于蔡司共聚焦显微成像的脑片,使用蔡司成像软件来观测各层细胞数量。切片厚度40 μm,采用10 μm一层进行层扫,每张脑片成像约有4~6幅。根据细胞前后成像的变化,判断c-Fos细胞和OXT神经元是否在同一层,若是,则可判断为共标记细胞。
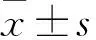
2 结果
2.1 Dex对睡眠脑区腹外侧视前区(ventrolateral preoptic nucleus, VLPO)和运动皮质的c-Fos细胞影响免疫荧光实验结果显示:与Saline组相比,Dex组M1/M2区域的c-Fos细胞表达降低,差异有统计学意义(t=9.64,P<0.001)(图1 A、B、E);与Saline组相比,Dex组促睡眠脑区VLPO中c-Fos细胞表达升高,差异有统计学意义(t=-5.15,P<0.05)(图1 C、D、F)。

图1 运动皮质M1/M2和促睡眠脑区VLPO的免疫荧光代表图(n=5)A:Saline组M1/M2脑区免疫荧光代表图;B:Dex组M1/M2脑区免疫荧光代表图;C:Saline组VLPO脑区免疫荧光代表图;D:Dex组VLPO脑区免疫荧光代表图;E:M1/M2脑区c-Fos阳性细胞数量统计图;F:VLPO脑区c-Fos阳性细胞数量统计图;1:×10;2:×20;3:×5;与Saline组比较:*P<0.05,***P<0.001
2.2 Dex对促觉醒相关脑区的c-Fos细胞表达的影响免疫荧光实验结果显示:与Saline组相比,Dex组LC脑区中c-Fos的表达降低,差异有统计学意义(t=4.45,P<0.01)(图2 A、B、K);与Saline组相比,Dex组外侧下丘脑(lateral hypothalamic area, LH)中c-Fos细胞表达降低,差异有统计学意义(t=7.40,P<0.001)(图2 C、D、L);与Saline组相比,Dex组腹侧结节乳头体核(ventral tuberomammillary nucleus, TMN)脑区c-Fos细胞表达降低,差异有统计学意义(t=5.00,P<0.01)(图2 E、F、M);与Saline组相比,Dex组背外侧背盖核(laterodorsal tegmental nucleus, LDT),臂旁核(parabigeminal nucleus, PB)两个脑区c-Fos细胞表达降低,差异有统计学意义(tPB=9.17,tLDT=6.44,P<0.01)(图2 G~J、N、O)。

图2 促觉醒相关脑区的免疫荧光c-Fos代表图(n=5)A:Saline组LC脑区免疫荧光代表图;B:Dex组LC脑区免疫荧光代表图;1:×10;2:×20;C:Saline组LH脑区免疫荧光代表图;D:Dex组LH脑区免疫荧光代表图;1:×5;2:×10;E:Saline组TMN脑区免疫荧光代表图;F:Dex组TMN脑区免疫荧光代表图;1:×5;2:×10;G:Saline组LDT脑区免疫荧光代表图;H:Dex组LDT脑区免疫荧光代表图;1:×5;2:×20;I:Saline组PB脑区免疫荧光代表图;J:Dex组PB脑区免疫荧光代表图;1:×5;2:×10;K~O:LC、LH、TMN、LDT、PB脑区c-Fos细胞数量统计图;与Saline组比较:**P<0.01,***P<0.001
2.3 Dex对大脑感觉神经核SFO、AP、SOL的c-Fos细胞表达影响免疫荧光实验结果显示:与Saline组相比,Dex组的小鼠穹窿下器(subfornical organ, SFO)脑区c-Fos细胞表达增高,差异有统计学意义(t=-5.22,P<0.01)(图3 A、B、E);与Saline组相比,Dex组延髓最后区(area postrema, AP)和孤束核(solitary tract, SOL)脑区的c-Fos细胞表达增高,差异有统计学意义(tAP=-12.15,tSOL=-7.05,P<0.001)(图3 C、D、F、G)。

图3 Dex对机体感觉神经核SFO、AP、SOL的影响(n=5)A:Saline组SFO脑区免疫荧光代表图;B:Dex组SFO脑区免疫荧光代表图;1:×5;2:×10;C:Saline组AP、SOL脑区免疫荧光代表图;D:Dex组AP、SOL脑区免疫荧光代表图;0:AP、SOL脑区 ×5;1:AP脑区 ×20;2:SOL脑区 ×10;E~G:SFO、AP、SOL脑区c-Fos细胞数量统计图;与Saline组比较:**P<0.01,***P<0.001
2.4 Dex对PVN、SON、SCN脑区的c-Fos细胞表达的影响免疫荧光实验结果显示:与Saline组相比,Dex组SON脑区c-Fos细胞表达增高,差异有统计学意义(t=-3.73,P<0.05)(图4 A、B、G);Dex组PVN和视交叉上核(suprachiasmatic nucleus, SCN)脑区c-Fos细胞表达差异无统计学意义(图4 C~F、H、I)。

图4 SON、PVN、SCN脑区免疫荧光c-Fos表达代表图(n=5)A:Saline组SON脑区免疫荧光代表图;B:Dex组SON脑区免疫荧光代表图;1:×10;2:×20;C:Saline组PVN脑区免疫荧光代表图 ×10;D:Dex组PVN脑区免疫荧光代表图 ×10;E:Saline组SCN脑区免疫荧光代表图 ×10;F:Dex组SCN脑区免疫荧光代表图 ×10;G~I:SON、PVN、SCN脑区c-Fos细胞数量统计图;与Saline组比较:*P<0.05
2.5 Dex对PVN、SON中OXT神经元和c-Fos细胞共标记的影响本实验中,小鼠腹腔注射给药后进行免疫荧光c-Fos细胞和OXT神经元共成像。显微成像后,统计了共标记神经元数量占总的OXT神经元和总的c-Fos细胞的比例。本研究选择年龄相仿的小鼠,OXT神经元在个体间差别不大,图5 F饼图显示的是Dex组和Saline组对应的脑区总OXT神经元数量是基本一致。染色和统计质量无误后,进行共标记统计,结果显示,与Saline组相比,Dex组PVN、SON脑区共标记神经元细胞数占总OXT神经元数量差异无统计学意义(图5A~E)。
统计共标神经元细胞数占该脑区总的c-Fos细胞的比例,结果显示:与Saline组相比,Dex组在PVN脑区差异无统计学意义;Dex组在SON脑区比例下降,差异有统计学意义(t=-3.73,P<0.05)(图5 G)。

图5 Saline组及Dex组PVN、SON脑区免疫荧光共标记代表图(n=4) ×20A:Saline组PVN脑区免疫荧光共标记代表图;B:Dex组PVN脑区免疫荧光共标记代表图;C:Saline组SON脑区免疫荧光共标记代表图;D:Dex组SON脑区免疫荧光共标记代表图;E:c-Fos细胞和OXT神经元共标记数与OXT神经元的比例;F:PVN、SON脑区总OXT神经元数量及共标记神经元数占总OXT神经元比例;G:c-Fos细胞和OXT神经元共标数与c-Fos细胞数量的比例;1:红色荧光标记的OXT神经元;2:绿色荧光标记的c-FOS细胞;3:共标记图;箭头:指示共标记的细胞的位置;与Saline组比较:*P<0.05
3 讨论
结果显示:Dex对促睡眠相关脑区细胞表达显著激活,如VLPO脑区;而对促觉醒与运动等相关脑区细胞表达显著抑制,如LC、LH、TMN、LDT、PB、M1/M2等脑区。
作为一种麻醉剂,Dex不可避免地会导致运动功能下降,本课题中,运动皮质M1/M2的c-Fos细胞表达显著降低。VLPO是位于下丘脑外侧与睡眠密切相关的促睡眠脑区,在整个睡眠过程中,VLPO表现非常活跃,c-Fos细胞表达显著增高[6]。LC是经典的促觉醒的核团,其内含有丰富的去甲肾上腺素合成神经元,这些神经元在整个中枢神经系统中发出弥散投射,LC-去甲肾上腺素系统在唤醒、应激反应中起主要作用[7]。LH是前脑的重要组成部分,是觉醒、防御和新陈代谢的重要控制器,包括食欲素神经元、黑色素浓缩激素神经元、γ-氨基丁酸能神经元,食欲素神经元被鉴定为促觉醒神经元[8],免疫荧光显示Dex可以显著抑制其活性。LDT在引发和维持REM睡眠中起重要作用[9],其主要含有胆碱能和非胆碱能神经元。免疫组化实验证实,LDT在快速眼动睡眠剥夺后的反弹期间胆碱能和非胆碱能神经元与Fos细胞共标记数量显著增多[9]。本课题免疫荧光实验显示,Dex降低LDT区域c-Fos细胞的数量,这与Dex减少REM睡眠的结果相一致。有文献表明,Dex可以在整个睡眠周期中会提高非快速眼动睡眠的比例[10]。此外,LDT中一半以上的胆碱能神经元表达有α2受体,提示Dex可能通过LDT的α2受体抑制神经元活性,从而减少REM睡眠。然而,Dex是否直接抑制LDT神经元,需要电生理膜片钳技术进一步验证。PB位于脑桥灰质的重要促觉醒核团之一,免疫荧光结果显示,Dex可减少PB的c-Fos细胞表达,提示Dex诱导的镇静催眠作用可通过抑制PB神经元兴奋来介导。SOL是延髓背侧的一个主要感觉核,接收心血管、内脏、呼吸、味觉和触觉的信息[11]。SFO位于第三脑室,在心血管调节,能量平衡,免疫反应和水矿物质平衡方面发挥作用。SFO缺乏血脑屏障,可以直接感受脑脊液中水矿物质的变化,尤其对Na+水平更加敏感,控制水和盐的摄入[12]。如果被激活可能代表机体水盐失衡,会主动寻求饮水。Dex的使用可以降低血压,当机体血压下降时,血管紧张素Ⅱ发挥升压作用,其中已被证实SFO与AngⅡ作用致升压效应有关系[13]。
PVN和SON脑区存在大量AVP、OXT神经元,负责产生和调控此类激素的释放。本研究结果显示Dex组PVN、SON脑区c-Fos细胞和OXT神经元共标记数与OXT神经元比例无差异性,但共标记数与c-Fos细胞数量比例降低。结果分析是Dex组SON脑区的c-Fos细胞表达数量较Saline组增高,Saline组激活的多数c-Fos细胞和OXT神经元进行共标记,但Dex组增加的c-Fos细胞并未和OXT神经元更多地进行共标记,这一结果表明,Dex可能并不会对小鼠机体的OXT神经元产生影响,但增加的c-Fos细胞和哪类神经元进行共标记,还需进一步研究。
