PGK1基因沉默对SMMC7721肝癌细胞增殖的影响*
2018-01-02张园园方肇勤
张园园 方肇勤
上海中医药大学 基础医学院 (上海, 201203)
PGK1基因沉默对SMMC7721肝癌细胞增殖的影响*
张园园 方肇勤△
上海中医药大学 基础医学院 (上海, 201203)
目的:观察PGK1基因沉默对SMMC7721肝癌细胞增殖的影响。方法常规体外培养SMMC7721肝癌细胞,Lipofectamine 3000方法将shRNA-PGK1 质粒及阴性载体转染至SMMC7721细胞;荧光实时定量 PCR及 Western Blot 检测 PGK1 的表达,MTT 检测细胞相对存活率。结果与正常SMMC 7721 细胞相比,在PGK1沉默的肝癌细胞中,PGK1基因的表达降低,细胞的相对存活率减少。结论PGK1基因沉默能够抑制SMMC7721肝癌细胞的增殖。
肝癌细胞;PGK1;RNA干扰;细胞增殖
原发性肝癌(肝癌)是我国最常见的恶性肿瘤之一,在恶性肿瘤死亡率中居第二位[1],严重危害人民生命健康。一直以来,中医药都是我国肝癌防治的重要力量,中医药在减轻患者临床症状,配合放化疗减毒增效,保护肝脏,预防肿瘤发生、复发、转移,延长患者生存期等方面具有独特的优势。然而,中医药防治肝癌的研发基础相对薄弱,相关作用机制并不十分清楚。
近年来,本项目组在国家自然基金的连续资助下,经过长期的研究和探索发现,预知子在体外能够显著抑制SMMC7721肝癌细胞的恶性增殖,与细胞毒抗生素G418联用,具有减量增效的作用[2,3];基因芯片检测结果显示,预知子的乙醇提取物能够有效减少肝癌细胞中包括PGK1在内的多种基因的表达,其与G418联用,下调PGK1表达的作用增强;qRTPCR结果也进一步证实了这一结果。由此,我们推测:预知子可能是通过下调PGK1的表达,减少肝癌细胞SMMC7721的恶性增殖。然而,国内外并无PGK1对SMMC7721肝癌细胞恶性增殖影响的相关报道。因此,我们计划将含PGK1 RNAi片段的质粒转染入SMMC7721细胞,使PGK1表达后沉默,观察肝癌细胞的恶性增殖情况,以揭示两者关系,为进一步探讨预知子乙醇提取物防治肝癌的作用机制提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要实验仪器 二氧化碳培养箱(美国Thermo公司)、垂直式无菌无尘操作台(中国造鑫企业有限公司)、Step One 定量 PCR 仪(美国 ABI 公司), 酶标仪(美国 Bio-TEX 公司),Nanodrop 分光光度计(美国 Thermo 公司),WB系统(美国BTO-RAD公司)。
1.1.2 主要实验试剂 Psilencer2.1-U6 neo载体质粒(美国Thermo 公司)、质粒双酶切试剂盒(美国NEB公司),感受态细胞 DH5α、凝胶DNA回收试剂盒(天根生物科技有限公司),TRizol、质粒提取试剂盒、脂质体转染试剂Lipofectamine3000 (美国 Invitrogen 公司),MTT、 DMSO(美国sigma公司),1640 培养基、胎牛血清、青链霉素双抗(美国 Gibco 公司),鼠抗人 PGK1单克隆抗体、鼠抗人GAPDH 单克隆抗体、辣根过氧化物标记的羊抗鼠 Ig G 抗体、鼠抗人GAPDH 单克隆抗体(美国Abnova公司 ),氯仿、异丙醇(上海国药集团),RT试剂盒、PCR 扩增试剂盒(日本 TaKaRa 公司),RIPA裂解液(中)(碧云天公司),PVDF膜(美国 Millipore 公司)。
1.1.3 细胞株 SMMC7721人肝癌细胞株为本实验室冻存的细胞,购自中科院上海细胞所。
1.2 方法
1.2.1 常规细胞复苏及培养 细胞复苏及培养参照文献[4]进行。
1.2.2 PGK1干扰序列及引物序列的设计与合成 根据PGK1基因序列(NM_000291.3),采用美国Life公司在线软件设计sh RNA序列,采用在线软件设计引物序列,均交由美国Invitrogen公司合成,shRNA序列:5’-GCTCAACAACATGGAGATTGG-3’。阴性质粒由试剂盒提供。
采用Primer3(v.0.4.0)在线软件设计PCR引物,PGK1-F:5’-TCACTCGGGCTAAGCAGATT-3’;PGK1-R:5’-CAGTGCTCACATGGCTGACT-3’。内参以GAPDH为参照(GAPDH-F:5’-GAGTCAACGGATTTGGTCGT-3’;GAPDH-R:5’-GATCTCGCTCCTGGAAGATG-3’)。
1.2.3 干扰质粒的重组与扩增 使用限制性内切酶(位点为BamHI、Hind III)切开质粒,经电泳鉴定酶切成功后,使用琼脂糖凝胶DNA回收试剂盒将质粒回收。使用T4噬菌体DNA连接酶将质粒与shRNA-PGK1连接,并转化至感受态细胞DH5α。在含50μg/ml 氨苄青霉素的LB培养基平板涂板,37℃过夜后挑选单克隆菌落,接种至含同样浓度氨苄青霉素的 LB培养基中,37℃,220 r/min,振荡过夜。次日,将少量菌液交由Invitrogen公司测序,余下菌液与等体积50%的消毒甘油(甘油加水稀释高压消毒)混匀后,放置-80℃冰箱保存。
收到公司测序结果后,与设计的shRNA-PGK1序列进行比对,确定一致后,使用Invitrogen公司的质粒中抽试剂盒,抽提重组质粒,Nanodrop检测质粒浓度,稀释至100ng/ul,放置-20℃冰箱保存。
1.2.4 实时荧光定量 PCR(q RT-PCR)检测 实验分成 4组:未转染的空白对照组(正常组)、G418对照组(G418组)、转染空载体的阴性对照组(阴性组)和转染PGK1重组质粒的实验组(PGK1RNAi组)。待细胞处于对数生长期时,常规收集细胞,调整细胞浓度为1.2×105个/ml,每孔2 ml,接种至6孔板,每组2个复孔。培养16~18 h,细胞密度约 80%时吸弃阴性对照孔及PGK1转染孔中原培养液,用 PBS 洗 1遍,更换为Opti-MEM培养基1.75ml。按照 Lipofectamine 3000 说明书要求,将 5 μl P3000和95ulOpti-MEM培养基充分混匀后再加入25ul(2.5 μg)重组质粒/阴性质粒,与含3.75ul Lipofectamine3000的Opti-MEM培养基125ul,充分混匀,室温静置 5 min,将250 μl混合液加入对应孔中,置于恒温培养箱中培养。转染 4 h 后,更换为及血清及双抗的 1640培养基。培养 24后,除空白对照组外,其余3组更换为含有1.4mg/ml G418的RPMI 1640培养基,48h后每孔加入1mlTRIzol。
按照 TRIzol说明书提取其总 RNA,并将所得的 RNA 溶解于 RNase Free H2O。Nanodrop分光光度计测量RNA 浓度及纯度,依据PrimeScriptTMRT reagent Kit (Perfect Real Time)说明书取1μg 总 RNA 作为反转录模板,产物cDNA 再根据TAKARA 公司SYBR®Premix Ex TaqTMII (Tli RNaseH Plus)说明书进行q PCR 操作每组3个复孔,内参基因使用GAPDH。反应体系为 cDNA 2.0 μl、RT Mix 10.0 μl、10 μmol/ L 的上下游引物各0.4 μl、Dye 0.4 μl、dd H2O 6.8 μl。Real-time PCR 反应程序:95℃,30s;95℃,30s→60℃,30s,40个循环。
目的基因的相对表达量可以采用 ∆∆CT 法分析,以正常组作为对照样本。
△CT=目的基因 CT-内参 CT(其中 CT 值为扩增 n 个循环基因的荧光数值)。
△△CT=观察样本∆CT-对照样本∆CT=(观察样本目的基因 CT-观察样本内参 CT)-(对照样本目的基因 CT-对照样本内参 CT)。实验重复3次。
1.2.5 蛋白定量(Western blot)检测 6孔板接种SMMC7721细胞,分组及转染方法同上。吸弃各孔培养液,每孔加入120μl细胞蛋白裂解液 RIPA,充分裂解细胞,3 000 r/min 离心收集上清液,按照BCA蛋白浓度测定试剂盒说明,测定每个蛋白样品的蛋白浓度。SDS-PAGE 电泳分离,电压80V,浓缩胶跑30min;电压110V,分离胶跑60min。将分离胶上蛋白转移到 PVDF 膜上,5%脱脂奶粉封闭1h,加入相应一抗,4℃ 过夜,TBST 洗 3次,每次 10 min,加入过氧化物酶标记二抗,摇床摇 1.5 h,TBST 洗 3 遍,每次 10 min,最后进行ECL显色,凝胶成像系统拍照,分析目标蛋白的相对表达量,内参蛋白使用GAPDH。实验重复3次。
1.2.6 MTT法检测PGK1沉默对细胞增殖的影响 分组方法同上,常规体外培养SMMC7721细胞,待细胞处于对数生长期时,收集细胞,调整细胞浓度为1×105个/ml,每孔100μl,接种至4块96孔板中,每组5个复孔。培养16~18 h,第1块板加20μlMTT溶液孵育4h后,每孔更换为150μlDMSO,放置摇床上振荡10min,酶标仪检测 490 nm 的吸光度(OD 值)。其余3快板,吸弃阴性对照孔及PGK1转染孔中原培养液,用 PBS 洗 1遍,更换为Opti-MEM培养基100μl/孔。按照 Lipofectamine 3000 说明书要求,将 2.4μl P3000和45.6ulOpti-MEM培养基充分混匀后再加入12ul(1.2μg)重组质粒/阴性质粒,与含1.8ul Lipofectamine3000的Opti-MEM培养基60ul,充分混匀,室温静置 5 min,以10 μl/孔将混合液加入对应的孔中,置于恒温培养箱中培养。转染 4 h 后,更换为含血清及双抗的1640培养基。转染12h后,3块板中除空白对照组外,其余3组更换为含有1.4mg/ml G418的完全RPMI 1640培养基,并于转染后24h、48h、72h分别进行MTT检测。

2 结果
2.1 RTqPCR检测结果 转染72h后,PGK1RNAi组PGK1基因的相对表达量明显低于其余各组,有统计学差异(P<0.05);而G418组PGK1基因的相对表达量则明显高于其余各组,比较有统计学差异(P<0.05),见图1。
2.2 Western blot检测结果 转染72h后,PGK1RNAi组PGK1蛋白的相对表达量低于其余各组,见图2。
2.3 MTT检测结果 随着转染时间的延长,各组相比,G418组细胞的增殖速度最低,PGK1RNAi组细胞的增殖低于阴性组和正常组,见图3。

图1 各组细胞PGK1基因的相对表达图
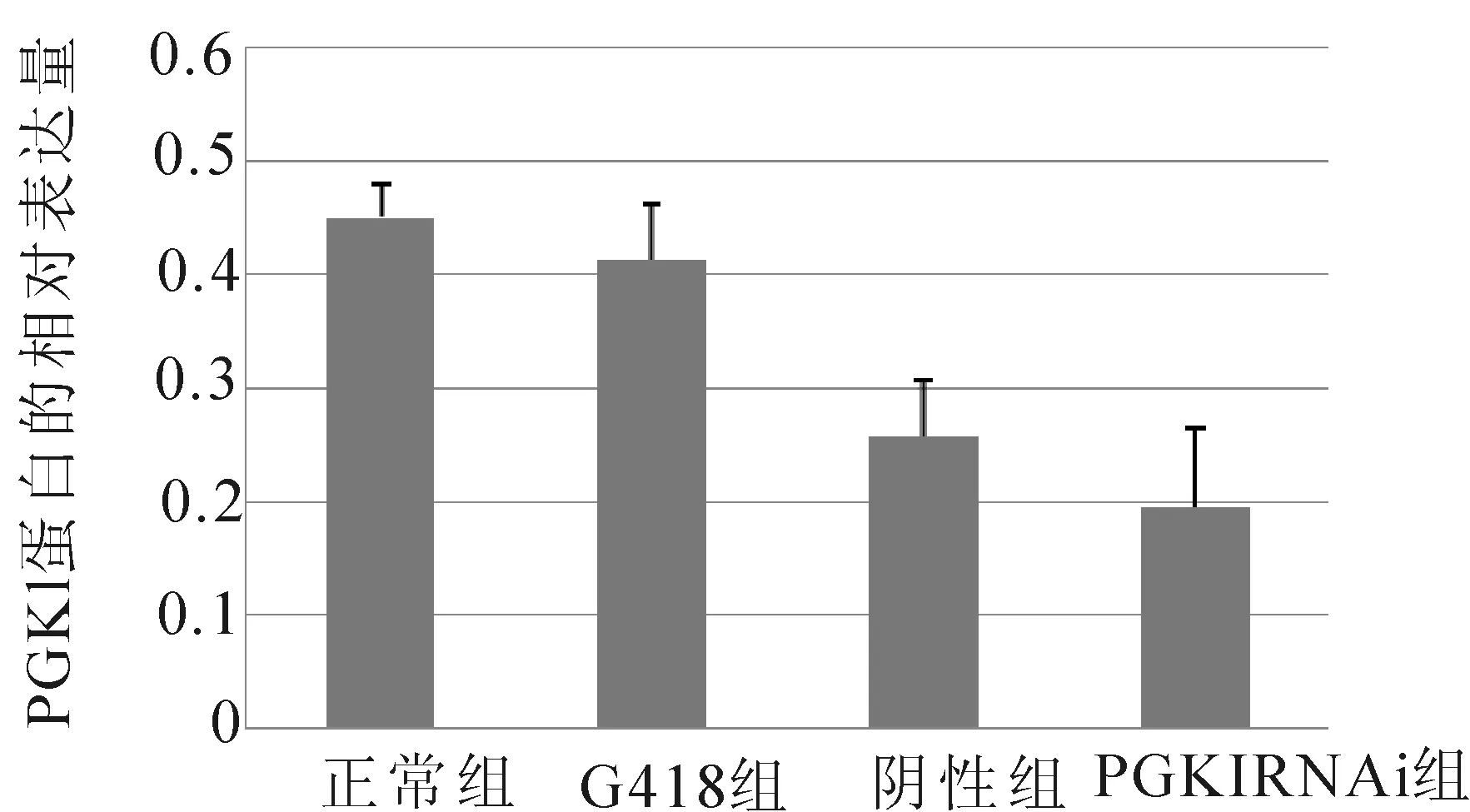
图2 各组细胞PGK1基因的蛋白表达图

图3 各组细胞PGK1基因的增殖图
3 讨论
磷酸甘油酸激酶(PGK)是糖酵解过程中重要的催化酶之一,它可催化1,3-二磷酸甘油酸(1,3-BPG)的磷酸转位到ADP而生成ATP。在原核和真核生物中,PGK的立体结构高度保守,是典型的双域结构。人类的基因组中,PGK存在两种亚型,PGK1和PGK2,两者在功能上和结构上都很相似。PGK1是X连锁基因,在所有的体细胞中都有表达[4]。
德克萨斯大学MD安德森癌症中心证实,在缺氧应激、表皮生长因子受体(EGFR)活化或致癌基因KRas G12V/B-Raf V600E突变的情况下,PGK1会线粒体易位。进而导致线粒体中丙酮酸代谢被抑制,细胞质中丙酮酸生成的乳酸增多。线粒体PGK1的蛋白激酶活性在于它是三羧酸(TCA)循环将丙酮酸从线粒体分流到细胞质中以促进乳酸生成的关键。此外,功能研究表明,用线粒体易位缺陷的PGK1 S203A突变体替代内源性PGK1可显着降低原位移植在小鼠脑中的肿瘤的生长,这是由肿瘤细胞低增殖率和增强的凋亡引起的[5]。由此可见,PGK1作为糖酵解酶和蛋白激酶在肿瘤的能量代谢方面发挥着重要的作用,其在恶性肿瘤组织中高度表达,有助于满足恶性肿瘤快速生长的需求。
本研究提示,在体外培养的肝癌细胞中,抑制PGK1基因的表达能够减少肝癌细胞的增殖。若要进一步阐明PGK1基因在肝癌发生发展过程中的作用,还需要更多的体内实验研究的支持。
[1] 陈万青,郑荣寿,曾红梅,等. 2011年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2015,24(1):1-10.
[2] 任红艳,方肇勤,梁超,等.预知子、白花蛇舌草抑制肝癌细胞恶性增殖的研究[J].辽宁中医杂志,2013,40 (12):2553-2555.
[3] 薛庆善.体外培养的原理与技术[M].北京:科学出版社,2001:128-138,705-749.
[4] Beutler E.PGK deficiency[J]. Br J Haematol, 2007,136(1):3-11.
[5] Li X, Jiang Y, Meisenhelder J,etal. Mitochondria-Translocated PGK1 Functions as a Protein Kinase to Coordinate Glycolysis and the TCA Cycle in Tumorigenesis[J]. Mol Cell, 2016,61(5):705-719.
EffectofPGK1silencingontheproliferationofSMMC7721hepatomacells
ZHANGYuan-yuan,FANGzhao-qin△.BasicMedicalSchool,ShanghaiUniversityofTraditionalChineseMedicine(Shanghai,201203)China
ObjectiveTo investigate the effect of PGK1 gene silencing on the proliferation of SMMC7721 hepatoma cells.MethodsSMMC7721 hepatoma cells were cultured in vitro. Lipofectamine 3000 was used to transfect shRNA-PGK1 plasmid and SMMC7721 cells into SMMC7721 cells. The expression of PGK1 was detected by real-time fluorescence quantitative PCR and Western blot. Cell viability was measured by MTT.ResultsCompared with normal 7721 cells, the expression of PGK1 in PGK1-silenced HCC cells was significantly decreased and the relative survival rate of PGK1 cells was decreased.ConclusionPGK1 gene silencing can inhibit the proliferation of SMMC7721 hepatoma cells.
Hepatocarcinoma cell; PGK1; RNA interference; Cell proliferation
10.3969/j.issn.1005-0264.2017.03.013
国家自然科学基金(No.81273641);中国博士后科学基金(No.2013M531201);上海市科委博士后科研基金项目(No.13R21415900);上海高校青年教师培养资助计划(No.ZZszy13004);△通迅作者
2017-03-22 编辑:程良斌)
