不同发育期菘蓝和毛状根中直铁线莲宁B的含量变化规律研究△
2017-12-26谭宇萍董宏然杨健唐金富康传志张瑜黄璐琦
谭宇萍,董宏然,杨健,唐金富*,康传志,张瑜,黄璐琦*
(1.广东药科大学 中药学院,广州 510000;2.道地药材国家重点实验室培育基地,中国中医科学院 中药资源中心,北京 100700)
·中药农业·
不同发育期菘蓝和毛状根中直铁线莲宁B的含量变化规律研究△
谭宇萍1,2,董宏然2,杨健2,唐金富2*,康传志2,张瑜2,黄璐琦1,2*
(1.广东药科大学 中药学院,广州 510000;2.道地药材国家重点实验室培育基地,中国中医科学院 中药资源中心,北京 100700)
目的测定不同生长时期菘蓝及不同悬浮培养时间毛状根中抗流感病毒活性成分直铁线莲宁B的含量,研究其累积变化规律,为菘蓝的采收和菘蓝毛状根体系评价提供参考。方法应用超高效液相色谱测定菘蓝叶片、根及毛状根中直铁线莲宁B的含量。结果菘蓝叶片中未检测到直铁线莲宁B;在整个生育期内,菘蓝根中直铁线莲宁B动态累积变化曲线为“单峰型”,含量在生长100 d左右达到峰值后逐渐降低;毛状根中直铁线莲宁B含量随悬浮培养时间持续增加,在20 d达到5.40 mg·g-1,超过根中最大含量。结论整个生长周期内,菘蓝和毛状根中直铁线莲宁B累积变化呈一定规律性,原植物中直铁线莲宁 B在九月下旬产量达到最大;毛状根在10~20 d期间直铁线莲宁B含量增长处于生长对数期,20 d后即超过原植物的最大含量,说明菘蓝毛状根体系是研究直铁线莲宁B生物合成的理想体系,也可为后续利用菘蓝毛状根体系大量制备直铁线莲宁B提供参考。
菘蓝;毛状根;生长期;直铁线莲宁B;含量
菘蓝IsatisindigoticaFort.为十字花科菘蓝属两年生草本植物。根和叶均可入药,根入药为板蓝根,叶入药为大青叶,具有清热解毒,凉血利咽之功效,主治瘟疫时毒、发热咽痛、痄腮、丹毒、痈肿,临床常用于流行性感冒,流行性腮腺炎,急慢性肝炎,流行性乙型肝炎,带状疱疹等疾病的治疗[1]。钟南山教授课题组研究发现,菘蓝中木脂素类化合物 7S,8R,8′R-(+)-落叶松树脂醇-4,4′-二-O-β-D-吡喃葡萄糖苷,即直铁线莲宁B (clemastanin B),对不同亚型人流感病毒与禽流感病毒均具有显著抑制作用[2],可能是菘蓝抗病毒活性物质基础之一。然而,直铁线莲宁B在菘蓝原植物中含量较低,安益强等测定了河北安国,安徽亳州等8个不同产地板蓝根中直铁线莲宁B的含量,直铁线莲宁B含量最高仅为0.900 mg·g-1[3]。中药材中活性物质含量受产地、栽培技术等因素影响,采收时间是直接影响中药材质量的重要因素之一,基于抗病毒活性物质直铁线莲宁B含量来优化菘蓝采收时间,目前尚缺乏相关的研究,因此研究菘蓝不同发育期直铁线莲宁B积累规律将有望为优化菘蓝药材采收时间提供有价值的参考。
发根农杆菌Agrobacteriumrhizogenes中含有使植物产生毛状根的Ri质粒,Ri质粒内Vir区基因表达产物作用于T-DNA产生T-DNA片段,并最终整合到宿主细胞基因组中产生大量毛状根。植物毛状根培养具有其生长不依赖外源植物激素、合成次生代谢物能力强且稳定、生物转化功能以及繁殖能力强等优点,不仅是植物天然产物生物合成研究的理想体系,以其作为生物反应器来生产高价值天然产物的潜力,更是受到研究者广泛关注,并已有成功的先例[4-5]。参照模式植物拟南芥,菘蓝体内木脂素合成途径已初步阐明[6],其中香豆酸-3-羟基化酶 (liC3H) 和松脂素还原酶 (liPLR) 参与木脂素成分生物合成,过表达liC3H和过表达liPLR使菘蓝毛状根中直铁线莲宁B的前体落叶松脂素的含量均明显提高[7-8],但对直铁线莲宁B在菘蓝毛状根的积累情况和积累规律还未见报道。
本研究拟通过超高效液相测定不同生长期菘蓝根和叶中直铁线莲宁B的含量,探索直铁线莲宁B产生规律,以期为菘蓝药材的采收提供参考依据。同时利用发根农杆菌C58C1诱导菘蓝毛状根,摸索不同悬浮培养时间毛状根中直铁线莲宁B积累变化规律,为今后解析其生物合成途径和合成调控研究提供平台。
1 材料与方法
1.1 实验材料
菘蓝毛状根材料为测定生长曲线时干燥至恒重的毛状根;菘蓝自交纯系,经中国中医科学院中药资源中心郝近大研究员鉴定为十字花科菘蓝属植物菘蓝IsatisindigoticaFort.2013年于北京郊区春播,在生长至60 d后(8月13日),每10 d取样一次,每次取3份菘蓝完整植株,记录各组菘蓝样品的表观数据后,将其地上与地下部分切断,分别称量各部分鲜重,在烘箱 90 ℃杀青 15 min后于阴凉通风处晾干,称量干重。
1.2 仪器与试剂
超高效液相 ACQUITY UPLC I-Class (美国 Waters 公司,包括四元高压梯度泵、真空脱气机、自动进样器、柱温箱、二极管阵列检测器、 EmpowerTM3 色谱工作站),超高效液相色谱柱ACQUITY UPLC BEH C18(2.1 mm× 50 mm,1.7 μm),BAS224S 型分析天平 (Sartorius),5810R 型冷冻离心机 (Eppendorf)。 甲醇、乙腈为色谱纯,其余试剂为分析纯,购自国药集团化学试剂有限公司,Murashige & Skoog Basal Medium with Vitamins (Phyto Thechnology Laboratories),Tryptone 、 Yeast extract (OXOID,LP0042)。
1.3 菘蓝毛状根诱导及培养
1.3.1 外植体的制备 挑选饱满无破损的菘蓝种子,用 75% 酒精浸泡 5 min,无菌水冲洗 4~5 次,再用 3% NaClO 溶液浸泡 10 min后无菌水冲洗 5 次,接种至 MS 固体培养基上,(26 ± 2) ℃ 下暗培养 2 d,光培养约 20 d,取无菌苗幼叶作为外植体。
1.3.2 发根农杆菌活化 取保存在-80 ℃发根农杆菌C58C1划线接种在 LB 固体培养基上,28 ℃培养2 d,挑取单菌落转接在LB液体培养基中,活化2次,28 ℃,200 r·min-1振荡培养至OD值为0.5,即可用于诱导毛状根。
1.3.3 毛状根的诱导和固体培养 农杆菌菌液浸泡过的菘蓝叶片放入MS固体培养基里,暗培养2 d,转入含400 mg·L-1Cef 的MS固体培养基,每10 d更换培养基,每次将Cef浓度降低100 mg·L-1直至获得无菌毛状根。
1.3.4 毛状根的鉴定 取新鲜毛状根 0.1 g,SDS 法提取总 DNA 作为 PCR 扩增模板。根据发根农杆菌 C58C1 菌株中RolB和RolC基因设计特异性引物:
RolB:RolB-F:CGAGGGGATCCGATTTGCTT;
RolB-R:GACGCCCTCCTCGCCTTCCT;
RolC:Rol C-F:TCGCCATGCCTCACCAACTCAC;
RolC-R:CCTTGATCGAGCCGGGTGAGAA;
扩增体系为 10 μL Takara Premix Ex Taq,1 μL 正向引物(5 μm·μL-1),1 μL 反向引物 (5 μm·μL-1),1 μL DNA模板,7 μL dd H2O.PCR 扩增条件为 94 ℃ 预变性 5 min,35 个扩增循环 (94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸 30 s),72 ℃继续延伸5 min,1.5%琼脂糖凝胶(EB 染色)进行电泳 (180 V/30 min),电泳结果于凝胶成像系统下扫描并保存图片。
1.3.5 菘蓝毛状根的液体悬浮培养 称取经PCR鉴定为阳性且多分枝、多根毛、生长迅速的毛状根 1.0 g至6,7 V液体培养基中悬浮振荡培养,80 r·mim-1,25 ℃,避光。
1.3.6 毛状根生长曲线的测定 取在6,7-V液体培养基中生长旺盛的菘蓝毛状根0.5 g鲜重,转接至新的6,7-V液体培养基中,从继代培养开始,每5 d取出毛状根样品,每次三瓶,取出的样品置于烘箱中37 ℃干燥24 h至恒重后称量其干重,并计算3份样品的平均值,绘制0~60 d毛状根的生长曲线。
1.4 直铁线莲宁B的含量测定
1.4.1 色谱条件 色谱柱:ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm);流动相:0.1% 甲酸-乙腈 (A)-0.1% 甲酸-水 (B) 12∶88;流速:0.4 mL·min-1;检测波长225 nm,柱温 40 ℃,进样量 2 μL.
1.4.2 标准品溶液的制备 精密称取2.00 mg直铁线莲宁B粉末(自制)于10 mL棕色容量瓶中,50%甲醇溶解、定容,浓度为200 μg·mL-1,放置于4 ℃冰箱供 UPLC 分析用。
1.4.3 线性关系考察 将上述对照品溶液进一步稀释成7个不同质量浓度的对照品溶液,按照1.4.1 项下色谱条件测定峰面积。以进样浓度X(μg·mL-1)为横坐标,色谱峰面积Y为纵坐标得到回归方程分别为:Y=3827X+6862.9,(r=0.999 7),线性范围1.000~100.0 μg·mL-1。
1.4.4 供试品溶液的制备 称取菘蓝叶片与根的粗粉0.500 g,精密称定,加入5 mL 50%甲醇超声提取两次,每次45 min,并用50% 甲醇补足损失的量;离心取上清,残渣用少量50% 甲醇冲洗3次,置于10 mL 棕色容量瓶中并用50%甲醇定容至刻度,摇匀,滤过,取滤液,即得;称取菘蓝毛状根粉末0.050 g,精密称定,加入1 mL 50%甲醇,用上述方法提取,并定容至2 mL,0.22 μm微孔滤膜滤过,即得。
1.4.5 精密度试验 取100 μg·mL-1标准品溶液,进样2 μL连续进样5次,测得直铁线莲宁B的峰面积 RSD 值为0.61%,表明该仪器精密度良好。
1.4.6 稳定性试验 取菘蓝和毛状根的同一供试品溶液,分别在0,2,4,6,8 h测定直铁线莲宁B的峰面积,其峰面积的RSD值分别为0.06%,0.08%,表明供试品溶液在8 h内稳定。
1.4.7 稳定性试验 取同一批次菘蓝和毛状根样品,按照1.4.4项下方法各制备 5 份供试品溶液,测定直铁线莲宁B的含量,结果为菘蓝和毛状根中直铁线莲宁B质量分数的 RSD 值分别为1.23%,1.36%,表明该方法的重复性良好。
1.4.8 加样回收率 精密称取已知含量的菘蓝和毛状根样品各5份,每份约50 mg,加入与所测成分约等量的对照品溶液,按1.4.4项下制备供试品溶液。按上述色谱条件测定,计算加样回收率。测得菘蓝,毛状根中直铁线莲宁B的平均回收率分别为103.2%,100.1%,RSD分别为0.74%,1.44%.
1.4.9 含量测定 按1.4.4项下方法制备供试品溶液,再按1.4.1下相应的测定方法测定峰面积并由标准曲线计算直铁线莲宁B含量。
2 分析
2.1 菘蓝毛状根的鉴定
提取菘蓝转化毛状根的基因组DNA,PCR扩增毛状根特异RolB和RolC基因片段,结果显示四个株系毛状根均能扩增出与转化菌株大小一致的片段;而以原植物的DNA为模板,扩增后无特异性条带,说明本实验诱导了菘蓝的毛状根,C58C1发根农杆菌中RolB和RolC两个基因已经稳定整合到基因组中,可以用于后续的研究。
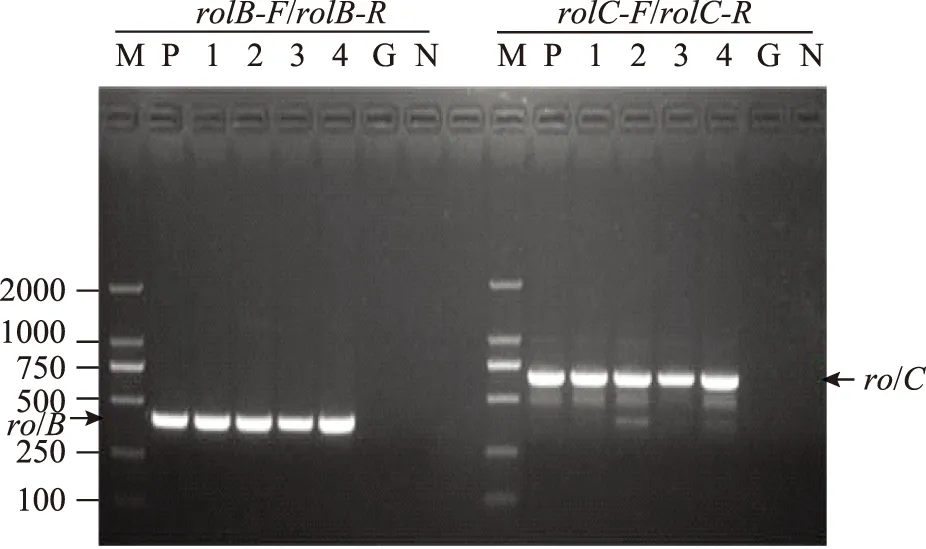
注:M:DNA Maker;P:菌株 C58C1;1~4:不同株系菘蓝毛状根;G:菘蓝;N:阴性对照图1 菘蓝毛状根Rol B,Rol C 基因PCR检测
2.2 不同生长时期菘蓝及毛状根生物量的变化
不同生长期菘蓝根、叶及不同悬浮培养时间毛状根生物量累积变化,如图2,北京春播的菘蓝,在播种后生长70 d内,菘蓝叶及根生物量逐渐增长;生长70 d后,进入9月份,天气逐渐变冷,光照强度变弱,地上叶的形态趋于稳定,生物量积累呈现稳定状态,此时叶中有机物向根部转移,根部进入快速增长期,一直持续到 10 月,根部生物量积累逐渐稳定。悬浮培养毛状根在生长50 d内,呈现“快~慢”生长模式;10~20 d处于快速增长期,10 d内生物量增长一倍,20 d后生物量呈现缓慢积累趋势,由于培养基里的水分及营养物质不断被消耗,50 d后,生物量开始下降,毛状根出现死亡现象。
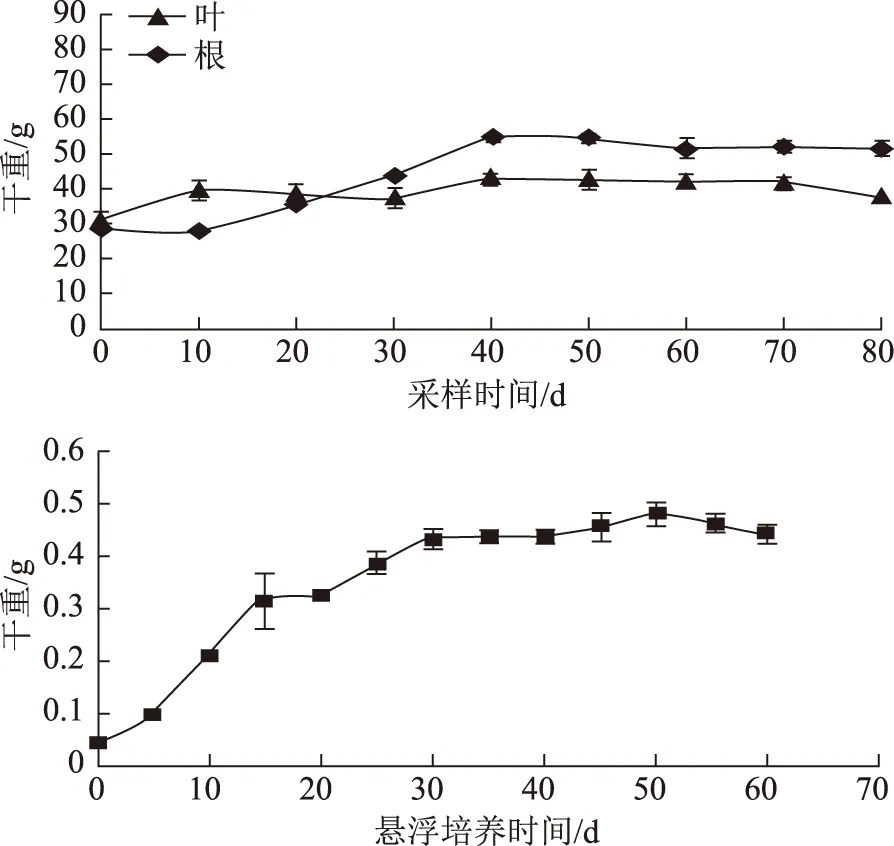
图2 不同生长期菘蓝根、叶及毛状根生物量的累积变化
2.3 不同生长期菘蓝根中直铁线莲宁B动态累积变化
不同生长期菘蓝中直铁线莲宁动态积累变化,见图3 (A,B) 在菘蓝叶片未检测出直铁线莲宁B;不同生长期根中直铁线莲宁B含量及产量总体均呈先升高后降低的变化趋势,含量介于0.75~ 2.13 mg·g-1,其产量则介于30.9~87.3 mg。从种子萌芽到生长期,在叶的光合作用下,菘蓝根部不断积累直铁线莲宁B,在生长90 d后其含量达到峰值,为2.13 mg·g-1;生长100 d,其产量达到最高87.3 mg。生长100 d后,直铁线莲宁B含量急剧下降,产量也相应持续下降。
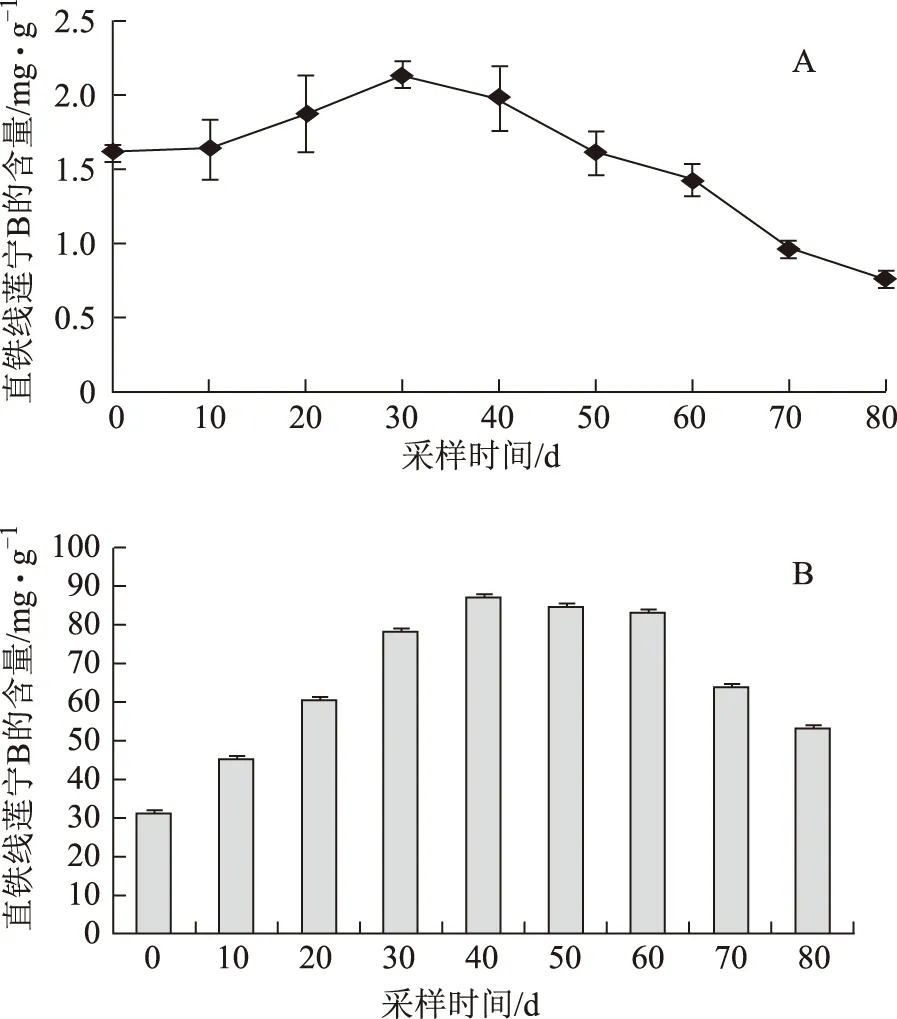
图3 不同生长期菘蓝根中直铁线莲宁B动态积累变化
2.4 不同悬浮培养时间菘蓝毛状根中直铁线莲宁B动态累积变化
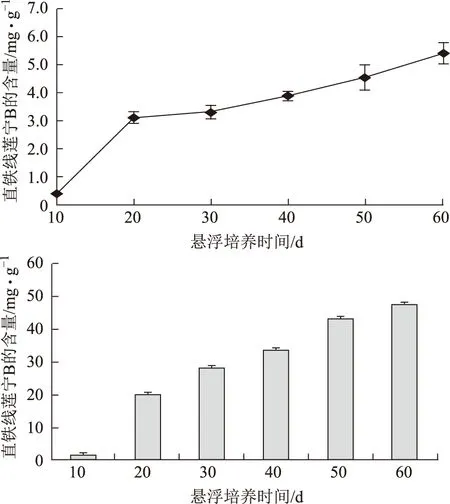
图4 不同悬浮培养时间菘蓝毛状根中直铁线莲宁B动态积累变化
对不同悬浮培养时间的菘蓝毛状根中直铁线莲宁B动态积累发现,悬浮培养菘蓝毛状根中直铁线莲宁B含量和产量均随生长期持续增加,毛状根在生长10 d内开始积累直铁线莲宁B,10~20 d毛状根处于生长对数期,直铁线莲宁含量急速增加,从0.38 mg·g-1迅速上升至3.10 mg·g-1,产量由1.629 mg·L-1迅速增加到20.26 mg·g-1,增长率约为10倍;第60 d达到了5.40 mg·g-1,产量达47.81 mg·L-1。
3 讨论
本研究考察了不同生长时期菘蓝以及不同培养时间菘蓝毛状根中抗病毒活性物质直铁线莲宁B含量变化,结果发现在叶中未检测到直铁线莲宁B,而根和毛状根中均含直铁线莲宁B,且直铁线莲宁B动态积累差异显著。气候条件会影响中药材质量,随季节变换植物体内活性物质含量与生物量呈规律性变化。春播70 d后,直铁线莲宁B进入快速积累期,到90 d左右(9月下旬)达到最高,之后呈下降趋势。因春播70 d后,进入秋季,昼夜差距变小,气温降低,夜间植物蒸腾作用减弱,有利于地上部分营养物质逐渐转入根部,故根中直铁线莲宁B含量逐渐增加;8~9月是菘蓝地下部分生长旺盛期,也是直铁线莲宁B合成积累关键时期,其合成积累在9月下旬达到最高值,之后随气温逐渐降低,地上部分开始枯萎,光合强度减弱,积累呈现下降趋势,这说明春播板蓝根最佳采收期为9月底至10月初[1]。
而在菘蓝毛状根中,直铁线莲宁B含量随悬浮培养增加不断积累,在生长10 d内明显增加,10 d后毛状根进入快速生长期,直铁线莲宁B含量迅速增加,培养20 d时,已经超过了板蓝根中最高含量,悬浮培养50 d后,毛状根进入生长停滞期,但直铁线莲宁B合成累积幅度大于生物量下降幅度,其含量仍呈增长趋势。由此可见,菘蓝毛状根能快速合成抗病毒成分直铁线莲宁B,生产效率高且稳定,并呈现一定的规律性,是研究菘蓝直铁线莲宁B生物合成的理想体系。前人研究发现,毛状根中次生代谢物含量甚至高于原植物,如通过甘草毛状根获得甘草黄酮,达干重的2.042%,是未转化甘草根的4.3倍[10]。本研究中也发现,菘蓝毛状根不仅能积累直铁线莲宁B,且含量稳定,随培养时间增加逐渐积累,可达板蓝根其含量最高值的2.5倍,说明菘蓝毛状根同样也具有用于生产直铁线莲宁B的潜力。
综上所述,本研究通过测定抗病毒活性物质直铁线莲宁B的含量,不仅为菘蓝药材的采收时间提供了参考,而且推断毛状根体系是研究直铁线莲宁B生物合成的理想体系,同时也具备用于直铁线莲宁B生成的潜力。但本研究仅从抗病毒活性物质直铁线莲宁B的含量考察菘蓝的毛状根和板蓝根药材之间差异,二者在抗病毒活性上差异如何?其物质基础是什么?这些问题仍有待于进一步研究。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015:205.
[2] Yang Z,Wang Y,Zheng Z,etal.Antiviral activity ofIsatisindigoticaroot-derived clemastanin B against human and avian influenza A and B viruses in vitro[J].International journal of molecular medicine,2013,31(4):867-873.
[3] 安益强,贾晓斌,昌莉丽,等.不同产地板蓝根药材中clemastanin B的含量比较[J].中国中药杂志,2009,34(14):1823-1825.
[4] Guillon S,Trémouillaux-Guiller J,Pati PK,etal.Hairy root research:recent scenario and exciting prospects[J].Curr Opin Plant Biol.2006,9(3):341-346.
[5] 张萌,高伟,王秀娟.药用植物毛状根的诱导及其应用[J].中国中药杂志,2014,39(11):1956-1960.
[6] Besseau S,Hoffmann L,Geoffroy P,etal.Flavonoid accumulation in Arabidopsis repressed in lignin synthesis affects auxin transport and plant growth[J].Plant Cell,2007,19(1):148-162.
[7] Xiao Y,Ji Q,Gao S,etal.Combined transcriptome and metabolite profiling reveals thatIiPLR1 plays an important role in lariciresinol accumulation inIsatisindigotica[J].J Exp Bot.2015,66(20):6259-6271.
[8] Chen R,Li Q,Tan H,etal.Gene-to-metabolite network for biosynthesis of lignans in MeJA-elicitedIsatisindigoticahairy root cultures[J].FrontPlantSci.2015,6:952.
[9] Chen J,Dong X,Li Q,etal.Biosynthesis of the active compounds ofIsatisindigoticabased on transcriptome sequencing and metabolites profiling[J].BMC Genomics.2013,14:857.
[10] 卢虹玉,刘敬梅,张海超,等.甘草毛状根诱导培养及其黄酮含量检测的研究[J].中国药学杂志,2011(11):814-818.
DynamicAnalysisofClemastaninBofthePlantatDifferentGrowthStagesandHairyRootsofIsatisindigotica
TAN Yuping1,2, DONG Hongran2, YANG Jian2, TANG Jinfu2*, KANG Chuanzhi2, ZHANG Yu2, HUANG Luqi1,2*
1.CollegeofTraditionalChineseMedicine,GuangdongPharmaceuticalUniversity,Guangzhou510006,China2.StateKeyLaboratoryBreedingBaseofDao-diHerbs,NationalResourceCenterforChineseMateriaMedica,ChinaAcademyofChineseMedicalSciences,Beijing100700,China
Objective:To investigate the changes of clemastanin B of the plant at different growth stages and hairy root ofIsatisindigotica.MethodsUltra Performance Liquid Chromatography was applied to determine the content of clemastanin B from the plant and hairy roots ofI.indigotica.ResultsClemastanin B was undetectable in the leaves ofI.indigotica,and the content of clemastanin B exhibited obvious change across different growing stages and increased with culture time in hairiry roots.The content of clesmastanin B showed a continuous increasing trend in hairy roots,reaching 5.40 mg·g-1in 20 days,which exceeding the maximum content of clemastanin B in roots,while its content was gradually decreased after reaching the peak at 100 days.ConclusionInvestigation of clemastanin B content at t different growth stages and hairy roots inI.indigoticapresent a certain law.The content of clemastanin B in the roots reached the maximum in 100 days after seeding.However,the content of clemastanin B in hairy roots were at the logarithmic phase of growth from 10 days to 20 days,even exceeding the maximum content in the roots at 20 days after seeding.From this angle,the hairy roots may provide us an ideal system to dissect the mechanism of the biosynthesis of clemastanin B and produce clemastanin B.
Isatisindigotica;hairy roots;growth stages;clemastanin B;content
10.13313/j.issn.1673-4890.2017.9.014
国家自然科学基金青年科学基金项目(81403090);中央本级重大增减支项目(2060302)
*
唐金富,副研究员,研究方向:菘蓝有效成分的生物合成调控研究;Tel:(010)64014411-2956,E-mail:jinfutang@126.com;黄璐琦,研究员,研究方向:分子生药学;Tel:(010)64014411-2955,E-mail:huangluqi01@126.com
2017-03-29)
