柬埔寨民间习用灵芝与伴生真菌拮抗特性评价△
2017-12-26佟曦然郭豪杰罗丽张昭齐耀东张本刚
佟曦然,郭豪杰,罗丽,张昭,齐耀东,张本刚
(中国医学科学院 北京协和医学院 药用植物研究所,中草药物质基础与资源利用教育部重点实验室,北京 100193)
·基础研究·
柬埔寨民间习用灵芝与伴生真菌拮抗特性评价△
佟曦然,郭豪杰,罗丽,张昭,齐耀东**,张本刚**
(中国医学科学院 北京协和医学院 药用植物研究所,中草药物质基础与资源利用教育部重点实验室,北京 100193)
目的分离并鉴定柬埔寨野生灵芝菌株及伴生菌,通过拮抗试验初步评价伴生真菌对灵芝的影响。方法对64个分离自柬埔寨灵芝的真菌样品进行了ITS序列鉴定,对检出的灵芝菌株与相同子实体中分离到的伴生真菌进行了拮抗试验。结果检出22株灵芝,占比34.4%,全部鉴定为Ganodermalingzhi;在非灵芝菌株中最常见的是炭角菌属(Xylaria)及炭团菌属(Hypoxylon),分别占比35.9%及15.6%,另检出灵芝病原真菌1株,鉴定为灵芝腐败木生红曲霉Xylogoneganodermophthora;检出药用真菌1株,鉴定为白囊耙齿菌Irpexlacteus。实验证明灵芝菌株间的拮抗作用更为突出,而灵芝与伴生真菌之间能交织生长,这影响到灵芝的品质。结论柬埔寨民间习用灵芝的药用特性尚需专业而系统的研究,方可确立为药用灵芝种质与资源的一个新自然分布区与产地;当地炭角菌属真菌以及采后储藏方式是影响柬埔寨灵芝品质或用药道地性的重要因素。
柬埔寨;野生灵芝菌株;ITS序列;伴生真菌;拮抗;品质
1 材料
1.1 灵芝子实体
野生灵芝新鲜幼嫩子实体购自柬埔寨戈公省私人售卖摊位(见图1)。挑选新鲜幼嫩未木质化子实体,采用两种储藏方式:1)4 ℃封藏:塑料袋密封4 ℃冷藏(菌株采集编号首数字为2的样品,2系列);2)常温阴干:塑料袋常温封存,但每日取出阴干(菌株采集编号首数字为6的样品,6系列)。对照菌株购自中国普通微生物菌种保藏管理中心,其中编号26为CGMCC5.26灵芝(红芝,赤芝,G.lucidum);编号69为CGMCC5.69中华灵芝(紫芝,G.sinense)。

注:1.野生灵芝售卖摊位;2~3.4 ℃封藏样品(2系列)正反面;4~7.常温阴干样品(6系列)正反面。图1 柬埔寨野生灵芝子实体
1.2 仪器试剂
植物基因组DNA提取试剂盒(Tiangen Biotech Co.,中国),2×Tag PCR Master Mix(北京艾德莱生物科技有限公司,中国),ITS通用引物由生工生物工程(上海)股份有限公司合成。高通量组织研磨仪(Retsch MM400,Germany),T100TMThermal Cycler PCR仪(BIORAD©,USA),1-14K小型高速离心机(SIGMA,Germany)。
2 方法
2.1 培养基
菌种分离培养基PDA1、菌种活化培养基PZDA1、液体薄层培养基PDA2详见表1。

表1 菌种分离鉴定用培养基 g
2.2 菌种分离
采用组织分离法,分别挑取菌柄内组织(S)和菌盖内组织(P),于PDA1平板24 ℃培养7~10 d后弃去可辨杂菌污染,挑取组织块上萌生的白色或近白色菌丝转接至PDA1斜面,于24 ℃培养2~3周后转入4 ℃冷藏。
2.3 ITS序列鉴定样品的准备
4 ℃储藏各菌株于PZDA1平板24 ℃活化培养10 d后,取菌落边缘φ4.5 mm的菌片接种于PDA2液体薄层,每编号重复3瓶,每瓶5 mL。24 ℃培养25 d后,3瓶重复菌丝合并,于35 ℃烘干后转入2 mL冻存管,-20℃封存。
2.4 DNA提取、扩增及测序
称取干燥样品约30 mg,用高通量组织研磨仪研磨2 min(30 Hz)后,按照植物基因组DNA提取试剂盒说明书操作步骤提取总DNA。PCR扩增引物、反应体系和反应程序参考《中国药典中药材DNA条形码标准序列》[5],ITS序列扩增使用的正向引物为5F:5′-GGAAGTAAAAGTCGTAACAAGG-3′,反向引物为4R:5′-TCCTCCGCTTATTGATATGC-3′。反应体系为2×Tag PCR Master Mix 12.5 μL,正反向引物(2.5 μmol·L-1)各1.0 μL,DNA模板2.0 μL,加无菌ddH2O补至25 μL。反应程序:94 ℃ 5 min;94 ℃ 1 min;50 ℃ 1 min;72 ℃ 1.5 min,每循环1次增加3 s,30个循环;72 ℃ 7 min。PCR扩增产物经1%琼脂糖电泳检测后,由测序公司进行双向测序。
2.5 数据处理
将测序峰图用Codon Code Aligner软件进行拼接,切除两端引物及低质量序列得到ITS序列。利用网络版BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi),对得到的序列进行鉴定。根据BLAST鉴定结果,从Genbank下载最相近序列。利用MEGA 6.0软件[6],对所得到的序列进行序列比对,并基于K2P模型,利用邻接(NJ)法构建系统聚类树(bootstrap:1000)。
2.6 灵芝与伴生真菌的拮抗现象观察
选取分子鉴定后的各灵芝菌株之间、灵芝菌株与相同子实体分离得到的对应半生真菌为拮抗对,经PDA1活化后在PZDA1平板上进行对峙培养,26 ℃培养5 d后观察双方菌丝间的拮抗情况,拍照并分析。分别采用田字、三叉接种法观察2、3个菌株的相互拮抗关系,采用十字架接种法观察1对3种菌株的相互拮抗关系;其中田字法并列接种相同菌株、三叉法和十字架法延径向外侧接种与内侧相同菌株,以相同菌株间的融合生长现象作为另侧拮抗现象的直观对照。
3 结果与分析
3.1 菌种分离
各菌株培养过程中的外观性状详见表2。虽然在不同培养基上有差异,液体薄层中变化更大,但大多数菌株表现出与灵芝菌丝相似的特点,诸如新生菌丝白色,老熟菌丝显现黄褐色,由于外观性状有较大重叠,且其后的拮抗试验显示灵芝与非灵芝菌丝间可交织生长,造成混淆,须配合分子手段鉴别。
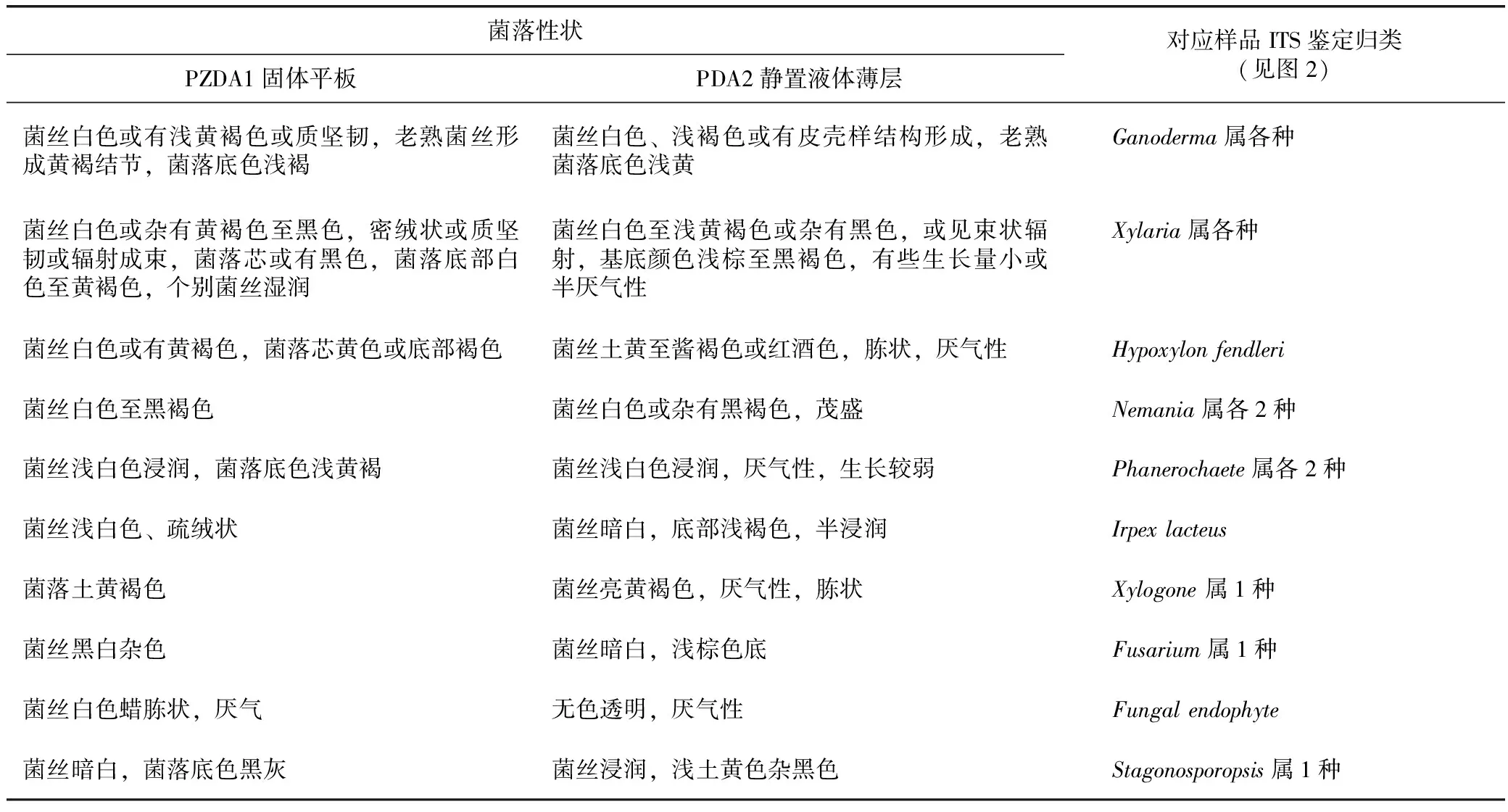
表2 各菌株在PZDA1及PDA2中的菌落性状
3.2 ITS测序及鉴定结果
本实验共得到64株分离样品及2株对照样品26和69的ITS序列,ITS序列长度为475~647 bp,平均GC含量为47.8%。将所得序列进行BLAST检索,并下载最相近序列构建NJ树。结果显示64株分离样本中灵芝属有22株,占比34.4%;其中19株与G.lingzhi的BLAST相似性最高,3株与G.sichuanense的BLAST相似性最高,1株与G.lucidum的BLAST相似性最高,在NJ树中它们聚在一枝,且支持率为92%,因此本研究将三者归并定为G.lingzhi。鉴于与对照株26(G.lucidum)之间≥99%的相似性,结合文献研究与论证[2,7],本研究认为G.lingzhi、G.sichuanense与GenBank中诸多记录为G.lucidum的中国栽培芝种之间显著趋同,但柬埔寨灵芝的药用特性仍需与诸多中国栽培灵芝菌株进一步比较研究。对照株69已知为紫芝(G.sinense),与GenBank发表的G.japonicum和G.sinense有较高的BLAST相似性,NJ树聚成一个分枝,且支持率为100%,结果支持学界通常认为G.sinensis与G.japonicum为同物异名的观点。
在非灵芝菌株主要为炭角菌属(Xylaria,23株)及炭团菌属(Hypoxylon,10株),分别占比35.9%及15.6%。另有其他属9株。23株炭角菌属样品中,有8株样品鉴定为Xylariasp.,7株鉴定为斐济炭角菌Xylariafeejeensis,4株鉴定为古巴炭角菌Xylariacubensis,2株鉴定为类陀螺炭角菌Xylariaapoda,1株鉴定为暗棕炭角菌Xylariabadia;10个炭团菌属样本与芬德勒氏炭团菌Hypoxylonfendleri)BLAST相似性较低(95%~97%),但在NJ树中与Hypoxylonfendleri构成的分枝支持率为100%,因此这些样本被暂定为Hypoxylonfendleri;在Phanerochaete属的2个样本中,1个样本BLAST最相似的物种有两个,另一个最相似物种为Phanerochaetesp.,并且两者在NJ树中聚在一枝,因此都被鉴定为Phanerochaetesp.。其他样本BLAST结果与NJ树结果一致,具有较高的可信度,具体鉴定结果见图2。
3.3 样品储藏方式的影响
由两种储藏方式中灵芝的检出情况可见,4 ℃封藏方式得到灵芝的比例仅为5.0%,远低于常温阴干方式的47.7%,说明采后保存方式明显影响灵芝的带菌程度。另外,由菌柄组织(S)分离到灵芝14株(占63.6%);显著优于菌盖组织(P)(8株,占36.4%)。
将两种储藏方式中非灵芝菌株的检出情况进行整理,见表3。非灵芝菌株主要为炭角菌属真菌,其次为炭团菌属。常温阴干条件下,主要为炭角菌属真菌污染,在菌盖中更为严重(69.2%);在4 ℃封藏条件下,低温及饱和湿度明显抑制了灵芝菌盖中炭角菌属真菌(16.7%)和子实体本身的活力,这时炭团菌属真菌在菌盖中迅速增长,占据优势地位(83.3%)。因此,采收后的加工储藏环节对保存柬埔寨灵芝原始品质尤为关键。

表3 非灵芝菌株检出情况
3.4 灵芝菌株之间以及灵芝与炭角菌和炭团菌之间的拮抗特点
拮抗试验结果见表4。结果显示各菌株之间出现相容、拮抗和交织并存3种情况。其中菌丝相容现象全部出现在某菌株与它自己之间(见图3),与对侧接种的另类菌株形成鲜明对照;拮抗现象全部出现在任一灵芝菌株与其他灵芝菌株之间(见图3);而菌落交汇处菌丝交织并存现象全部出现在灵芝与同芝来源的伴生真菌之间(见图3)。各灵芝菌株之间的拮抗现象说明体细胞不亲和性的广泛存在,这种菌株异质性构成了柬埔寨灵芝遗传多样性的物质基础,成为灵芝品种选育与发展种植产业的种源基础。灵芝生活菌丝与伴生真菌之间未见显著的排斥或相互免疫,而是在菌落交汇处菌丝交织并存,这反映出灵芝与当地某些代表性真菌之间存在较为亲密的共存关系,双方菌丝一定程度上扭结生长在一起,这必然影响到灵芝的品质。

注:NJ树各分枝中已知物种名和Genbank号的序列为Genbank下载的参考序列;分枝前的两个数字,前者为分枝支持度,后者为该份样品序列与参照序列的最小BLAST相似性;NJ树右侧的物种名,为对应样本推荐鉴定的物种名。图2 柬埔寨灵芝样品及最相近序列NJ树
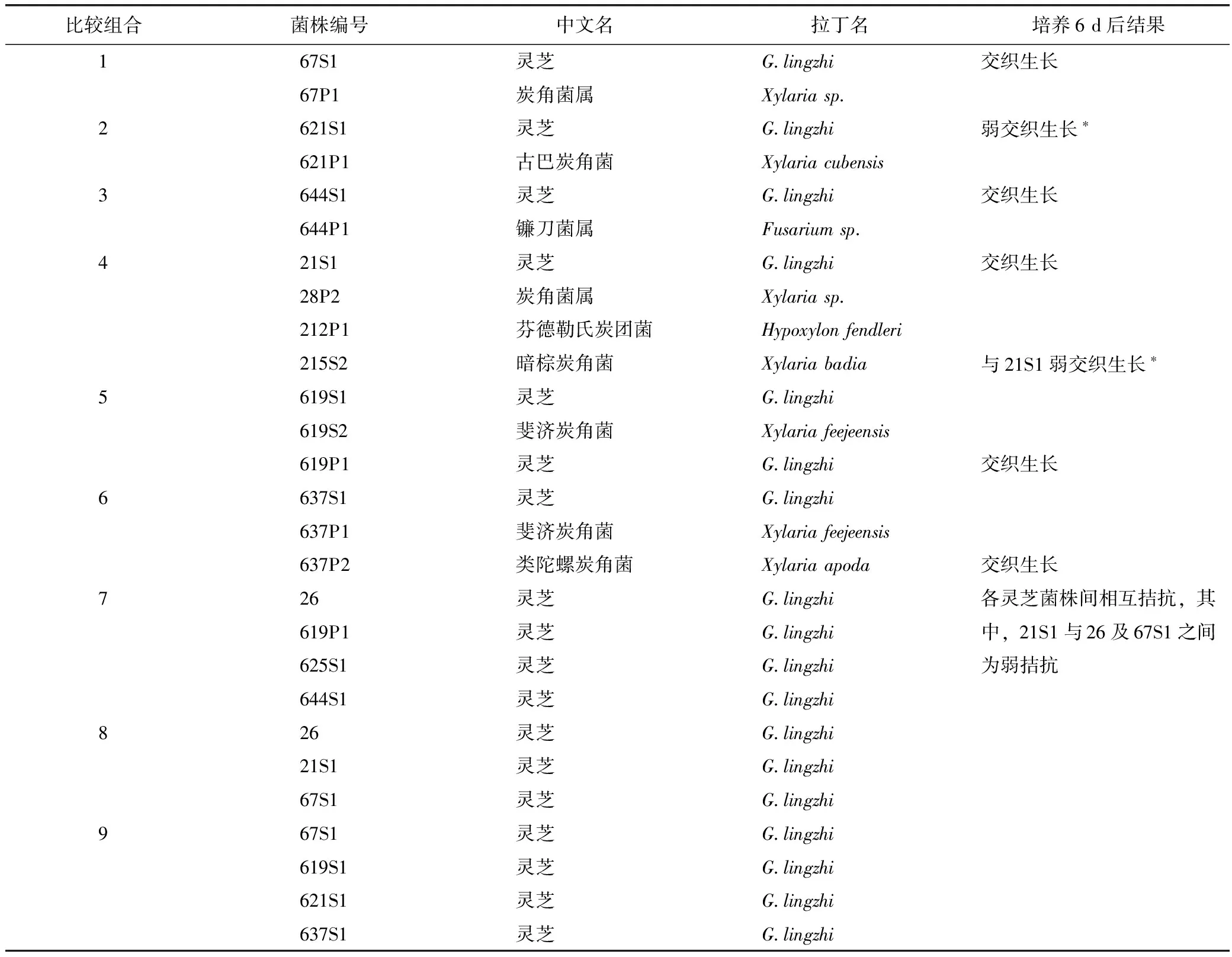
比较组合菌株编号中文名拉丁名培养6d后结果167S1灵芝Glingzhi交织生长67P1炭角菌属Xylariasp2621S1灵芝Glingzhi弱交织生长∗621P1古巴炭角菌Xylariacubensis3644S1灵芝Glingzhi交织生长644P1镰刀菌属Fusariumsp421S1灵芝Glingzhi交织生长28P2炭角菌属Xylariasp212P1芬德勒氏炭团菌Hypoxylonfendleri215S2暗棕炭角菌Xylariabadia与21S1弱交织生长∗5619S1灵芝Glingzhi619S2斐济炭角菌Xylariafeejeensis619P1灵芝Glingzhi交织生长6637S1灵芝Glingzhi637P1斐济炭角菌Xylariafeejeensis637P2类陀螺炭角菌Xylariaapoda交织生长726灵芝Glingzhi各灵芝菌株间相互拮抗,其619P1灵芝Glingzhi中,21S1与26及67S1之间625S1灵芝Glingzhi为弱拮抗644S1灵芝Glingzhi826灵芝Glingzhi21S1灵芝Glingzhi67S1灵芝Glingzhi967S1灵芝Glingzhi619S1灵芝Glingzhi621S1灵芝Glingzhi637S1灵芝Glingzhi
注:*弱交织生长表现为仅在菌落接触面有交织生长,不向对方菌落纵深发展。
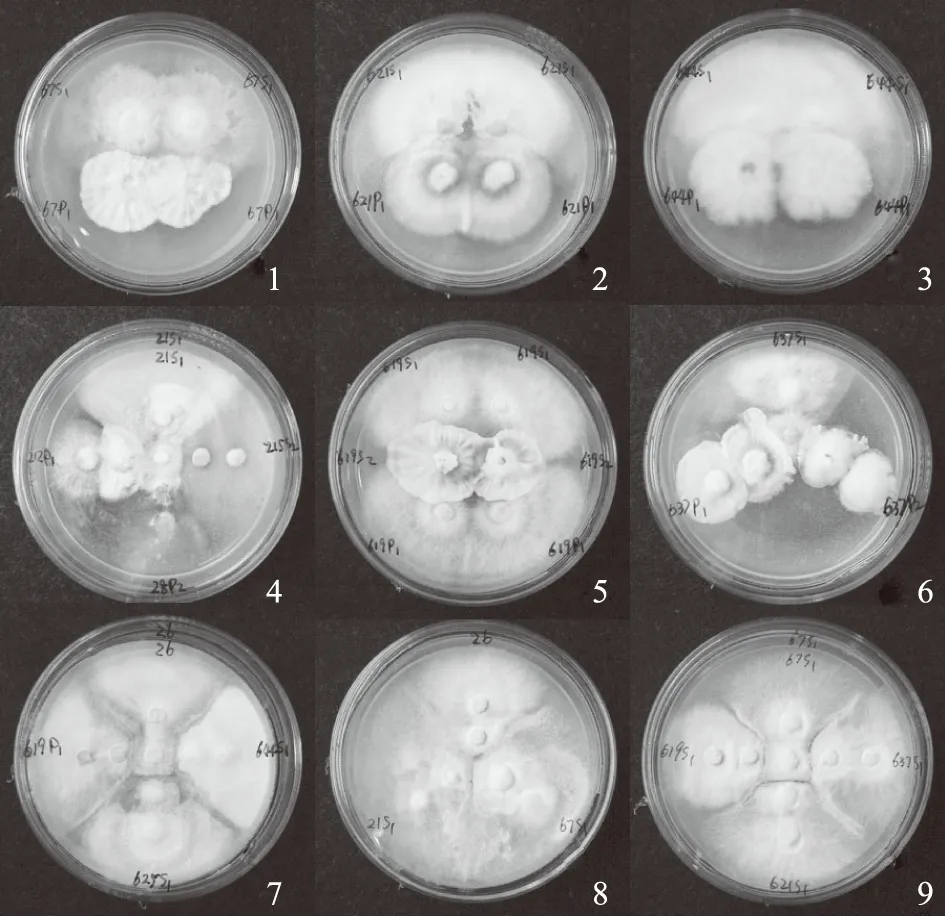
注:1~9分别对应表4比较组合1~9。图3 灵芝菌株之间以及与炭角菌和炭团菌之间的拮抗
4 讨论
4.1 检测结果中灵芝种类的单一性
分离到的灵芝菌种集中为G.lingzhi,与荳蔻山原始热带雨林中灵芝的生物多样性不符,分析原因应为选材时间和采集地点集中,而且仅选择发育幼嫩程度较一致的子实体所致,许多外观典型的假芝、喜热灵芝、热带灵芝、拟热带灵芝的子实体因当时已发育成熟并严重木质化,不易分离菌种,因而未收集。张杰等[8]将G.sichuanense归为亚热带分布的种类,而对于原生于豆蔻山热带雨林的G.sichuanense和G.lingzhi,需进一步比较与中国常用栽培种的产量、品质特性,才能更精确阐明其药用特性。
4.2 对原生植被研究的重要性
除少数寄主专一性较强的种类外,通常灵芝可生长在多种硬木类阔叶树的腐木上,大量研究显示不同菌材显著影响灵芝的质量[9]。豆蔻山热带雨林水分及光热资源充足、植被茂盛、群落结构复杂,为木腐真菌提供了多样化的生长基质,从而导致当地灵芝品质存在变化。然而,对柬埔寨植物的研究几乎处在空白状态,对原生植被的研究是影响当地灵芝产业科学并可持续发展的基础。同时,特有的热带气候环境为灵芝的品种选育提供了理想的试验田。
4.3 伴生菌对灵芝药材的影响及采收加工的规范化
野生灵芝在自然环境中生长发育,子实体原基发生于枯立木、老树桩或地表以下树根上,因此菌柄容易夹带更多土壤微生物,而菌盖更多接触地表以上山谷风中的游离微生物。实验证实,分离自菌柄与菌盖的非芝微生物种类有明显差异(见表3)。研究显示炭角菌属、炭团菌属常常为植物内生真菌并产生丰富的次生代谢物[10-12],具有多种药理活性,因此,以森林腐木为基料的野生灵芝其生长发育和品质必定受到影响;同时,研究还证明共生的炭角菌能参与到寄主的代谢中,形成与寄主相同或相似的代谢产物[12-13],最终影响药材的道地性[14]。本研究结果显示灵芝与伴生真菌菌丝间的交织生长现象提示了半生真菌影响灵芝品质的可能性,需要更深入的研究。同时,特定气候条件下的微生物环境显然是促成柬埔寨灵芝道地性的原因之一。
药材的微生物毒素污染引起各国政府的重视,越来越多内容被列入到检测条款中[15]。刚采摘的灵芝表面有糖性物质,明显粘手,很适合微生物生长。分析本研究结果可知,采摘后迅速脱水干燥是保持灵芝原初品质最为简单有效的方法,但这在柬埔寨当地粗放条件下很难做到;因此,因地制宜规范采收加工操作流程,是保证柬埔寨野生灵芝品质的必要条件。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015:188-189.
[2] 吴兴亮,宋斌,赵有兴,等.中国药用灵芝及名称使用商榷[J].贵州科学,2013,31(1):1-17.
[3] 黄龙花,杨小兵,张智,等.基于ITS序列分析鉴定灵芝属菌种[J].中国食用菌,2010,29(1):55-57.
[4] 唐传红,张劲松,陈明杰,等.利用拮抗试验和RAPD对灵芝属菌株进行分类研究[J].微生物学通报,2005,32(5):72-76.
[5] 陈士林.中国药典中药材DNA条形码标准序列[M].北京:科学出版社,2015:25.
[6] Tamura K,Stecher G,Peterson D,et al.Mega 6:Molecular evolutionary genetics analysis version 6.0[J].Mol Biol Evol,2013,30(12):2725-2729.
[7] Cao Y,Wu S H,Dai YC.Species clarification of the prize medicinal Ganoderma mushroom“Lingzhi”[J].Fungal Diversity,2012,56:49-62.
[8] 张杰.灵芝属部分真菌系统发育及药用成分的研究[D].贵阳:贵州大学,2006.
[9] 胡惠萍,周洁莹,夏凤娜,等.不同原料栽培的灵芝孢子粉质量比较试验[J].食用菌,2008(4):27-29.
[10] Ezra G Baraban,Jesse B Morin,Gillian M Phillips,et al.Xyolide,a bioactive nonenolide from an Amazonian endophytic fungus,Xylaria feejeensis[J].Tetrahedron Letters,2013,54:4058-4060.
[11] Fan N W,Chang H S,Cheng M J,et al.ChemInform Abstract:Secondary Metabolites from the Endophytic Fungus Xylaria cubensis[J].Helvetica Chimica Acta,2014,97(12):1689.
[12] 张方方,王明兹,刘海元,等.闽浙马尾杉内生真菌炭团菌NX9产石杉碱甲的发酵条件优化[J].中国医药工业杂志[J].2015,46(8):827-832.
[13] 高聪,罗俊,刘霞,等.炭角菌属真菌化学成分与生物活性研究进展[J].菌物学报,2016,35(7):767-781.
[14] 马广强,徐红波,朱金华,等.植物内生菌对道地药材道地性的影响[J].江西中医药大学学报,2014,26(1):56-58.
[15] 杨美华.药用植物及其产品中真菌及真菌毒素污染研究进展[J].贵州农业科学,2008,36(6):59-63.
EvaluationofAntagonisticEffectbetweenGanodermaIsolatesandCompanionFungifromCambodia
TONG Xiran,GUO Haojie,LUO Li,ZHANG Zhao,QI Yaodong*,ZHANG Bengang*
(InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences,PekingUnionMedicalCollege,KeyLaboratoryofBioactiveSubstanceandResourcesUtilizationofChineseHerbalMedicine,MinistryofEducation,Beijing100193,China)
Objective:To isolate and identify ferineGanodermaisolates in Cambodia and its companion fungi,and evaluate the influence of companion fungi by antagonistic test.Methods64 fungal strains from the folk usedGanodermain Cambodia were investigated by analysis of ITS sequences.The relationship ofGanodermaand companion fungus which came from the same fruiting body were judged by antagonistic effect.Results22 isolates wereGanoderma,in the proportion of 34.4%,including 19Ganodermalingzhiand 3Ganodermasichuanense.XylariaandHypoxylonwere most commonly in non-Ganoderma,in the proportion of 35.9% and 15.6%,respectively.In addition,aGanodermapathogen was isolated and identified asXylogoneganodermophthora,a medicinal fungus was isolated and identified asIrpexlacteus.It is proved that the antagonistic effect was more evident amongGanodermaisolates,but interwoven growth occurred betweenGanodermaand companion fungus,this will affect the quality of Ganoderma.ConclusionThe medicinal properties still need professional and systematic research of the folk used ferineGanodermain Cambodia,and then be able to established as a new natural distribution or producing area of medicinalGanodermagermplasm or resources.The nativeXylariaand storage mode are more important factors to affecting the quality or Geo-herbalism of CambodiaGanoderma.
Cambodia;ferineGanodermaisolates;ITS;companion fungus;antagonistic test;quality
10.13313/j.issn.1673-4890.2017.9.003
中国医学科学院医学与健康科技创新工程项目(2016-I2M-2-003)
*
齐耀东,博士,助理研究员,研究方向:中药资源与濒危药用植物保护、分子系统学与分子地理学,Tel:(010)57833196,E-mail:ydQi@implad.ac.cn;张本刚,研究员,博士生导师,研究方向:中药资源鉴定及保护利用,Tel:(010)62899725,E-mail:bgzhang@implad.ac.cn
2017-01-06)
