血管紧张素Ⅱ与分泌型卷曲相关蛋白5在心肌细胞肥大中相关性研究
2017-12-21金鑫郭炳彦杨蓉常亮王亚玲苗成龙刘素云张辉李拥军
金鑫,郭炳彦,杨蓉,常亮,王亚玲,苗成龙,刘素云,张辉,李拥军
基础与实验研究
血管紧张素Ⅱ与分泌型卷曲相关蛋白5在心肌细胞肥大中相关性研究
金鑫,郭炳彦,杨蓉,常亮,王亚玲,苗成龙,刘素云,张辉,李拥军
目的:探讨分泌型卷曲相关蛋白5(sFRP5)在心肌细胞肥大中的表达情况及其发挥的作用。 方法:体外培养SD乳鼠心肌细胞,应用血管紧张素Ⅱ(AngⅡ)诱导心肌细胞肥大。替米沙坦、PD123319分别阻滞血管紧张素1型受体(AT1R)、血管紧张素2型受体(AT2R)的表达,逆转录聚合酶链反应(RT-PCR)及蛋白免疫印迹法(Western bolt)检测sFRP5、脑利钠肽(BNP)及肿瘤坏死因子-a(TNF-a)的表达。 结果:sFRP5 能够在心肌细胞中表达。sFRP5 mRNA及蛋白水平、BNP蛋白水平的表达随Ang Ⅱ干预时间的延长而增加, 48 h达到最高值 (P<0.05)。与Ang Ⅱ(10-6mol/L)组相比,Ang Ⅱ+替米沙坦(10 μmol/L)组sFRP5 mRNA和蛋白水平显著降低(P<0.05),Ang Ⅱ +PD123319(10 μmol/L)组 sFRP5 mRNA 和蛋白水平差异无统计学意义(P>0.05);与Ang Ⅱ (10-6mo1/L)+ sFRP5(0 ng/ml)组比较,Ang Ⅱ(10-6mo1/L)+sFRP5 (10 ng/ml)组及Ang Ⅱ(10-6mo1/L)+sFRP5 (100 ng/ml)组BNP蛋白及TNF-a的蛋白表达水平明显下降(P<0.05)。 结论:在Ang Ⅱ诱导的心肌细胞肥大过程中,主要通过血管紧张素Ⅱ型受体上调sFRP5的表达,且sFRP5在抑制心肌细胞肥大中发挥作用。
血管紧张素Ⅱ;心肌细胞肥大;脂肪细胞因子
(Chinese Circulation Journal, 2017,32:1227.)
心肌肥厚是由细胞外刺激信号作用于细胞并通过一系列信号转导通路引起细胞内基因表达的活化与失活,并最终引起细胞表型改变的过程,主要表现为心肌细胞的肥大和间质成分的改变[1]。血管紧张素Ⅱ(Ang Ⅱ)通常被选择作为心肌细胞肥大的诱导剂,直接导致心肌肥厚[2]。分泌型卷曲相关蛋白(sFRP) 5 属于分泌型卷曲相关蛋白(sFRP)家族中的一员,是一种新近发现的与肥胖和胰岛素抵抗有关的脂肪细胞因子和抗炎因子[3,4]。已有研究证实,sFRP1~4在心肌组织中表达, sFRP3、4在心肌肥厚中表达增加[5]。本研究探讨sFRP5在心肌细胞肥大中的表达情况及其发挥的作用。
1 材料与方法
1.1 材料:出生2~3天的Sprague-Dawley(SD)大鼠乳鼠(购自河北医科大学实验动物中心),甘油醛-3-磷酸脱氢酶(DMEM)培养液、青霉素、链霉素、D-Hanks、Ⅱ型胶原酶干粉、胰蛋白酶干粉及胎牛血清购自Sigma公司(圣路易斯,美国),Ang Ⅱ、sFRP5抗体、替米沙坦、PD123319系Gibico产品(加利福尼亚,美国)。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、二甲亚砜(DMSO),Trizol试剂, 多聚酶链反应(PCR)扩增剂、逆转录PCR(RTPCR)检测试剂盒购自Promega公司(麦迪逊,美国),脑利钠肽(BNP)、肿瘤坏死因子(TNF-a)兔抗鼠抗体、二抗IRDye 700 DX购自GIBCO公司(比灵斯,美国)。5-溴脱尿苷(5-BrdU)购自Santa Cruz公司(美国)。
1.2 心肌细胞原代培养:将SD乳鼠用75%医用酒精消毒,持眼科剪沿剑突下剪开肋骨,暴露心脏,剪取左心室心尖部分,置入预冷的D-Hanks清洗液中,反复清洗3遍;后将心肌组织放入小培养瓶中,应用另一眼科剪剪碎至1 m3左右;加入4 ml预先配好的混合消化酶液,放入无菌小转子,至磁力搅拌器上,在37℃恒温条件下进行消化,搅拌5 min,弃上清;消化2次后,吸上清液于10 ml离心管中,加入含有10%小牛血清的低糖DMEM 4 ml终止消化,置于离心机中以112 g离心,弃上清,加入含有10%胎牛血清的培养基4 ml,离心,再弃上清,最后加入含有10%小牛血清的低糖DMEM 2 ml,重悬后备用;按上述方法重复消化,共约10~12次,直到完全消化;收集心肌细胞,用200目无菌细胞筛过滤并移入直径为10 cm的培养皿中,温箱中孵育2 h。
1.3 心肌细胞的纯化及培养:吸取心肌细胞悬浮液,在另一培养皿中进行细胞计数;加入终浓度为0.1 mmol/L的5-BrdU,后按106/ml的密度将心肌细胞悬液接种于六孔板。于孵育箱中培养48 h;后换为无血清、无5-BrdU的培养基继续培养24 h后进行实验。
1.4 实验分组:干预药物均由无菌过滤器过滤除菌后加入心肌细胞。(1)对照组:正常心肌细胞不加任何干预因素;(2)不同浓度的Ang Ⅱ(10-5~-8mo1/L)、不同作用时间(12、25、48和72 h)对sFRP5 mRNA和蛋白水平及BNP蛋白表达的影响:Ang Ⅱ组:Ang Ⅱ(10-6mol/L)作用心肌细胞48 h刺激心肌细胞肥大;(3)Ang Ⅱ 受体阻滞剂对心肌细胞sFRP5和BNP表达的影响:①Ang Ⅱ + 替米沙坦组及Ang Ⅱ+ PD123319组:分别用AT1R阻滞剂替米沙坦(10 μmol/L)及 AT2R 阻滞剂 PD123319(10 μmol/L)干预心肌细胞30 min,后用Ang Ⅱ (10-6mol/L)刺激48 h;②替米沙坦组及PD123319组:即正常心肌细胞分别给予替米沙坦(10 μmol/L)及 PD123319(10 μmol/L);(4)不同浓度的sFRP5对心肌细胞肥大中BNP和TNF- a表达的影响:分别用不同浓度的sFRP5(0、10和100 ng/ml)干预心肌细胞4 h后,用AngⅡ(10-6mol/L)刺激48 h。分为Ang Ⅱ (10-6mo1/L)+sFRP5(0 ng/ml)组,Ang Ⅱ(10-6mo1/L)+sFRP5 (10 ng/ml)组及Ang Ⅱ(10-6mo1/L)+sFRP5 (100 ng/ml)组,每天加药一次,每2天换液一次。
1.5 噻唑兰法检测心肌细胞活力:心肌细胞以1×105/ml的密度种植于96孔板中,处理心肌细胞后,加入5 mg/ml 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT ,商品名:噻唑兰)溶液20 μl于培养基中,在37℃条件下继续培养4 h,之后每孔加入150μl的DMSO,并震荡10 min,将96孔细胞培养板置入全自动酶标仪,在490 nm波长处测定其光吸收值。
1.6 逆转录-聚合酶链反应检测sFRP5、BNP等mRNA的表达:采取Trizol法提取心肌细胞总RNA,取2 μg总RNA进行逆转录后取2 μl行PCR反应。sFRP5的上游引物5'-ACTTTGAATGCCGTGAA-3',下游引物5'-AATCCAGTTGGTGAGCC-3',扩增片段长度为多少113 bp,PCR反应体系20 μl,反应条件为94℃变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环,72 ℃延伸7 min,甘油醛-3-磷酸脱氢酶(GAPDH)的上游引物5'-GAGGCTCTCTTCCAGCCTTC-3',下游引物5'-AGGGTGTAAAAGCAGCTCA-3',PCR 反应体系20μl,反应条件为 94 ℃变性 5 min,94 ℃变性 30 s,55℃退火30 s,72℃延伸30 s,28个循环,72℃延伸7 min,得到的PCR产物2%的琼脂糖电泳并用成像系统扫描摄片。
1.7 蛋白免疫印迹法(Western blot)检测sFRP5、BNP、TNF-α等蛋白的表达:收集细胞,提取细胞总蛋白。取样品蛋白50μg,SDS-聚丙烯酰胺凝胶电泳法分离,转膜,5%BSA封闭2 h后,用含5%脱脂奶粉的TBST缓冲液(Tris-HCl,pH=7.4;NaCl,Tween-20)洗膜,依次加入sFRP5(1:500)及BNP抗体(1:500)及TNF-α(1:500) 4℃孵育过夜,洗完膜后,二抗(1:2 000)孵育2 h后,ECL显色系统检测,Ban&can 图像分析系统定量各蛋白条带的总灰度值, GAPDH作为内参照。

2 结果
2.1 心肌细胞形态学观察
刚提取的心肌细胞在倒置显微镜下观察呈圆形。培养2~4 h细胞开始贴壁生长,后细胞逐渐展开,伸出伪足,变为三角形、星形、多边形等形态,培养12 h后,少数贴壁的单个细胞出现自发性搏动。培养24 h后,心肌细胞全部贴壁,自发性搏动的频率100 次/min左右。MTT法测定细胞存活率约95%。
2.2 RT-PCR和Western Blot检测sFRP5 mRNA和蛋白在心肌细胞中的表达(图1)
心肌细胞mRNA和蛋白水平均可检测到sFRP5的表达, 且sFRP5在心肌细胞中表达明显高于心肌成纤维细胞(P<0.05)。
2.3 不同浓度的 Ang Ⅱ( 10-5~10-8mo1/L )对 sFRP5 mRNA、蛋白水平的影响
在Ang Ⅱ10-5~10-8mo1/L浓度中,大鼠心肌细胞sFRP5 mRNA及蛋白水平表达的比较分别为1.53±0.01、1.58±0.02、1.85±0.01、1.80±0.01 及0.54±0.01、0.66±0.03、0.93±0.01、0.77±0.02,大鼠心肌细胞细胞中sFRP5 mRNA及蛋白水平表达随Ang Ⅱ浓度的升高而增加,当浓度达到10-6mo1/L时达到最高值,之后呈下降趋势(P均<0.05),当Ang Ⅱ浓度增加到10-5mo1/L后sFRP 5 mRNA水平与浓度为10-6mo1/L时相比并未见明显差异(P>0.05)。由此我们确定10-6mo1/L的Ang Ⅱ浓度作为下一步实验的依据。

图1 RT-PCR(1A)和Western Blot(1B)检测sFRP5 mRNA和蛋白在心肌细胞中的表达(n=3)
2.4 Ang Ⅱ(10-6mo1/L )在不同时间点(12、24、48和72 h)对心肌细胞sFRP 5和BNP表达的影响
sFRP5 mRNA水平在不同时间点的sFRP5/GAPDH值分别为1.37±0.0、1.53±0.03、1.82±0.01和1.57±0.012 ,随着干预时间延长,sFRP5/GAPDH值48 h为最高(P>0.05),72 h开始降低(P均>0.05) ;在不同时间点BNP/GAPDH值分别为0.31±0.02 、 0.62±0.04、0.79±0.01 和 0.66±0.01,随着干预时间延长,48 h达到最高值,72 h后明显降低(P均<0.05)。但与24 h时相比,无明显变化,差异无统计学意义(P>0.05)。
2.5 AngⅡ受体阻滞剂对大鼠心肌细胞sFRP5 mRNA和蛋白表达的影响
与对照组比较,AngⅡ组sFRP5 mRNA水平和蛋白表达水平显著升高;与AngⅡ组相比,AngⅡ+替米沙坦组sFRP5 mRNA水平和蛋白表达水平显著降低(P<0.05);替米沙坦组sFRP5蛋白和mRNA水平表达水平较对照组无明显变化(P>0.05,图2A)。Ang Ⅱ +PD123319组与 Ang Ⅱ组相比,sFRP5 mRNA水平和蛋白表达水平差异无统计学意义(P>0.05,图 2B)。
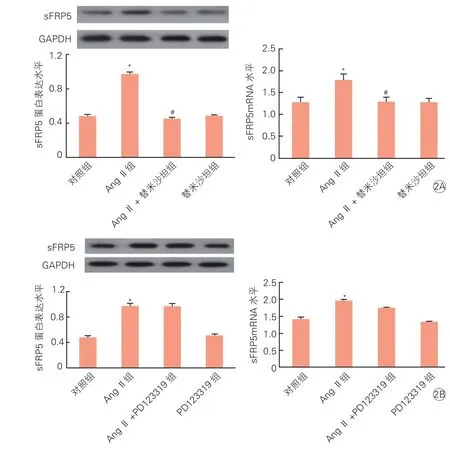
图2 AngⅡ受体对大鼠心肌细胞sFRP5 mRNA及蛋白表达的影响 (n=3)
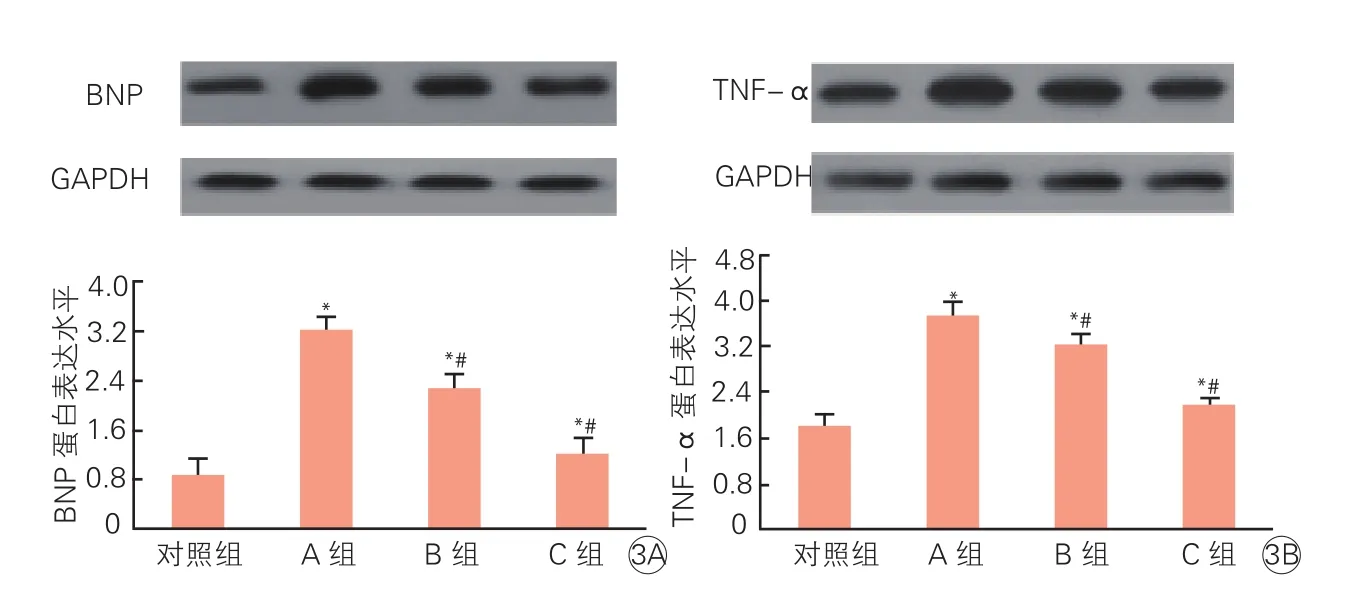
图3 sFRP5对大鼠心肌细胞肥大中BNP及TNF-a蛋白表达的影响(n=3)
2.6 不同浓度sFRP5对心肌细胞BNP及TNF-a蛋白表达的影响(图3)
与对照组相比,随着sFRP5刺激浓度的增加,BNP及TNF-a的蛋白表达水平增加(P<0.05),与Ang Ⅱ(10-6mo1/L)+sFRP5(0 ng/ml)组相比,AngⅡ(10-6mo1/L)+sFRP5 (10 ng/ml)及AngⅡ(10-6mo1/L)+sFRP5 (100 ng/ml)组BNP(图3A)及TNF-a(图3B)的蛋白表达水平明显下降,且在Ang Ⅱ(10-6mo1/L)+sFRP 5 (100 ng/ml)组下降最明显(P<0.05)。
3 讨论
sFRP5除了可以在脂肪组织中表达外,在视网膜色素上皮细胞中高表达,在胰腺中也有表达,在肝脏和肌肉组织中微弱表达[6,7]。研究证实,sFRP1~4在心肌组织中表达,sFRP3、4在心肌肥厚中表达增加。以往关于sFRP5的研究主要集中在胚胎发育、肿瘤发生及凋亡等过程,近年来其抗炎、抗动脉粥样硬化、抗胰岛素抵抗等保护作用已经有研究相继报道,但是对于sFRP5在心肌肥厚中的表达情况研究甚少。
Ang Ⅱ的生物学作用主要是通过 AngⅡ 1型受体(Ang Ⅱ types 1 receptor, AT1R)和 AngⅡ 2型受体(Ang Ⅱ types 2 receptor, AT2R)介导的,这两种受体均属于G蛋白偶联受体[8],但是它们的组织分布以及细胞内信号转导途径是不相同的。AT1R在成年组织器官中丰富表达,主要分布于肺、血管平滑肌细胞、肝、肾、肾上腺[9]。AngⅡ与AT1R结合可引起心肌肥厚和细胞外基质蛋白的积聚、促进醛固酮分泌、内皮细胞的损伤以及调节细胞因子、化学趋化因子和黏附分子等炎症介质的表达等[10]。Ang Ⅱ与AT2R结合则起与AT1R结合相反的作用。在病理情况下,AT2R表达上调,参与细胞分化、组织再生、扩张血管、促进尿钠排泄、抑制内皮和平滑肌细胞增殖、细胞凋亡等过程[11]。也有研究证实在心室肥厚、心肌梗死以及心力衰竭时AT2R表达相对上调,介导AngⅡ的主要作用[12]。因此,在Ang Ⅱ诱导心肌肥厚过程中,sFRP5的表达增加与哪个受体有关,尚不明确。
本研究体外大鼠心肌细胞培养并给予Ang Ⅱ刺激,诱导心肌细胞肥大,观察Ang Ⅱ两种受体在sFRP5表达增加中所起的作用。结果显示,sFRP5能够在心肌细胞中表达。Ang Ⅱ诱导心肌细胞肥大,通过检测BNP蛋白表达情况间接评价心肌细胞肥大情况。证明不同浓度Ang Ⅱ干预心肌细胞后,sFRP5的表达随着干预浓度和干预时间的变化有所变化,且呈浓度和时间依赖性,并且和BNP的变化趋势有相关性。通过不同浓度的sFRP5干预肥大的心肌细胞,从而发现,sFRP5抑制BNP及TNF-a的表达增加,证实sFRP5的心脏保护作用。
替米沙坦和PD123319分别是AT1R和AT2R特异性受体拮抗剂,sFRP5的表达在替米沙坦+AngⅡ组中明显低于Ang Ⅱ组,Ang Ⅱ引起的sFRP5表达增加几乎完全可以被替米沙坦抑制,说明Ang Ⅱ诱导的心肌细胞肥大主要由AT1R介导,而不是通过AT2R起作用。这和我们上述的推测一致。
总之,本文的研究证实sFRP5可以在心肌细胞中表达,并且在心肌肥大过程中呈现上调趋势。这一过程主要是由AT1R介导的。sFRP5在抑制心肌细胞肥大中发挥保护作用。
[1] 张昌琳, 乔树宾. Apelin-APJ 系统在心肌肥厚发生发展过程中作用的研究进展. 中国循环杂志, 2015, 30: 398-400.
[2] Rosenbaugh EG, Savalia KK, Manickam DS, et al. Antioxidant-based therapies for angiotensin Ⅱ-associated cardiovascular diseases. Am J Physiol Regul Integr Comp Physiol, 2013, 304: R917-R928.
[3] Ouchi N, Higuchi A, Ohashi K. Sfrp5 is an anti-inflammatory adipokine that modulates metabolic dysfunction in obesity. Science,2010, 329: 454-457.
[4] Almario RU, Karakas SE. Roles of circulating WNT-signaling proteins and WNT-inhibitors in human adiposity, insulin resistance, insulin secretion, and inflammation. Horm Metab Res, 2015, 47: 152-157.
[5] Schumann H, Holtz J, Zerkowski HR, et al. Expression of secreted frizzled related proteins 3 and 4 in human ventricular myocardium correlates with apoptosis related gene expression. Cardiovasc Res,2000, 45: 720-728.
[6] Holly VL, Widen SA, Famulski JK, et al. Sfrp1a and Sfrp5 function as positive regulators of Wnt and BMP signaling during early retinal development. Dev Biol, 2014, 388: 192-204.
[7] Peng C, Xiao X, Kang B, et al. Serum secreted frizzled-related protein 5 levels differentially decrease in patients with hepatitis B virusassociated chronic infection and hepatocellular carcinoma. Oncol Lett,2014, 8: 1340-1344.
[8] Branco AF, Allen BG. G protein-coupled receptor signaling in cardiac nuclear membranes. J Cardiovasc Pharmacol, 2015, 65: 101-109.
[9] Magnani F, Pappas CG, Crook T, et al. Electronic sculpting of ligand-GPCR subtype selectivity: the case of angiotensin Ⅱ. ACS Chem Biol,2014, 9: 1420-1425.
[10] McNeill H, Vinson GP. Regulation of MAPK activity in response to dietary sodium in the rat adrenal gland. Endocr Res, 2000, 26: 879-883.
[11] Gao J, Chao J, Parbhu KJ, et al. Ontogeny of angiotensin type 2 and type 1 receptor expression in mice. J Renin Angiotensin Aldosterone Syst, 2012, 13: 341-352.
[12] Horiuchi M, Akishita M, Dzau VJ. Recent progress in angiotensin Ⅱtype 2 receptor research in the cardiovascular system. Hypertension,1999, 33: 613-621.
Relationship Between Angiotensin Ⅱ, Secreted Frizzled-related Protein 5 and Rat's Cardiomyocyte Hypertrophy in Vitro
JIN Xin, GUO Bing-yan, YANG Rong, CHANG Liang, WANG Ya-ling, MIAO Cheng-long, LIU Su-yun, ZHANG Hui,LI Yong-jun.
Department of Cardiology, The Second Hospital of Hebei Medical University, Shijiazhuang (050000), Hebei, China
LI Yong-jun, Email:lyjbs001@163.com
Objective: To investigate the expression and effect of secreted frizzled-related protein 5 (sFRP5) in rat’s cardiomyocyte hypertrophy in vitro.
Methods: Neonatal rat’s ventricular myocytes were cultured in vitro, cardiomyocyte hypertrophy was induced by Ang Ⅱ.Telmisartan and PD123319 were used to block angiotensin type 1 receptor (AT1R) and angiotensin type 2 receptor (AT2R)respectively. RT-PCR and Western-blot analysis were conducted to examine the expressions of sFRP5, BNP and TNF-α.
Results: sFRP5 was expressed in cardiomyocytes. The mRNA and protein expressions of sFRP5, protein expression of BNP were increased by prolonged time of AngⅡ treatment, the maximum expression was observed at 48 h, P<0.05.Compared with Ang Ⅱ (10-6mol/L) group, the mRNA and protein expressions of sFRP5 in AngⅡ +Telmisartan (10 μmol/L)group were decreased, P<0.05, those expressions were similar in AngⅡ +PD123319 (10 μmol/L) group, P>0.05. Compared with AngⅡ (10-6mo1/L)+sFRP5 (0 ng/ml) group, protein expressions of BNP and TNF-α were decreased in Ang Ⅱ (10-6mo1/L)+sFRP5(10 ng/ml) group and in Ang Ⅱ (10-6mo1/L)+sFRP5 (100 ng/ml) group respectively, P<0.05.
Conclusion: For in vitro process of Ang Ⅱ induced neonatal rat’s cardiomyocyte hypertrophy, using Ang Ⅱ receptor could up-regulate sFRP5 expression and sFRP5 plays an important role in cardiomyocyte hypertrophy.
AngiotensinⅡ; Cardiomyocyte hypertrophy; Adipokine
国家自然科学基金(81570345);国家自然科学基金青年科学基金(81400217)
050000 河北省石家庄市,河北医科大学第二医院 心内科
金鑫 主治医师 博士 主要从事冠心病研究 Email:jinxin99123@163.com 通讯作者:李拥军 Email:lyjbs001@163.com
R541
A
1000-3614(2017)12-1227-05
10.3969/j.issn.1000-3614.2017. 12.020
2016-12-25)
(编辑:曹洪红)
