多发性硬化症及实验性自身免疫性脑脊髓炎免疫疗法的研究进展①
2017-12-20夏玲芝沈传来
夏玲芝 沈传来
(南京金域医学检验所自身免疫性疾病检测中心,南京 210061)
·专题综述·
多发性硬化症及实验性自身免疫性脑脊髓炎免疫疗法的研究进展①
夏玲芝 沈传来②
(南京金域医学检验所自身免疫性疾病检测中心,南京 210061)
多发性硬化症(MS)是一种慢性进行性中枢神经系统(CNS)脱髓鞘的炎症性自身免疫病,主要由自身反应性CD4+T细胞对髓鞘自身抗原发生免疫应答所致,自身反应性CD8+T细胞[1]和B细胞[2]等也参与免疫损伤作用。小鼠、大鼠或豚鼠的实验性自身免疫性脑脊髓炎(EAE)是目前最广泛使用的MS动物模型,与MS有相似的组织病理变化和疾病进程、相同的髓鞘蛋白抗原,如髓鞘碱性蛋白(MBP)、髓鞘蛋白脂蛋白(PLP)、髓鞘少突胶质细胞糖化蛋白(MOG)等,以及很多已被明确的相同或相似的优势T细胞表位。近年来对EAE和MS的免疫疗法研究繁多,本文删繁就简,根据免疫机制不同自行将之归纳为非特异性疗法、“间接”特异性疗法和“直接”特异性疗法等三大类共14种治疗策略进行全面总结和综合述评。
1 非特异性疗法
即没有使用自身抗原,而是使用其他免疫制剂,非特异性地靶向炎症细胞因子、T细胞、B细胞、抗原提呈细胞(APC)或其他固有免疫细胞,抑制机体的整体免疫功能。根据靶向的目标不同可分为如下主要策略。
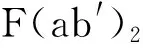
1.2靶向CD4+T细胞 静脉输注anti-CD127,封闭CD4+T细胞膜上的IL-7Ra,从而阻止TH0细胞向TH1分化,抑制后者所介导的细胞免疫反应[9];利用聚乳酸-羟基乙酸纳米颗粒(PLGA-NPs)做载体,里面包裹KN93(钙-钙调蛋白依赖性蛋白激酶-4的小分子抑制剂),表面覆盖脂质层并包被anti-CD4,制备成纳米胶(Nanolipogel),腹腔注射治疗EAE和狼疮样疾病,靶向结合CD4+T细胞并在局部缓释KN93,以旁分泌方式靶向抑制TH0细胞向TH17分化,降低炎症反应的发生[10];经凋亡细胞处理的树突状细胞(DC),具有致耐受性DC(Tolerogenic DC)的特性,静脉输注后可以非特异性地抑制效应性记忆CD4+T细胞(TEM)的发育和分化,阻止EAE发展,但对中枢记忆性CD4+T细胞(TCM)没有影响[11];鼠或人β-防卫素(mBD14,hBD3)是一种抗菌肽,经静脉输注后能非特异性地促使CD4+T细胞向调节性T细胞(Treg)分化,治疗接触性过敏和EAE显示有效[12]。这类策略靶向抑制CD4+T细胞向TH1、TH17或TEM分化,促进其向Treg分化,抑制机体的细胞免疫和炎症反应,属主动免疫抑制疗法,缺点是不具备自身抗原的特异性,必定影响机体针对其他病原体、肿瘤等抗原的CD4+T细胞的特异性免疫应答能力。
1.3靶向抗原提呈细胞 用PLGA-NPs包裹PHCCC(一种小分子谷氨酸受体增强剂),静脉注射后被DC吞噬,改变DC代谢谷氨酸的方式,降低DC的活化和抗原提呈能力,并使其细胞因子的分泌发生偏移,诱导TH0向Treg分化、抑制TH17分化并减少炎症因子的释放,从而推迟EAE进程,减轻症状[13];GABA(γ-氨基丁酸)或γ-乙烯氨基丁酸(抗癫痫药)口服或腹腔注射,抑制抗原提呈细胞(APC)活性,降低IL-6、TNF-α等水平,也能抑制EAE发展[14]; B7分子结合肽(CD80CAP1、B7AP、sF2)[15]或CTLA-4-Ig[16]静脉输注后能非特异性地阻断APC细胞膜上的B7分子与T细胞膜上CD28分子的结合,抑制T细胞活化,用于治疗EAE、类风湿关节炎(RA)和肾移植排斥等。靶向APC疗法主要是一种间接影响CD4+T细胞活化的策略,不但缺少抗原特异性,而且其中不可控因素较多。
1.4靶向B细胞 Anti-CD20(如Rituximab、Ocrelizumab、Automumab等)、Anti-CD19(如MEDI-551)、Anti-BAFF-R(如VAY736)等单抗已被用于MS的临床试验,非特异性地靶向清除和抑制B细胞[2]。其抑制体液免疫反应的能力很强,疗效显著,但非特异性地清除B细胞必然引起整体免疫功能下降。未来应更多考虑病变组织局部的给药治疗和B细胞不同分化阶段的靶向疗法,以降低对整体B细胞库的损伤。
1.5靶向其他固有免疫样细胞 利用硫脂抗原靶向抑制NKT细胞(包括invariant NKT和variant NKT),间接抑制TH1、TH17和细胞毒T细胞(CTL)分化,降低炎性细胞因子水平,同时促进Treg细胞分化增殖及IL-10、TGF-β等调节性细胞因子释放,但具体作用机制不明,在EAE治疗中有很多矛盾的结果报道,可能与使用剂量、模型鼠遗传背景等因素有关[17,18]。但是,a-GalCer(KRN7000)和OCH(a-GalCer anologue)等已广泛用于临床前和临床研究,在抗肿瘤和抗肝炎病毒感染的治疗中有明确的效果[19];利用淀粉纤维如糊精Amylin28-33经腹腔注射治疗EAE,非特异性活化腹腔B1a细胞(CD19hi/CD5+)和巨噬细胞(CD11bhiF4/80+),使其细胞膜上表达抑制性细胞受体如BTLA、IRF4、Siglec G等,同时分泌IL-10等调节性因子[20]。
2 “间接”特异性疗法
使用了髓鞘自身抗原或多肽,但可能的主要机制是被APC摄取、提呈,通过选择性活化途径诱导致耐受性DC等抑制性APC细胞形成,从而间接抑制抗原特异性T细胞(AST)的分化和效应功能。主要策略如下。
2.1可溶性多肽疗法(Peptide immunotherapy,PIT) 如将MBP85-99、PLP139-151和MOG35-55等多肽混合物经真皮注射治疗MS患者显示有效,Treg、IL-10、TGF-β等上升,TH1、TH17、IFN-γ等下降[21,22];更多的髓鞘抗原多肽经静脉、真皮和口服等途径治疗EAE显示有效,但口服方式在MS治疗中不成功[23]。可溶性多肽的作用机制有争议,主要可能经APC摄取和提呈途径影响AST细胞,但也可能部分地直接与AST细胞上的TCR结合,诱导T细胞凋亡、无能或功能抑制等[24];利用改变个别氨基酸的抗原多肽(Altered peptide ligand,APL)可以进一步避免多肽疗法引起的过敏反应[25-27];格拉默(Glatiramer acetate)是目前唯一被FDA批准的治疗MS的多肽药物,是模拟髓鞘蛋白的四个氨基酸无规则聚合物,但只对少数患者有效。抗原性多肽制备容易,但已明确的种类有限,是否与患者高度多态性的HLA等位基因相匹配值得进一步考虑。
2.2可溶性多肽链疗法(Soluble antigen arrays,SAgAs) 如将PLP139-151多肽和LABL(一种ICAM-1分子的抑制性多肽,来自LFA-1分子)偶联到线性结构的透明质酸聚合物(HA)上。LABL能与APC等细胞膜上的黏附因子ICAM-1结合,经皮下或静脉注射后有利于SAgAs靶向于APC,从而被摄取或与APC表面结合,但具体作用机制不明[28];将PLP139-151多肽和能与B7分子结合的CD28或CTLA-4分子模拟多肽(B7AP、CD80-CAP、sF2)偶联到HA上,则可利用这些模拟肽靶向结合APC上的B7分子,从而阻断或封闭APC细胞与T细胞间的B7/CD28信号途径[29]。这种携带多种抗原肽和抑制性信号分子的线性聚合物制备较容易,而且具有将抗原肽靶向提呈给APC并抑制APC活化的双功能,但其疗效往往取决于该可溶性聚合物的物理化学特征。聚合物大小、免疫分子的亲和力、链缠结(Chain entanglement)等因素直接决定免疫反应的走向:免疫原性或免疫耐受性。目前众多探索发现SAgAs 疗法能显著降低EAE的临床评分,推迟发病日期(Day of onset)以及降低发病率;同时显示:T细胞活化的双信号同时同地提呈给T细胞能显著减轻EAE症状,但是不连接在一起的两个信号成分的混合物(如混合多肽或多肽与HA混合物)则不能有效减轻EAE[28,30]。
2.3多肽或抗原共价结合的凋亡细胞疗法(Ag-apoptotic cells) 凋亡细胞经静脉输注后到达脾脏边缘区,经凋亡途径降解后的细胞碎片被边缘区巨噬细胞表面的清道夫受体SRBⅡ识别而后被吞噬。APC摄取这些凋亡细胞成分后通过选择性活化途径形成致耐受性APC而不是致炎症性APC,分泌IL-10、TGF-β,诱导Treg升高,从而间接调节AST细胞,抑制TH细胞向TH1和TH17分化。比如,将格拉默多肽药装载于用丝裂酶素处理的DC或脾细胞,静脉给药治疗EAE,则炎性细胞因子(IL-2、4、6、12、17,IFN-γ,TNF-α)分泌降低,抑制性细胞因子(TGF-β、IL-10)表达升高,T细胞增殖能力减弱[31,32];将完整蛋白分子(PLP、MOG、MBP)、混合多肽(PLP139-151、PLP178-191、MBP84-104、MOG92-106)或脊髓组织匀浆等脉冲处理经ECDI(Ethylenecar-bodiimide)固定后的脾细胞,ECDI可致细胞凋亡,静脉给药,已进行MS的临床Ⅱ期治疗研究。这种抗原结合的脾细胞可能直接将抗原肽提呈给T细胞,但由于没有共刺激分子的作用,将诱导AST细胞无能;或者通过间接提呈方式,即负载有抗原的凋亡脾细胞碎片被体内APC细胞摄取,诱导致耐受性DC的形成,从而介导T细胞耐受而不是介导免疫应答反应。但是,这种负载抗原的凋亡细胞经腹腔、皮下和口服等途径治疗MS或EAE则显示无效[33-35];新近,有人用双功能交联剂SMCC代替ECDI,将MOG35-55分别偶联到凋亡的和活的脾细胞上,然后经静脉注射治疗EAE。结果显示,在主动EAE、被动EAE、再刺激EAE(re-challenged)模型中以及在EAE的防护性和治疗性研究中,脊髓组织局部炎性细胞浸润减少、脱髓鞘和轴突丢失现象减轻、CD4+T细胞的体外增殖能力减弱、Treg升高、IFN-γ和IL-17减少等。但是这两种脾细胞形式得到了相似的治疗效果,即抗原负载凋亡脾细胞与抗原负载活脾细胞的疗效没有显著区别,提示不一定需要凋亡细胞才能在血中被APC吞噬而诱导自身免疫抑制或耐受,具体作用机制有待进一步研究[36]。
2.4多肽修饰或包裹的仿生纳米颗粒疗法(Antigen-decorated or encapsulated nanoparticles,Ag-NPs) 利用直径400~500 nm的仿生纳米颗粒模拟和代替凋亡细胞,将PLP139-151共价偶联到羧化物聚苯乙烯或聚乳酸-羟基乙酸(PLG)纳米颗粒表面,静脉注射治疗EAE,被脾脏边缘区巨噬细胞膜上MARCO分子识别而被巨噬细胞和DC所吞噬,从而促使巨噬细胞和DC分泌IL-10和TGF-β,并进一步诱导APC表面PD-L1的上调表达;这些致耐受性APC提呈抗原肽给自身抗原特异性T细胞,介导AST细胞克隆清除、无能或流产活化,从而诱导抗原特异性的耐受;同时,IL-10和TGF-β诱导产生的Treg可能起到保持长期耐受的作用。这种被称为致耐受性NPs的体内作用机制尚未完全清楚,但在对EAE模型的预防和治疗研究中可以使发病推迟、临床评分降低、中枢神经系统淋巴细胞、APC和小胶质细胞浸润减少,共培养中分泌INF-γ和IL-17的TH1和TH17细胞降低。该Ag-NPs经静脉输注才能诱导T细胞耐受,腹腔注射只能诱导部分T耐受,皮下注射或口服则基本无效[37,38];将芳香烃受体激动剂ITE和MOG35-55共包被金纳米颗粒,在治疗EAE中诱导致耐受性DC,进而促进Treg产生,抑制EAE的发生和发展[39];将多肽和雷帕霉素共包裹在PLG纳米颗粒里面,静脉或皮下给药治疗EAE或超敏反应,抑制抗原特异性CD4+T和CD8+T细胞的活化,同时诱导抗原特异性的Treg和Breg(调节性B细胞)产生,且可以使B细胞产生针对多种免疫原的、持久性的耐受。这种致耐受性纳米颗粒经静脉注射后聚集于肝、脾,并与巨噬细胞和DC共定位,皮下接种后集中于淋巴结[40]。装载抗原肽的纳米材料被APC吞噬,诱导致耐受性APC的形成,从而间接抑制自身抗原特异性T细胞的活化是这类策略的基本原理,但是否抑制其他抗原特异性T细胞的反应能力需要进一步明确。
2.5重组TCR配体疗法(Recombinant TCR ligand,RTL) 即制备MHCⅡ类分子α1β1功能区与特定抗原肽的单链蛋白,经皮下或静脉给药,治疗MS和EAE。如RTL1000是HLA-DR2-α1β1-hMOG35-55的重组单链蛋白,已用于MS患者的临床Ⅰ期治疗研究[41];RTL551(I-Ab-α1β1-mMOG35-55)[42]、RTL401(I-As-α1β1-mPLP139-151)[43]和RTL200 (ratRT1.B-α1β1-ratMBP69-89)[44]等用于EAE治疗。这类多肽与MHCⅡ类分子复合物的部分结构体的体内作用机制尚未完全明确,主要是通过其β1结构区与单核、巨噬细胞膜上的CD74分子结合,导致其表达下调,阻断移动抑制因子(MIF)与CD74结合,导致局部单核细胞数量减少,诱导M2型单核细胞和少胶质细胞产生,进而抑制下游炎性反应的发生;同时也可能与TCR结合,阻断CD4信号途径,部分抑制T细胞效应[45]。
3 “直接”特异性疗法
即利用MHC分子与自身抗原肽的复合体(pMHC)直接靶向AST细胞,诱导其凋亡、无能或抑制。目前此类研究在MS和EAE中极少见,但在Ⅰ型糖尿病、类风湿关节炎、同种移植和超敏反应模型中已有所报道,主要策略如下。
3.1可溶性pMHC多聚体疗法(pMHC multimers) 制备I-Ag7-Ig与胰岛反应性CD4+T 细胞(BDC2.5)的模拟肽1040-31相嵌合的MHC-Ⅱ类分子二聚体,在体外或NOD鼠体内能有效诱导BDC2.5CD4+T死亡、分泌IL-10的Tr1样细胞增殖,有效预防和抑制Ⅰ型糖尿病(T1D)的发生和发展[46,47];可溶性HLA-DR0401-Ig/GAD65271-285二聚体在体外与T1D患者的外周血单个核细胞(PBMC)共培养中也能诱导分泌IL-10的Tr1样细胞增殖[48];携带毒性物质如皂草素、Ⅰ型核糖体灭活蛋白等的pMHCⅠ类分子的四聚体经静脉输注可以选择性地清除抗原特异性CD8+T细胞[49,50],并在抑制移植排斥和推迟T1D发展中显示效应[51-53]。可溶性pMHC多聚体可直接靶向抗原特异性T细胞,诱导凋亡或杀伤,但是其体内使用剂量可能较大,制备成本较高,而且需要新的保护策略以避免被蛋白酶降解。
3.2pMHC多聚体修饰的仿生纳米颗粒疗法(pMHC-NPs) 将pMHC-Ⅰ类多聚体负载在葡聚糖纳米粒表面(114 nm),静脉输注后可以保护NOD小鼠免于T1D的发生,也可以在新发病的T1D小鼠中治疗胰岛炎症和维持正常的血糖量[54]。主要机制是:pMHC-NPs可以清除高亲和力的自身反应性CD8+T细胞;更能扩增该抗原表位特异性的、低亲和力的、具有记忆表型的自身调节性CD8+T细胞,而后者可以抑制或杀伤携带多种自身抗原的APC,从而抑制多种自身抗原的提呈,最终抑制多克隆自身反应性T细胞的活化,而没有装载自身抗原的APCs不会被自身调节性CD8+T细胞所抑制或杀伤[55,56]。但是,pMHC-NPs是否适合其他的自身免疫病如MS,包被pMHCⅡ类分子的NPs是否可以扩增自身调节性CD4+T细胞,在体内是否易于被吞噬,pMHC的亲和力、包被浓度以及NPs的种类、尺寸和注射剂量是否影响其功能等问题都需要进一步研究[57]。与Ag-NPs主要作用于APC不同,pMHC-NPs主要直接靶向于抗原特异性T细胞,但面临着如何避免被APC吞噬的问题。
3.3杀伤性抗原提呈细胞(KAPCs) 人们通过基因转导技术使递呈有靶抗原的DC[58]、单核细胞[59]、B细胞[60]、成纤维母细胞[61]、造血干细胞[62]或其他细胞系[63]等表达FasL,在体外培养[64]和体内实验中,通过细胞膜上的pMHC分子靶向结合抗原特异性T细胞,同时通过膜上的FasL与活化后T细胞膜上的Fas分子结合诱导T细胞凋亡,在同种移植排斥[61-63,65]、类风湿关节炎[66]及变态反应[67]等的动物模型中都有良好的治疗效果。但是,KAPCs疗法同时也遭到诸多质疑:除了生物安全性和原代DC等细胞的大规模制备困难外,更重要的是FasL在载体细胞膜上的表达水平难以均匀控制。未表达或过低表达FasL的细胞会促进抗原特异性T细胞活化扩增;过高表达FasL又会导致非特异性杀伤;部分杀伤性细胞还能分泌可溶性FasL,诱导自身及其他表达Fas分子的组织细胞发生凋亡;另外还可引起严重的中性粒细胞反应。因此表达FasL的杀伤性抗原递呈细胞成为一种“双刃剑”,在不少的治疗实验中出现矛盾或相反的结果[68,69]。
3.4杀伤性人工抗原提呈细胞(KaAPCs) 以非细胞性仿生材料做载体,标记pMHC多聚体和FasL,制备成杀伤性微米颗粒,靶向结合AST细胞并诱导其凋亡。2008年, Schutz等[70]用anti-Fas和HLA-A2/肽二聚体共同标记细胞大小的磁珠(4.5 μm),替代杀伤性抗原提呈细胞疗法。CMVpp65-杀伤性磁珠或MART127-35-杀伤性磁珠在体外共培养中均可选择性地诱导85%~87%的特异性CTL细胞株凋亡,而没有标记anti-Fas的对照磁珠只有3%~13%的凋亡率。这种杀伤性磁珠不能活化静止的CTL,只能使已经活化的CTL凋亡。2010 年,Schutz等[71]综合述评了这种靶向杀伤性载体的现状和前景,提出它具有杀伤性细胞所没有的明显优势:可以在GMP条件下标准化和规模化生产,MHC抗原和FasL的包被量可自由控制,质量均一,从而可有效控制毒副作用;没有B7等共刺激分子和黏附分子,不能使静止T细胞形成免疫突触而活化,只能使已经活化的T细胞凋亡,适合在自身免疫病、移植排斥和超敏反应等患者体内对过度活化T细胞进行清除;不能加工递呈其他抗原而引起非病原性T细胞的损伤;不能分泌可溶性FasL而引起自分泌和旁分泌杀伤,也不易被受者的CTL识别为靶细胞而被攻击等。2011年,本文作者将H-2Kb单体和anti-Fas负载至4.5 μm胶乳微球表面,经静脉输注治疗小鼠皮肤移植排斥,证实KaAPCs在体内能选择性使脾细胞中H-2Kb同种反应性T细胞频率下降60%;皮肤移植物存活期延长6 d;移植物局部的炎性细胞、T细胞都显著减少;而整体免疫功能没有明显下降[72]。2015年,用可生物降解、无毒性的聚乳酸-羟基乙酸(PLGA)微球代替胶乳微球,得到相似的疗效[73]。2016年,将H-2Kb-Ig/OVA257-264二聚体和anti-Fas偶联于4.5 μm PLGA微球表面,在体外和OT-1 TCR转基因鼠体内系统研究了KaAPCs靶向杀伤OVA257-264特异性CD8+T细胞的能力和机制;经尾静脉输注后,48 h时PBMC中OVA257-264特异性CD8+T细胞减少90%以上,杀伤效应维持4 d;体内滞留时间48 h;利用H-2Kb-Ig二聚体和anti-Fas共负载PLGA微球,在单个MHC基因位点错配的皮肤移植鼠内(C57BL/6和bm1供受对),三次静脉注射导致皮肤移植物成活期延长41.5 d[74]。这些同种移植排斥的体内实验结果提示了KaAPCs疗法在自身免疫病,尤其是MS、RA等以T细胞介导为主的自身免疫病中有很好的治疗潜能。
上述三大类免疫疗法各有优点,也有各自的不足。每一类疗法中的各种治疗策略更是如此。非特异性疗法中免疫制剂的制备相对较容易,大多为细胞因子或抗体,免疫抑制效果明显而且作用范围广。但其主要不足是能抑制机体的整体免疫功能,由此导致机体抗感染能力、抗肿瘤能力减弱等副作用。“间接”特异性疗法虽然使用了髓鞘自身抗原或其多肽,但并非直接靶向于自身反应性T细胞,而是被APC摄取,通过选择性活化途径诱导致耐受性APC形成,分泌IL-10、TGF-β,诱导Treg产生,间接抑制TH1和TH17产生等。其主要不足有:在体内诱导致耐受性APC存在不确定性,牵涉多种因素如APC的种类、组织特异性和表面受体、免疫制剂大小和抗原量等,不精确的靶向(如靶向浆细胞样DCs的NPs[75],皮下接种的NPs[38,40])反而会增强免疫应答,加重疾病;另外此类EAE研究极少涉及自身反应性CD8+T细胞的免疫调节。“直接”特异性疗法目前尚极少见于MS和EAE的治疗研究。在同种移植排斥中,供受者间MHC的差异能够明确鉴定,因此移植抗原较为明确, 所以“直接”特异性疗法在治疗同种移植排斥中有优势。但是,在自身免疫病中,大多数自身抗原及其抗原表位尚不清楚,因此pMHC多聚体的制备受限于已知抗原表位肽较少,其靶向杀伤或抑制的自身反应性T细胞克隆数则较少,临床疗效受限。未来的发展方向应考虑整合上述多种免疫疗法,相互取长补短,开拓新型的更有效的综合免疫治疗策略。
[1] Mars LT,Saikali P,Liblau RS,etal.Contribution of CD8 T lymphocytes to the immuno-pathogenesis of multiple sclerosis and its animal models[J].Biochim Biophys Acta,2011,1812(2):151-161.
[2] Agahozo MC,Peferoen L,Baker D,etal.CD20 therapies in multiple sclerosis and experimental autoimmune encephalomyelitis-Targeting T or B cells?[J].Mult Scler Relat Disord,2016,9:110-117.
[3] Brod SA.Ingested(oral)anti-IL-12/23 inhibits EAE[J].J Neurol Sci,2016,361:19-25.
[4] Yeilding N,Szapary P,Brodmerkel C,etal.Development of the IL-12/23 antagonist ustekinumab in psoriasis:past,present,and future perspectives --an update[J].Ann N Y Acad Sci,2012,1263:1-12.
[5] Ritchlin C,Rahman P,Kavanaugh A,etal.Efficacy and safety of the anti-IL-12/23 p40 monoclonal antibody,ustekinumab,in patients with active psoriatic arthritis despite conventional non-biological and biological anti-tumour necrosis factor therapy:6-month and 1-year results of the phase 3,multicentre,double-blind,placebo-controlled,randomised psummit 2 trial[J].Ann Rheum Dis,2014,73:990-999.
[6] Lunemann JD,Nimmerjahn F,Dalakas MC.Intravenous immunoglobulin in neurology --mode of action and clinical efficacy[J].Nat Rev Neurol,2015,11(2):80-89.
[7] Quast I,Keller CW,Weber P,etal.Protection from experimental autoimmune encephalomyelitis by polyclonal IgG requires adjuvant-induced inflammation[J].J Neuroinflammation,2016,13:42.
[8] Lünemann JD,Quast I,Dalakas MC.Efficacy of intravenous immunoglobulin in neurological diseases[J].Neurotherapeutics,2016,13(1):34-46.
[9] Ashbaugh JJ,Brambilla R,Karmally SA,etal.IL7Ra contributes to experimental autoimmune encephalomyelitis through altered T cell responses and nonhematopoietic cell lineages[J].J Immunol,2013,190(9):4525-4534.
[10] Otomo K,Koga T,Mizui M,etal.Cutting edge:nanogel-based delivery of an inhibitor of CaMK4 to CD4+T cells suppresses experimental autoimmune encephalomyelitis and lupus-like disease in mice[J].J Immunol,2015,195(12):5533-5537.
[11] Zhou F,Zhang GX,Rostami A.Apoptotic cell-treated dendritic cells induce immune tolerance by specifically inhibiting development of CD4+effector memory T cells[J].Immunol Res,2016,64(1):73-81.
[12] Bruhs A,Schwarz T,Schwarz A.Prevention and mitigation of experimental autoimmune encephalomyelitis by murine β-defensins via induction of regulatory T cells[J].J Invest Dermatol,2016,136(1):173-181.
[13] Gammon JM,Tostanoski LH,Adapa AR,etal.Controlled delivery of ametabolic modulator promotes regulatory T cells and restrains autoimmunity[J].J Control Release,2015,210:169-178.
[14] Prud′homme GJ,Glinka Y,Wang Q.Immunological GABAergic interactions and therapeutic applications in autoimmune diseases[J].Autoimmun Rev,2015,14(1):1048-1056.
[15] Dudhgaonkar SP,Janardhanam SB,Kodumudi KN,etal.CD80 blockade enhance glucocorticoidinduced leucine zipper expression and suppress experimental autoimmune encephalomyelitis[J].J Immunol,2009,183(11):7505-7513.
[16] Yao S,Zhu Y,Chen L.Advances in targeting cell surface signalling molecules for immune modulation[J].Nat Rev Drug Discov,2013,12(2):130-146.
[17] Van Kaer L,Wu L,Parekh W.Natural killer T cells in multiple sclerosis and its animal model,experimental autoimmune encephalomyelitis[J].Immunology,2015,146(1):1-10.
[18] Maricic I,Halder R,Bischof F,etal.Dendritic cells and anergic type I NKT cells play a crucial role in sulfatide-mediated immune regulation in experimental autoimmune encephalomyelitis[J].J Immunol,2014,193(3):1035-1046.
[19] Van Kaer L,Parekh W,Wu L.Invariant NK T cells:potential for immunotherapeutic targeting with glycolipid antigens[J].Immunotherapy,2011,3(1):59-75.
[20] Kurnellasa MP,Bou Ghosnb EE,Schartnerc JM,etal.Amyloid fibrils activate B-1a lymphocytes to ameliorate inflammatory brain disease[J].Proc Natl Acad Sci U S A,2015,112(49):15016-15023.
[21] Jurynczyk M,Walczak A,Jurewicz A,etal.Immune regulation of multiple sclerosis by transdermally applied myelin peptides[J].Ann Neurol,2010,68(5):593-601.
[22] Walczak A,Siger M,Ciach A,etal.Transdermal application of myelin peptides in multiple sclerosis treatment[J].JAMA Neurol,2013,70(9):1105-1109.
[23] Szczepanik M,Majewska-Szczepanik M.Transdermal immunot-herapy:Past,present and future[J].Pharmacol Rep,2016,68(4):773-781.
[24] Anderton SM.Peptide immunotherapy in experimental autoimmune encephalomyelitis[J].Biomed J,2015,38(3):206-214.
[25] Wegmann KW,Archie Bouwer HG,Whitham RH,etal.Eluding anaphylaxis allows peptide-specific prevention of the relapsing stage of experimental autoimmune encephalomyelitis[J].J Neuroimmunol,2014,274(1-2):46-52.
[26] Deraos G,Rodi M,Kalbacher H,etal.Properties of myelin altered peptide ligand cyclo(87-99)(Ala91,Ala96)MBP87-99 render it a promising drug lead for immunotherapy of multiple sclerosis[J].Eur J Med Chem,2015,101:13-23.
[27] Perera CJ,Lees JG,Duffy SS,etal.Effects of active immunisation with myelin basic protein and myelin-derived altered peptide ligand on pain hypersensitivity and neuroinflammation[J].J Neuroimmunol,2015,286:59-70.
[28] Hartwell BL,Hall AS,Swafford D,etal.Molecular dynamics of multivalent soluble antigen arrays support a two-signal co-delivery mechanism in the treatment of experimental autoimmune encephalomyelitis[J].Mol Pharm,2016,13(2):330-343.
[29] Northrup L,Sestak JO,Sullivan BP,etal.Co-delivery of autoantigen and B7 pathway modulators suppresses experimental autoimmune encephalomyelitis[J].AAPS J,2014,16(6):1204-1213.
[30] Sestak JO,Sullivan BP,Thati S,etal.Codelivery of antigen and an immune cell adhesion inhibitor is necessary for efficacy of soluble antigen arrays in experimental autoimmune encephalomyelitis[J].Mol Ther Methods Clin Dev,2014,1:14008.
[31] Van Brussel I,Lee WP,Rombouts M,etal.Tolerogenic dendritic cell vaccines to treat autoimmune diseases:can the unattainable dream turn into reality?[J].Autoimmun Rev,2014,13(2):138-150.
[32] Kleist C,Mohr E,Gaikwad S,etal.Autoantigen-specific immunosuppression with tolerogenic peripheral blood cells prevents relapses in a mouse model of relapsing-remitting multiple sclerosis[J].J Transl Med,2016,14:99.
[33] Smith CE,Miller SD.Multi-peptide coupled-cell tolerance ameliorates ongoing relapsing EAE associated with multiple pathogenic autoreactivities[J].J Autoimmun,2006,27(4):218-231.
[34] Turley DM,Miller SD.Peripheral tolerance induction using ethylenecarbodiimide-fixed APCs uses both direct and indirect mechanisms of antigen presentation for prevention of experimental autoimmune encephalomyelitis[J].J Immunol,2007,178(4):2212-2220.
[35] Lutterotti A,Yousef S,Sputtek A,etal.Antigen-specific tolerance by autologous myelin peptide-coupled cells:a phase 1 trial in multiple sclerosis[J].Sci Transl Med,2013,5(188):188ra75.
[36] Zhang L,Guo Y,Xia CQ.Infusion of sulfosuccinimidyl-4-[Nmaleimidomethyl]cyclohexane-1-carboxylate-conjugated MOG35-55-coupled spleen cells effectively prevents and reverses experimental autoimmune encephalomyelitis in mice[J].J Immunol Res,2015,2015:129682.
[37] Getts DR,Martin AJ,McCarthy DP,etal.Microparticles bearing encephalitogenic peptides induce T-cell tolerance and ameliorate experimental autoimmune encephalomyelitis[J].Nat Biotechnol,2012,30(12):1217-1224.
[38] Hunter Z,McCarthy DP,Yap WT,etal.A biodegradable nanoparticle platform for the induction of antigen-specific immune tolerance for treatment of autoimmune disease[J].ACS Nano,2014,8(3):2148-2160.
[39] Yeste A,Nadeau M,Burns EJ,etal.Nanoparticle-mediated codelivery of myelin antigen and a tolerogenic small molecule suppresses experimental autoimmune encephalomyelitis[J].Proc Natl Acad Sci U S A,2012,109(28):11270-11275.
[40] Maldonado RA,LaMothe RA,Ferrari JD,etal.Polymeric synthetic nanoparticles for the induction of antigen-specific immunological tolerance[J].Proc Natl Acad Sci U S A,2015,112(2):E156-165.
[41] Offner H,Sinha S,Burrows GG,etal.RTL therapy for multiple sclerosis:A Phase I clinical study[J].J Neuroimmunol,2011,231(1-2):7-14.
[42] Sinha S,Subramanian S,Proctor TM,etal.A promising therapeutic approach for multiple sclerosis:recombinant T-cell receptor ligands modulate experimental autoimmune encephalomyelitis by reducing interleukin-17 production and inhibiting migration of encephalitogenic cells into the CNS[J].J Neurosci,2007,27(46):12531-12539.
[43] Sinha S,Miller L,Subramanian S,etal.Binding of recombinant T cell receptor ligands(RTL)to antigen presenting cells prevents upregulation of CD11b and inhibits T cell activation and transfer of experimental autoimmune encephalomyelitis[J].J Neuroimmunol,2010,225(1-2):52-61.
[44] Adamus G,Burrows GG,Vandenbark AA,etal.Treatment of autoimmune anterior uveitis with recombinant TCR ligands[J].Invest Ophthalmol Vis Sci,2006,47(6):2555-2561.
[45] Benedek G,Vandenbark AA,Alkayed NJ,etal.Partial MHC class II constructs as novel immunomodulatory therapy for stroke[J].Neurochem Int,2017,107:138-147.
[46] Casares S,Hurtado A,McEvoy RC,etal.Down-regulation of diabetogenic CD4+T cells by a soluble,dimeric peptide-MHC class II chimera[J].Nat Immunol,2002,3(4):383-391.
[47] Masteller EL,Warner MR,Ferlin W,etal.Peptide-MHC class II dimers as therapeutics to modulate antigen-specific T cell responses in autoimmune diabetes[J].J Immunol,2003,171(10):5587-5595.
[48] Preda I,McEvoy RC,Lin M,etal.Soluble,dimeric HLA DR4-peptide chimeras:An approach for detection and immunoregulation of human type-1 diabetes[J].Eur J Immunol,2005,35(9):2762-2775.
[49] Hess PR,Barnes C,Woolard MD,etal.Selective deletion of antigen-specific CD8+T cells by MHC class I tetramers coupled to the type I ribosome-inactivating protein saporin[J].Blood,2007,109(8):3300-3307.
[50] Samanta D,Mukherjee G,Ramagopal UA,etal.Structural and functional characterization of a single-chain peptide-MHC molecule that modulates both naive and activated CD8+T cells[J].Proc Natl Acad Sci U S A,2011,108(33):13682-13687.
[51] Hess SM,Young EF,Miller KR,etal.Deletion of naive T cells recognizing the minor histocompatibility antigen HY with toxin-coupled peptide-MHC class I tetramers inhibits cognate CTL responses and alters immunodominance[J].Transpl Immunol,2013,29(1-4):138-145.
[52] Vincent BG,Young EF,Buntzman AS,etal.Toxin-coupled MHC class I tetramers can specifically ablate autoreactive CD8+T cells and delay diabetes in nonobese diabetic mice[J].J Immunol,2010,184(8):4196-4204.
[53] Gojanovich GS,Murray SL,Buntzman AS,etal.The use of peptide-major-histocompatibility-complex multimers in type 1 diabetes mellitus[J].J Diabetes Sci Technol,2012,6(3):515-524.
[54] Tsai S,Shameli A,Yamanouchi J,etal.Reversal of autoimmunity by boosting memory-like autoregulatory T cells[J].Immunity,2010,32(4):568-580.
[55] Clemente-Casares X,Tsai S,Yang Y,etal.Peptide-MHC-based nanovaccines for the treatment of autoimmunity:a “one size fits all” approach?[J].J Mol Med(Berl),2011,89(8):733-742.
[56] Khadra A,Tsai S,Santamaria P,etal.On how monospecific memory-like autoregulatory CD8+T cells can blunt diabetogenic autoimmunity:a computational approach[J].J Immunol,2010,185(10):5962-5972.
[57] Sugarman J,Tsai S,Santamaria P,etal.Quantifying the importance of pMHC valency,total pMHC dose and frequency on nanoparticle therapeutic efficacy[J].Immunol Cell Biol,2013,91(5):350-359.
[58] Hoves S,Krause SW,Herfarth H,etal.Elimination of activated but not resting primary human CD4+and CD8+T cells by Fas ligand(FasL/CD95L)-expressing killer-dendritic cells[J].Immunobiology,2004,208(5):463-475.
[59] Zhang HG,Su X,Liu D,etal.Induction of specific T cell tolerance by Fas ligand-expressing antigen-presenting cells[J].J Immunol,1999,162(3):1423-1430.
[60] Kosiewicz MM,Krishnan A,Worthington MT,etal.B cells engineered to express Fas ligand suppress pre-sensitized antigen-specific T cell responses in vivo[J].Eur J Immunol,2002,32(6):1679-1687.
[61] Lau HT,Yu M,Fontana A,etal.Prevention of isletallograft rejection with engineered myoblasts expressing FasL in mice[J].Science,1996,273(5271):109-112.
[62] Whartenby KA,Straley EE,Kim H,etal.Transduction of donor hematopoietic stem-progenitor cells with Fas ligand enhanced short-term engraftment in a murine model of allogeneic bone marrow transplantation[J].Blood,2002,100(9):3147-3154.
[63] Strauss G,Osen W,Knape I,etal.Membrane-bound CD95 ligand expressed on human antigen-presenting cells prevents alloantigen-specific T cell response without impairment of viral and third-party T cell immunity[J].Cell Death Differ,2007,14(3):480-488.
[64] Schutz C,Hoves S,Halbritter D,etal.Alloantigen specific deletion of primary human T cells by Fas ligand(CD95L)-transduced monocyte-derived killer-dendritic cells[J].Immunology,2011,133(1):115-122.
[65] Yolcu ES,Askenasy N,Singh NP,etal.Cell membrane modification for rapid display of proteins as a novel means of immunomodulation:FasL-decorated cells prevent islet graft rejection[J].Immunity,2002,17(6):795-808.
[66] Kim SH,Kim S,Oligino TJ,etal.Effective treatment of established mouse collagen-induced arthritis by systemic administration of dendritic cells genetically modified to express FasL[J].Mol Ther,2002,6(5):584-590.
[67] Chuang YH,Suen JL,Chiang BL.Fas ligand-expressing adenovirus-transfected dendritic cells decrease allergen-specific T cells and airway inflammation in a murine model of asthma[J].J Mol Med,2006,84(7):595-603.
[68] Kusuhara M,Matsue H.Limitations of CD95 ligand-transduced killer dendritic cells to prevent graft rejections[J].Exp Dermatol,2005,14(4):273-280.
[69] Askenasy N,Yolcu ES,Yaniv I,etal.Induction of tolerance using Fas ligand:a double-edged immunomodulator[J].Blood,2005,105(4):1396-1404.
[70] Schutz C,Fleck M,Machensen A,etal.Killer-artificial-antigen-presenting-cells(KaAPC):a novel strategy to delete specific T cells[J].Blood,2008,111(7):3546-3552.
[71] Schutz C,Oelke M,Schneck JP,etal.Killer artificial antigen-presenting cells:the synthetic embodiment of a ‘guided missile′[J].Immunotherapy,2010,2(4):539-550.
[72] Shen C,He Y,Cheng K,etal.Killer artificial antigen-presenting cells deplete alloantigen-specific T cells in a murine model of alloskin transplantation[J].Immunol Lett,2011,138(2):144-155.
[73] Wang W,Fang K,Wang X,etal.Antigen-specific killer polylactic-co-glycolic acid(PLGA)microspheres can prolong alloskin graft survival in a murine model[J].Immunol Invest,2015,44(4):385-399.
[74] Wang W,Fang K,Li MC,etal.A biodegradable killer microparticle to selectively deplete antigen-specific T cells in vitro and in vivo[J].Oncotarget,2016,7(11):12176-12190.
[75] Tel J,Sittig SP,Blom RA,etal.Targeting uptake receptors on human plasmacytoid dendritic cells triggers antigen cross-presentation and robust type I IFN secretion[J].J Immunol,2013,191(10):5005-5012.
10.3969/j.issn.1000-484X.2017.12.028
R741.05R744.3
A
1000-484X(2017)12-1881-07
①本文受国家自然科学基金面上项目(81172823,81372448)资助。
②东南大学医学院病原生物学与免疫学系,南京 210009。
夏玲芝(1970年-),女,主管检验师,主要从事免疫学检验技术和基础研究。
及指导教师:沈传来(1968年-),男,博士,教授,博士生导师,主要从事肿瘤、移植排斥和自身免疫病的免疫生物治疗和免疫学新技术方面的研究,E-mail:chuanlaishen@seu.edu.cn 。
[收稿2017-05-18 修回2017-06-20]
(编辑 倪 鹏)