miR-128调控AK2蛋白的表达通过STAT3信号通路对宫颈癌细胞生物学行为的影响①
2017-12-20杨林青孙颖川
杨林青 孙颖川
(许昌学院,许昌 461000)
miR-128调控AK2蛋白的表达通过STAT3信号通路对宫颈癌细胞生物学行为的影响①
杨林青 孙颖川
(许昌学院,许昌 461000)
目的探讨miR-128调控AK2蛋白的表达通过STAT3信号通路对宫颈癌细胞生物学行为的影响其机制。方法qPCR和Western blot检测宫颈癌组织和细胞中AK2和miR-128的表达情况;双荧光素酶实验检测miR-128和AK2之间的相互作用;CCK-8增殖试验检测miR-128对宫颈癌细胞增值能力的影响;裸鼠体内成瘤试验检测miR-128对宫颈癌细胞成瘤能力的影响;Western blot检测miR-128对STAT3信号通路蛋白水平的影响;Western blot检测过表达AK2蛋白逆转miR-128对p-STAT3的抑制水平。结果在宫颈癌组织中AK2表达水平相比正常宫颈组织中高,miR-128在宫颈癌C33a细胞株中表达水平较低;双荧光素酶试验证实miR-128可以直接靶向调控AK2的表达;CCK-8增殖实验表明miR-128可以抑制宫颈癌细胞株的增殖能力;体内成瘤实验表明miR-128的增高可以抑制宫颈癌细胞成瘤能力[体积(3.05±0.35)cm3vs (0.86±0.11)cm3,P=0.031;(3.26±0.39)g vs (0.89±0.15)g,P=0.016];Western blot实验表明miR-128可以抑制p-STAT的激活[(42.12±6.28)% vs (91.25±9.29)%,P<0.05],而AK2的过表达又可以逆转miR-128对p-STAT的抑制作用。结论miR-128靶向调控AK2的表达进而通过STAT3通路的激活调控宫颈癌细胞的生物学行为。
miR-128;宫颈癌;AK2;CCK-8
宫颈癌是女性生殖系统恶性肿瘤中发病率最高的肿瘤之一,仅次于卵巢癌,尽管目前早期检测手段多样,早期发现率有明显的提高,但是总体发病率和术后复发率仍然不佳,仍是对女性的生命健康严重威胁的疾病[1,2]。世界女性健康组织将宫颈癌列为对女性生殖系统威胁最大的恶性肿瘤,晚期转移后预后较差[3]。所以对于宫颈癌的早期预防和诊断需要进一步提高,研究其发病机理及病程进展过程是解决此问题的关键。
微小RNA(miRNA)是一种内源表达的通常长度为18~23个核苷酸的小型非编码RNA,可以通过靶向调控转录基因的非翻译区蛋白表达发挥作用[4]。目前多项研究显示miRNA参与各种细胞功能,包括细胞凋亡、细胞增殖、神经发育和干细胞分化等等,包括肿瘤细胞和正常组织细胞,miRNA被认为是一种新的基因表达调节剂[5]。miR-128在多种肿瘤的发展进程中存在异常表达的现象[6]。例如,在胶质瘤中miR-128明显下调[7]。miR-128的过表达也可以通过靶向E2F3a抑制神经母细胞瘤的增殖和运动能力,并减少其转移能力。
腺苷酸转移激酶(Adenylate kinases 2,AK2)是细胞内对细胞和线粒体能量内稳态的维持起重要作用的酶[8]。此外,它们还可用于调节AMP介导的反应,调节单磷酸化和二磷酸化腺嘌呤核苷酸的浓度,影响细胞增殖行为[9]。在人类细胞中,AK2也可以参与线粒体凋亡进程,抑制细胞的凋亡[10]。 但是AK2对肿瘤细胞的真正调节功能机制仍不清楚。
在本研究中,我们发现miR-128人宫颈癌细胞中表达下调,作为肿瘤抑制因子通过直接靶向AK2调控宫颈癌细胞的生物学行为。此外,过表达miR-128可以抑制细胞增殖和体内成瘤能力。本文对miR-128和AK2在宫颈癌中的联系做出阐释。
1 材料与方法
1.1材料
1.1.1细胞培养和试剂 人宫颈癌细胞株SiHa、HeLa、Caski和C33a均从上海细胞研究所购买。细胞培养条件:在含有10%胎牛血清的1640培养基(FBS)中培养,每500 ml加入100单位青霉素和100 ng链霉素。将所有细胞放在37℃,5%CO2恒温孵箱中。 STAT3和p-STAT3购买于美国Abcam公司。AK2,GAPDH抗体购买于Sigma公司。
1.1.2慢病毒包装和稳定细胞系 miR-128-mimic、miR-128-inhibitor和LV5-AK2慢病毒构建体购自上海吉玛基因生物有限公司。慢病毒用Lentiviral包装包装系统根据制造商的说明书(Thermo Fisher Scientific)。 构建得到相应的稳定细胞株。
1.2方法
1.2.1qRCR试验检测mRNA水平 使用TRIzol试剂(Invitrogen,Carlsbad,CA,USA)分离肺癌细胞的总RNA,并使用miRNA分离试剂盒进一步纯化miRNA部分。通过光谱测定RNA样品的浓度和纯度。使用实时PCR系统进行实时逆转录PCR(q-PCR)。U6管家基因作为对照。使用2-ΔΔCt方法计算肺癌细胞的miRNA相对表达量。实验重复3次。PCR引物如下5′-ACACTCCAGCTGGGTCACAGTGGGTC-3′,5′-TGGTGTCGTGGAGTCGTGGTGTCGTG-3′。
1.2.2双荧光素酶活性测定 为验证miR-128和AK2的相关关系,我们使用双荧光素酶测定,将24孔板中的miR-128或NC细胞与0.4 mg萤火虫荧光素酶报告载体和0.1 mg含有海肾荧光素酶(Promega)的pRL-TK对照载体共转染,使用 siPORTneoFX试剂盒,根据使用方法操作,在转染后48 h制备裂解物。使用双荧光素酶报告基因测定系统(Promega),转染24 h后测定荧光素酶活性。 对于每个转染的萤火虫荧光素酶活性被归一化为海肾荧光素酶活性。实验重复3次。
1.2.3Western免疫印迹 细胞用胰蛋白酶消化,从培养瓶消化刮下,离心,收集上清液作为总细胞蛋白质提取物储存在-80℃。蛋白质通过SDS-PAGE胶分级分离,转移到硝酸纤维素上膜(Whatman,Germany),并进行免疫印迹根据制造商的说明进行分析。使用GAPDH作对蛋白内参对照。实验重复3次。
1.2.4细胞增殖测定 为了确定miR-128对细胞增殖的影响,将C33a细胞接种在6孔板中培养24 h。细胞分别用miR-128和NC组慢病毒处理,并培养24 h。然后将细胞进行胰蛋白酶消化并以2 000个细胞接种每孔96孔板。细胞的增殖是使用Cell Counting Kit-8(CCK-8)试剂盒检测。根据说明书每24 h 1次。试验重复3次。
1.2.5裸鼠肿瘤实验 购买雌性裸鼠(4周龄)来自上海实验动物中心。在无病原体条件饲养。将8只小鼠随机分为两组。皮下注射稳定表达miR-128的C33a细胞进入裸鼠两侧腋下C33a细胞稳定表达等量注射NC组作阴性对照。测量肿瘤每周3次。 6周后处死裸鼠,并测量肿瘤体积及重量。

2 结果
2.1宫颈癌组织和细胞中MiR-128和AK2的表达水平 如图1A所示,AK2在宫颈癌组织中呈现低表达的水平,免疫组化和蛋白水平都显示正常宫颈中AK2的表达高于宫颈癌中。如图1B显示,miR-128的表达水平在不同类型的宫颈癌细胞株中表达量不尽相同,C33a的表达情况最低,选取表达量较低的C33a细胞株进行后续miR-128过表达试验。
2.2双荧光素酶验证miR-128和AK2之间的关系 我们通过TargetScan搜索生物信息学检测AK2是miR-128的直接靶标,通过双荧光素酶试验验证AK2和miR-182在宫颈癌细胞中的相互关系。我们发现miR-128具有和AK2相似的的3′-UTR结合序列(图2A)。将AK2 3′-UTR克隆到miRNA报告载体中。miR-128的过表达荧光素酶活性降低到对照组的70%水平(图2B),表明miR-128抑制AK2的表达水平。我们将miR-128-mimic与AK2共转染到宫颈癌C33a细胞株中。荧光素酶报告基因结果显示(图2B):miR-128-mimic可以明显抑制AK2的荧光素酶活性。表明miR-128能与AK2的3′UTR特异性结合,并可以调控AK2的表达。

图1 AK2和miR-128在宫颈癌细胞株中的表达情况Fig.1 Expression of AK2 and miR-128 expression in cervical cancer cell linesNote: A.AK2;B.miR-128.**.P<0.05.(DAB staining,×40).

图2 验证miR-128与AK2之间的调控关系Fig.2 Verify regulatory relationship between miR-128 and AK2Note: A.Binding site of miR-128 to AK2;B.Double luciferase to detect the relationship between miR-128 and AK2.**.P<0.05.
2.3MiR-128的表达对C33a细胞增殖能力的影响 为了研究miR-128对宫颈癌细胞增殖能力的影响,使用C33a细胞株进行质粒转染以增加miR-128的表达。通过CCK-8实验检测miR-128对C33a细胞增殖情况的影响。如图3所示,miR-128-mimic组的细胞的生长速度比其对照组慢得多(P<0.01),培养96 h后抑制效果显示具有统计学意义,而转染了miR-128-inhibitor过后,C33a细胞的增殖能力相应减少,培养96 h后效果显示具有统计学意义(P<0.01)。综上所述,miR-128的表达后可以明显调控C33a细胞的增殖能力。
2.4miR-128抑制细胞在裸鼠体内肿瘤的生长 裸鼠成瘤实验结果显示,肿瘤生长情况如图所示(图4A):与NC组裸鼠肿瘤大小相比,miR-128-mimic组的肿瘤体积明显减小[体积(3.05±0.35)cm3vs (0.86±0.11)cm3,P=0.031],且随着饲养时间延长,统计学意义更加明显。处死裸鼠后,剥除肿瘤重量对比(图4B):与NC组相比,miR-128-mimic组裸鼠肿瘤重量明显减小[(3.26±0.39)g vs (0.89±0.15) g,P=0.016]。表明过表达miR-128后可以抑制C33a细胞的体外成瘤能力。
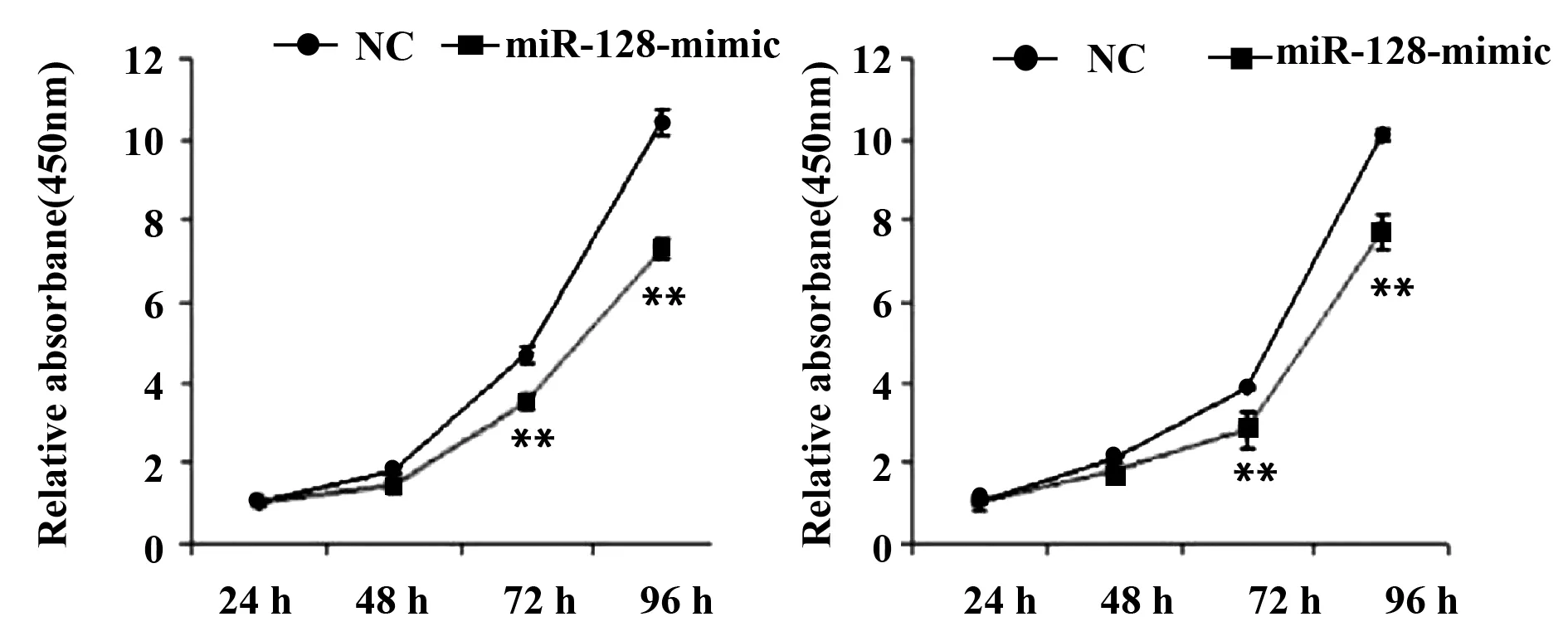
图3 miR-128对宫颈癌细胞株增殖能力的影响Fig.3 Effect of miR-128 on proliferation of cervical cancer cell linesNote: **.P<0.05.

图4 裸鼠成瘤实验检测miR-128在宫颈癌细胞中的作用Fig.4 Role of miR-128 in cervical cancer cells was detected by nude mice tumorigenesisNote: A.Effect of miR-128 on tumorigenesis of cervical cancer cells in nude mice.B,C.nude mice in vivo.**.P<0.05.
2.5miR-128的过表达对STAT3信号通路激活的影响 免疫印迹法检测过表达miR-128后STAT信号通路蛋白的表达变化情况。在miR-128-mimic实验组中P-STAT3的表达情况比NC对照组的明显降低[(42.12±6.28)% vs (91.25±9.29)%,P<0.05],而STAT3蛋白的表达情况在两组之间差异并没有显著统计学意义。结果表明,过表达miR-128后,p-STAT3蛋白表达水平相应下调,表明STAT3通路活性受到抑制,所以,miR-128可能是通过影响STAT3信号通路的磷酸化水平调控C33a细胞的生物学行为。
2.6过表达AK2蛋白水平逆转miR-128对p-STAT3的抑制 如上所述,AK2是miR-128下游的直接靶标。因此,我们想通过增加AK2的表达观察是否以逆转miR-128对下游蛋白通路的抑制情况。LV5-AK2转入miR-128-mimic的宫颈癌细胞。如图6A所示,通过转染LV5-AK2后,miR-128的水平相应升高。 类似地,如图6B所示,而miR-128对p-STAT3蛋白的抑制受到相应的逆转,表明AK2可以一定程度上逆转miR-128对p-STAT3的抑制,间接证明了miR-128是通过靶向AK2抑制p-STAT3的激活。

图5 miR-128对STAT3信号通路蛋白表达水平的影响Fig.5 Effect of miR-128 on expression of STAT3 signaling pathway proteinNote: A.Effect of miR-128 on phosphorylated STAT3 pathway.B.The expression level of P-STAT3 protein.**.P<0.05.##.P<0.01.

图6 AK2对STAT3信号通路蛋白的调控作用Fig.6 Regulation of STAT3 signaling protein by AK2Note: A.Inhibition of miR-128 expression by AK2;B.AK2 reversibility of STAT3 pathway activation.**.P<0.05.##.P<0.01.
3 讨论
宫颈癌是一种常见的女性生殖系统恶性肿瘤,是由多种因素诱导发生的[11]。为了在宫颈癌更早期的时候预测并采取相应的预防处理措施,我们需要更多准确的方法去诊断宫颈癌。 随着目前分子诊断学和生物检测技术的进步,宫颈癌的分子标记物越来越受到关注,并结合相关的临床分期为宫颈癌治疗提供帮助[12]。潜在的分子标记在预测宫颈癌的治疗效果方面有重要作用,观察预后,鉴别治疗风险[13]。
最近有很多证据表明miRNA在肿瘤发生和转移中具有重要作用[14]。鉴定肿瘤相关的miRNAs和他们的直接靶基因对于肿瘤的发展、进展和转移有重要作用[15,16]。我们通过生物信息学方法分析,预测到miR-128在宫颈癌中表达异常,且可以调节在细胞增殖中起重要作用的相关基因,对细胞的分裂、新陈代谢、运动和凋亡行为都具有一定的影响。因此在验证过程中,我们发现miR-128显著促进宫颈细胞的增殖能力,然后探讨其下游相关靶向作用因子。
AK的高表达状态可以促进线粒体ATP的生成,释放相应能量,促进细胞运动能力[17],表明过表达AK2可以为细胞增殖提供足够的能量。有研究表明,在胶质瘤细胞中增加AK2的表达可以明显促进U251细胞的增殖和迁移速率[18]。 Heldt等[19]的研究也表明,细胞体内的AK2的增多可以通过加速循环细胞有丝分裂速度达到迅速扩增的效果。
越来越多的学者对肿瘤自我更新能力的研究感兴趣。有研究表示,miR-128可以作为细胞自我更新行为中的一种调节剂[20],这不仅适用于与正常细胞有关的研究,肿瘤生物的细胞更新也可受此影响。此外,有学者证实,过表达miR-128可以对肿瘤细胞的生长和扩散起到明显的抑制作用[21]。miR-128可以与下游的多个靶标产生作用。例如,表皮生长因子受体是miR-128的相关靶标,在肺癌中表现出相应抑制作用[22]。然而,在宫颈癌中,miR-128和下游靶标的相关关系尚无文献报道,针对miR-128对宫颈癌的诊断和治疗意义也是无证据可追溯,所以我们力图去完善此方向的研究。
STAT3是属于JAK/STAT家族的一类转录活化因子蛋白,当 STAT3发生磷酸化的时候形成二聚体,并转移进细胞核内与染色体上启动子相结合,诱导位于其下游的蛋白的转录激活,从而发挥相应作用[23]。STAT3和 P-STAT3在多种人类恶性肿瘤组织如肺癌、肝细胞癌、乳腺癌中均有明显表达,且持续高水平的 STAT3磷酸化的激活可诱导其下游肿瘤相关基因的表达,从而起到拮抗细胞凋亡、促进细胞增殖、促进新生血管形成及新陈代谢以及抑制抗肿瘤免疫反应发生的作用[24,25]。
miRNA作为转录后基因调控子可以调控多种细胞的生理和病理活动[26]。miRNA的异常表达通常被认为在肿瘤的发生和发展中发挥重要作用。最近很多研究表明,与正常组织相比,miR-128在多种肿瘤组织中表达下调[27]。我们的研究表明miR-128在宫颈癌中的表达下调,结果表明miR-128可能参与宫颈癌的发病起因。为探讨具体的作用方式及是否与下游相关蛋白相互作用,我们使用生物信息学预测miR-128下游的潜在靶标。我们确认AK2是miR-128的作用靶标,而且通过过表达AK2可以抑制miR-128的相关作用。AK2的过表达也可以间接调控STAT3磷酸化的激活,继而影响STAT3信号通路,干扰宫颈癌细胞生物学行为。因此,这项研究不仅有助于揭示miR-128在调节宫颈癌生长中的新机制,而且通过定位AK2,也可以对宫颈癌的靶向诊断和治疗提供支持。
综上所述,本研究表明miR-128在宫颈癌细胞株C33a的侵袭迁移中起重要作用,并对其相关机制做进一步探讨,这些结果为我们提供了miR-128在宫颈癌病理学的作用和机制中新的见解,为宫颈癌治疗提供了潜在的治疗策略。
[1] Ronco G,Dillner J,Elfström KM,etal.Efficacy of HPV-based screening for prevention of invasive cervical cancer:follow-up of four European randomised controlled trials[J].Lancet,2014,383(9916):524-532.
[2] Salmerón J,Lazcano-Ponce E,Lorincz A,etal.Comparison of HPV-based assays with Papanicolaou smears for cervical cancer screening in Morelos State,Mexico[J].Cancer Causes Control,2003,14(6):505-512.
[3] 乔友林,赵宇倩.宫颈癌的流行病学现状和预防[J].中华妇幼临床医学杂志(电子版),2015,11(2):1-6.
[4] Pokhriyal A,Tan Y,Ferreirac P,etal.Sensitive detection of protein and miRNA cancer biomarkers using silicon-based photonic crystals and a resonance coupling laser scanning platform3[J].Lab Chip,2013,13:4053-4064.
[5] Li L,Hu X,Yang Z,etal.Establishing reliable miRNA-cancer association network based on text- mining method[J].Comput Math Methods Med,2014,2014:746979.
[6] Huh WK,Ault KA,Chelmow D,etal.Use of primary high-risk human papillomavirus testing for cervical cancer screening:interim clinical guidance[J].Gynecol Oncol,2015,136(2):178-182.
[7] 车艳红,卢爱妮,廖予妹.miR-143 在宫颈癌组织中表达及临床意义的初步研究[J].医学研究生学报,2014,27(5):510-512.
[8] Six E,Lagresle-Peyrou C,Susini S,etal.AK2 deficiency compromises the mitochondrial energy metabolism required for differentiation of human neutrophil and lymphoid lineages[J].Cell Death Dis,2015,6(8):e1856.
[9] Rissone A,Weinacht KG,la Marca G,etal.Reticular dysgenesis-associated AK2 protects hematopoietic stem and progenitor cell development from oxidative stress[J].J Experimental Med,2015:20141286.
[10] Six E,Lagresle-Peyrou C,Susini S,etal.AK2 deficiency compromises the mitochondrial energy metabolism required for differentiation of human neutrophil and lymphoid lineages[J].Cell Death Disease,2015,6(8):e1856.
[11] Massad LS,Einstein MH,Huh WK,etal.2012 updated consensus guidelines for the management of abnormal cervical cancer screening tests and cancer precursors[J].Obstetrics Gynecol,2013,121(4):829-846.
[12] 应 倩,夏庆民,郑荣寿,等.中国 2009 年宫颈癌发病与死亡分析[J].中国肿瘤,2013,22(8):612-616.
[13] Stevanovic S,Draper LM,Langhan MM,etal.Complete regression of metastatic cervical cancer after treatment with human papillomavirus-targeted tumor-infiltrating T cells[J].J Clin Oncol,2015,33(14):1543-1550.
[14] Palumbo T,Faucz FR,Azevedo M,etal.Functional screen analysis reveals miR-26b and miR-128 as central regulators of pituitary somatomammotrophic tumor growth through activation of the PTEN-AKT pathway[J].Oncogene,2013,32(13):1651-1659.
[15] Hamdorf M,Idica A,Zisoulis DG,etal.miR-128 represses L1 retrotransposition by binding directly to L1 RNA[J].Nat Structural Mol Biol,2015,22(10):824-831.
[16] Fu J,Rodova M,Nanta R,etal.NPV-LDE-225(Erismodegib)inhibits epithelial mesenchymal transition and self-renewal of glioblastoma initiating cells by regulating miR-21,miR-128,and miR-200[J].Neuro Oncol,2013,15(6):691-706.
[17] Tanuma S,Endo H.Mono(ADP-ribosyl)ation of Gi by eukaryotic cysteine-specific mono(ADP-ribosyl)transferase attenuates inhibition of adenylate cyclase by epinephrine[J].Biochimica et Biophysica Acta(BBA) Mol Cell Res,1989,1010(2):246-249.
[18] 袁 璟,汪朝晖,廖玉华,等.抗 L3T4 单抗对线粒体腺苷酸转移酶多肽诱导小鼠心肌病的免疫治疗[J].临床心血管病杂志,2004,3(1):15.
[19] Heldt HW,Schwalbach K.The participation of GTP-AMP-P transferase in substrate level phosphate transfer of rat liver mitochondria[J].Eur J Biochem,1967,1(2):199-206.
[20] Branca M,Ciotti M,Santini D,etal.Activation of the ERK/MAP kinase pathway in cervical intraepithelial neoplasia is related to grade of the lesion but not to high-risk human papillomavirus,virus clearance,or prognosis in cervical cancer[J].Am J Clin Pathol,2015,122(6):902-911.
[21] Papagiannakopoulos T,Friedmann-Morvinski D,Neveu P,etal.Pro-neural miR-128 is a glioma tumor suppressor that targets mitogenic kinases[J].Oncogene,2012,31(15):1884-1895.
[22] Papagiannakopoulos T,Friedmann-Morvinski D,Neveu P,etal.Pro-neural miR-128 is a glioma tumor suppressor that targets mitogenic kinases[J].Oncogene,2012,31(15):1884-1895.
[23] Wang P,Xue Y,Han Y,etal.The STAT3-binding long noncoding RNA lnc-DC controls human dendritic cell differentiation[J].Science,2014,344(6181):310-313.
[24] Siveen KS,Sikka S,Surana R,etal.Targeting the STAT3 signaling pathway in cancer:role of synthetic and natural inhibitors[J].Biochimica et Biophysica Acta(BBA)-Reviews on Cancer,2014,1845(2):136-154.
[25] von Karsa L,Arbyn M,De Vuyst H,etal.European guidelines for quality assurance in cervical cancer screening.Summary of the supplements on HPV screening and vaccination[J].Papillomavirus Res,2015,1:22-31.
[26] Qian PX,Banerjee A,Wu ZS,etal.Loss of SNAIL regulated miR-128-2 on chromosome 3p22.3 targets multiple stem cell factors to promote transformation of mammary epithelial cells[J].Cancer Res,2012,72(22):6036-6050.
[27] Li B,Chen H,Wu N,etal.Deregulation of miR-128 in ovarian cancer promotes cisplatin resistance[J].Int J Gynecological Cancer,2014,24(8):1381-1388.
EffectofmiR-128andAK2onbiologicalbehaviorofcervicalcancercellsbySTAT3signalingpathway
YANGLin-Qing,SUNYing-Chuan.
TheUniversityofXuchang,Xuchang461000,China
Objective:To investigate the mechanism of miR-128 on the expression of AK2 protein through the STAT3 signaling pathway on the biological behavior of cervical cancer cells.MethodsThe expression of AK2 and miR-128 in cervical cancer tissues and cells was detected by qPCR and Western blot.Double luciferase assay was used to detect the interaction between miR-128 and AK2.CCK-8 proliferation assay was used to detect the effect of miR-128 on the enhancement of cervical cancer cells.The effect of miR-128 on the tumorigenesis of cervical cancer cells was exa mined by tumor formation test in nude mice.Western blot was used to detect the effect of miR-128 on STAT3 signal pathway protein level.Western blot was used to detect the inhibitory effect of miR-128 on p-STAT3 by overexpressing AK2 protein.ResultsThe expression level of AK2 in cervical cancer tissues was higher than that in normal cervical tissues,and the expression level of miR-128 in cervical cancer C33a cells was lower.Double luciferase assay confirmed that miR-128 could directly target the expression of AK2.CCK-8 proliferation test showed that miR-128 could inhibit the proliferation of cervical cancer cell lines.In vivo tumorigenesis test showed that the increase of miR-128 could inhibit the tumorigenesis ability of cervical cancer cells[volume(3.05±0.35)cm3vs (0.86±0.11)cm3,P=0.031;weight(3.26±0.39)g vs (0.89±0.15)g,P=0.016];Western blot showed that miR-128 could inhibit the activation of p-STAT[(42.12±6.28)% vs (91.25±9.29)%,P<0.05],while the overexpression of AK2 could reverse the inhibitory effect of miR-128 on p-STAT.ConclusionmiR-128 is used to regulate the expression of AK2 and regulate the biological behavior of cervical cancer cells through the activation of STAT3 pathway.
miR-128;Cervical cancer;AK2;CCK-8
10.3969/j.issn.1000-484X.2017.12.006
R737.33
A
1000-484X(2017)12-1783-06
①本文为河南省医学科技攻关计划项目(201203068)。
杨林青(1983年-),女,实验师,主要从事临床医学方面的研究,E-mail:yllys_89@163.com。
[收稿2017-05-15 修回2017-06-19]
(编辑 许四平 刘格格)