吗替麦考酚酯对肺成纤维细胞的转化及功能影响①
2017-12-20刘玉芝殷松楼殷寒秋
刘玉芝 殷松楼 殷寒秋 王 凯
(徐州医科大学附属医院风湿免疫科,徐州 221002)
吗替麦考酚酯对肺成纤维细胞的转化及功能影响①
刘玉芝 殷松楼 殷寒秋 王 凯
(徐州医科大学附属医院风湿免疫科,徐州 221002)
目的通过吗替麦考酚酯(MMF)对体外培养肺成纤维细胞(LF)转化为肌成纤维细胞(MF)过程的干预,观察MMF对LF转化及CTGF、FN蛋白表达的影响。方法体外培养新生大鼠来源的LF,加入转化生长因子-β1(TGF-β1)诱导转化为MF,分别加入终浓度为0 μmol/L(对照组)、0.1 μmol/L(低浓度组)、1 μmol/L(中浓度组)、10 μmol/L(高浓度组)的MMF进行干预;倒置显微镜下观察LF和MF形态,并用细胞免疫荧光的方法鉴定波形蛋白和α-平滑肌肌动蛋白(α-SMA),分析MMF对LF转化的影响;ELISA方法检测结缔组织生长因子(CTGF)和纤维连接蛋白(FN)的水平。结果LF经TGF-β1诱导96 h后转化成MF,细胞免疫荧光结果显示MMF能够抑制α-SMA 的表达,但对已分化的肌成纤维细胞表型变化无影响;ELISA结果显示与对照组比较,MMF组CTGF和FN分泌水平均显著下降(P<0.05),并呈一定的浓度依赖。结论MMF能够抑制肺成纤维细胞转化和 CTGF、FN表达,提示MMF有抗纤维化作用,影响CTGF和FN表达可能是作用途径之一。
TGF-β1;吗替麦考酚酯;结缔组织生长因子;纤维连接蛋白; 肺成纤维细胞;肌成纤维细胞
间质性肺病(Interstitial lung disease,ILD)是结缔组织病中常见且严重的并发症,预后差、目前治疗方法有限。ILD主要的病理改变是肺泡、肺间质、支气管不同程度的炎症反应及纤维组织增生。早期是以渗出性病变为主的肺泡炎,随后在大量细胞因子的刺激作用下如转化生长因子(Transforming growth factor-β1,TGF-β1)成纤维细胞病理性增殖并转化为肌成纤维细胞(Myofibroblast,MF),后者具有更强的分泌功能致细胞外基质(Extracellular matrix,ECM)异常积聚,导致不可逆性的肺间质纤维化[1]。目前,ILD以糖皮质激素和环磷酰胺联合治疗为主,但部分患者效果欠佳,有时因副作用大不能耐受,给治疗带来困难。吗替麦考酚酯(Mycophenolat mofetil,MMF)是一种较为新型的免疫抑制剂, 有研究表明MMF有抑制肺成纤维细胞(Lung fibroblasts,LF)增殖和抗纤维化作用,但也有争议的报道[2,3]。本研究旨在观察MMF对LF转化及分泌功能影响,探讨MMF抗纤维化作用可能性。
1 材料与方法
1.1材料 新生SD大鼠购自徐州医科大学实验动物中心;L-DMEM培养基购自Hyclone公司;胎牛血清购自杭州四季青生物工程材料有限公司;胰酶,购自碧云天生物技术研究所;TGF-β1重组细胞因子溶解稀释液套装购自联科生物公司;兔抗α-平滑肌肌动蛋白抗体、兔抗波形蛋白抗体购自艾博抗(上海)贸易有限公司;TRITC标记的山羊抗兔IgG和Alexa Fluor488标记的山羊抗兔IgG均购自微科曼得生物工程有限公司;大鼠结缔组织生长因子(Connective tissue growth factor,CTGF)、纤维连接蛋白(Fibronectin,FN)ELISA试剂盒均购自武汉优尔生科技股份有限公司;培养箱购自美国Thermo公司;酶标仪购自美国perkinelmer公司;CKX-3倒置显微镜购自日本奥林巴斯公司;研究级正置荧光显微镜购自日本奥林巴斯公司。
1.2方法
1.2.1大鼠LF的原代培养和传代 将新生SD大鼠置于75%酒精消毒,无菌条件下取肺,PBS反复冲洗后将肺组织剪成1 mm3大小再均匀接种于培养皿中,置于37℃、5%CO2的培养箱4 h,组织块贴壁后加入完全培养基3 ml继续培养,每2~3 d换液,待LF接近铺满皿底时胰酶消化传代,取第4~5代生长良好的LF用于实验。
1.2.2实验分组 转化前(Before-differentiation) 将LF以1×105/孔接种于6孔板中, 24 h后分别加入MMF(0、0.1、1、10 μmol/L)设为对照组、低浓度组、中浓度组、高浓度组,共培养96 h;另取接种在6孔板中的LF加入0、低、中、高浓度MMF,同时分别给予5 μg/L的 TGF-β1共培养96 h,此为转化过程中(During-differentiation);转化后(After-differenti-ation):制备以上相同LF四组,分别给予5 μg/L的 TGF-β1培养96 h后,再分别加入0、低、中、高浓度MMF共培养48 h。达到作用时间后收集各阶段实验组细胞培养液备用。
1.2.3LF和MF形态观察 普通倒置显微镜下观察LF和MF的形态。
1.2.4LF和MF的鉴定及分析MMF对成纤维细胞表型转化的影响 取对数生长期的LF接种于含有小圆玻片的6孔板中,并按照上述转化前、转化中及转化后的方法处理各实验组细胞,分别达到作用时间后,取出圆玻片到12孔板,用PBS洗涤(3 min×3次);甲醇固定30 min后洗涤(3 min×3次);加入500 μl封闭液37℃条件下30 min后洗涤(3 min×3次);加入1∶250稀释兔抗波形蛋白抗体300 μl(加入1∶290稀释兔抗α-SMA抗体300 μl)4℃过夜;复温37℃30 min后洗涤(3 min×3次);加入400 μl 1∶50稀释TRITC标记的山羊抗兔IgG二抗(加入400 μl 1∶150稀释Alexa Fluor488标记的山羊抗兔IgG二抗),室温避光孵育1 h后洗涤(3 min×3次);加入DAPI 3~5 min后洗涤(3 min×3次);取出圆玻片加荧光淬灭剂,立即荧光显微镜下观察拍照,转化中及转化后各实验组每组随机取3张片,应用软件Image-Pro plus 6.0分别计算每组每张片的荧光强度,再计算各实验组平均荧光强度。
1.2.5ELISA方法检测CTGF、FN的水平 对于收集到的各阶段细胞培养上清液,严格按照大鼠CTGF 和FN ELISA试剂盒说明书进行测定,每组3复孔。

2 结果
2.1LF和MF形态 普通倒置显微镜下可见大鼠LF贴壁生长,呈长梭形、条索状,也有少数不规则三角形,胞浆丰富,部分细胞融合成片,部分细胞之间边界清晰。大鼠的肺MF增殖明显,由长梭形或不规则三角形、细胞之间边界清楚的LF转化为扁平状、体积较大且边界不清的MF。MF形态变化明显说明经TGF-β1诱导96 h后,分化显著。
2.2大鼠LF和MF的鉴定 如图1为培养的第三代LF,DAPI表示着染的细胞核,Vimentin表示成纤维细胞特异性标记胞浆波形蛋白染色阳性,Merge为合成后的细胞;图2 LF经TGF-β1诱导96 h转化成的MF,DAPI表示着染的细胞核,α-SMA表示肌成纤维细胞特异性标记α-平滑肌肌动蛋白染色阳性,Merge为合成后的细胞。
2.3MMF对成纤维细胞表型转化的影响
2.3.1MMF对转化中成纤维细胞表型转化的影响 细胞免疫荧光显示MMF对LF表型转化的影响如图3所示,TGF-β1刺激组(对照组)与加入低浓度的MMF组α-SMA荧光信号较强,而中浓度及高浓度MMF组α-SMA荧光信号逐渐减弱;各实验组细胞平均荧光强度分别为TGF-β1刺激组(对照组)(86.35±1.25)、低浓度MMF组(71.96±12.02)、中浓度MMF组(61.85±13.11)、高浓度MMF组(44.04±9.51),与TGF-β1刺激组比较,中高浓度MMF组均可抑制α-SMA表达(分别为P<0.05,P<0.01),见图4。
2.3.2MMF对已分化MF表型的影响 如图5所示,与对照组比较,各浓度MMF组α-SMA荧光信号变化不明显;各组细胞平均荧光强分别为对照组(117.72±13.79)、0.1 μmol/L MMF组(116.73±14.01)、1 μmol/L MMF组(113.96±14.15)、10 μmol/L MMF组(110.62±15.39),各浓度MMF组分别与对照组比较,均不能抑制肌成纤维细胞α-SMA的表达(P>0.05),见图6。
2.4CTGF、FN的表达 ELISA方法定量检测可见,MMF对成纤维细胞分泌CTGF和FN有明显的抑制作用。转化前 MMF可抑制肺成纤维细胞分泌CTGF、FN,与对照组比较差异有统计学意义(P<0.05),中高浓度组更明显(P<0.01);转化中 MMF对转化中成纤维细胞分泌CTGF呈浓度依赖性抑制,而低浓度的MMF就可显著降低FN的表达(P<0.01); 转化后:与对照组比较,各浓度组的MMF对肌成纤维细胞分泌CTGF、FN均无抑制作用(P>0.05),见表1~3。

图1 大鼠LF荧光染色结果(×200)Fig.1 Immunouorescence staining of rat lung fibroblast(×200)

图2 大鼠MF荧光染色结果(×200)Fig.2 Immunouorescence staining of rat myofibroblast(×200)

图3 MMF对 TGF-β1 诱导的LF 表型转化α-SMA 表达的影响(× 200)Fig.3 Effect of MMF on alterations of α-SMA expression in TGF-β1 induced LF (× 200)Note: 1.Control group;2.TGF-β1+0.1 μmol/L MMF;3.TGF-β1+1 μmol/L MMF;4.TGF-β1+10 μmol/L MMF.

图4 转化中各组细胞平均荧光强度的比较 Fig.4 Average fluorescence intensity of each during-differentiation subgroupNote: Compared with TGF-β1 group,*.P<0.05,#.P<0.01.
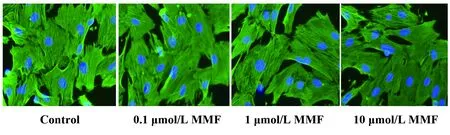
图5 MMF对 MF表型的影响(× 200)Fig.5 Effect of MMF on phenotype of MF(× 200)

图6 转化后各组细胞平均荧光强度的比较Fig.6 Average fluorescence intensity of each after-differentiation subgroupNote: Compared with control,*.P>0.05.


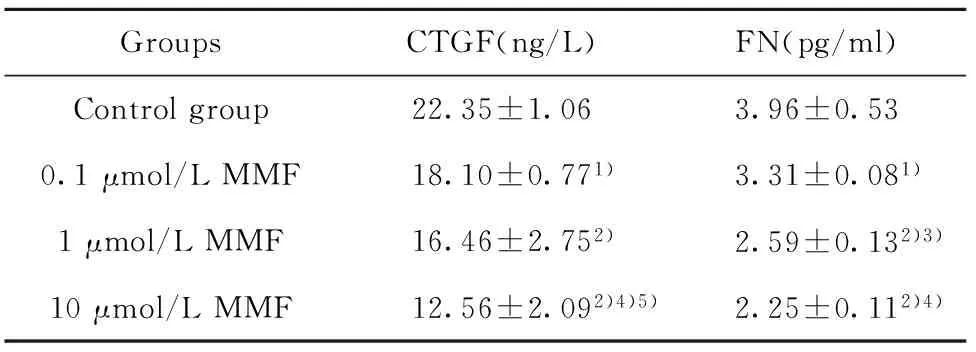
GroupsCTGF(ng/L)FN(pg/ml)Controlgroup22.35±1.063.96±0.530.1μmol/LMMF18.10±0.771)3.31±0.081)1μmol/LMMF16.46±2.752)2.59±0.132)3)10μmol/LMMF12.56±2.092)4)5)2.25±0.112)4)
Note:Compared with control group,1)P<0.05,2)P<0.01;compared with 0.1 μmol/L MMF,3)P<0.05,4)P<0.01;compared with 1 μmol/L MMF,5)P<0.05.
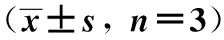

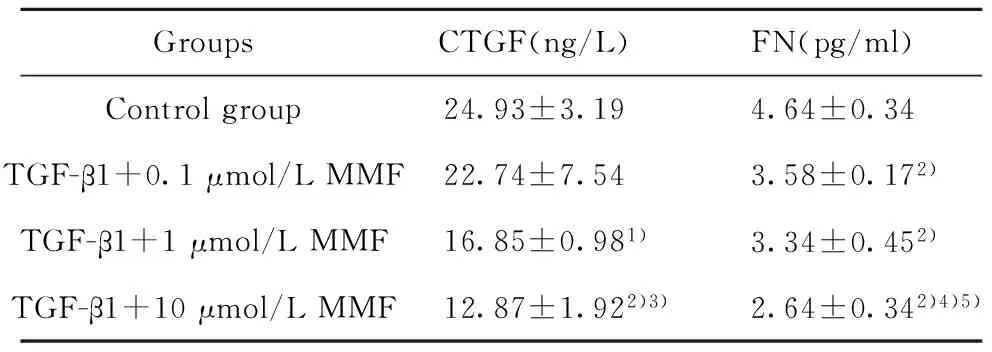
GroupsCTGF(ng/L)FN(pg/ml)Controlgroup24.93±3.194.64±0.34TGF-β1+0.1μmol/LMMF22.74±7.543.58±0.172)TGF-β1+1μmol/LMMF16.85±0.981)3.34±0.452)TGF-β1+10μmol/LMMF12.87±1.922)3)2.64±0.342)4)5)
Note:Compared with control group,1)P<0.05,2)P<0.01;compared with TGF-β1+0.1 μmol/L MMF,3)P<0.05,4)P<0.01;compared with TGF-β1+1 μmol/L MMF,5)P<0.05.



GroupsCTGF(ng/L)FN(pg/ml)Controlgroup26.18±1.065.67±0.770.1μmol/LMMF25.29±0.914.47±0.491μmol/LMMF23.82±4.204.24±1.5510μmol/LMMF23.32±1.294.80±2.13
3 讨论
目前大量研究已经证明成纤维细胞是间质性肺病纤维化中起主要作用的细胞,尤其是肌成纤维细胞的多种功能如迁移、增殖、分泌ECM蛋白和细胞因子等相互作用,共同促进了肺纤维化的发展[4-6]。TGF-β1就是最有效促纤维化因子,可通过TGF-β/Smad信号途径诱导LF转化为MF[7]。肺纤维化中成纤维细胞的反应与ECM重构及组织收缩能力相关联,最终导致肺纤维化,这一动态过程LF与MF都有参与,这两种细胞的相互作用突出了肺纤维化发展的一个重要方面[8]。MF具有更强分泌细胞因子功能,如能抑制MF生成对阻止ILD发展有益。间质性肺病是结缔组织病较为严重的并发症,预后不良,目前治疗方法有限,因此寻求有效安全的治疗手段意义重大。MMF是一种较为新型免疫抑制剂,肝及骨髓毒性作用小,传统应用于移植领域,现也应用于肾脏疾病、结缔组织病和炎症性肠病等疗效显著[9]。近期有学者将其应用于结缔组织病间质性肺病(Connective tissue disease-interstitial lung disease,CTD-ILD)中且效果良好,张光峰等[10]认为MMF在缓解或稳定CTD-ILD患者的肺功能及影像学改变上其总体疗效及生存率与环磷酰胺相当,而且耐受性良好,但作用机制不清楚。
本实验在MMF干预的作用下,体外培养大鼠LF经TGF-β1诱导转化为MF来模拟肺纤维化病理过程,在ILD病理过程中,细胞因子发挥重要作用,本研究结果显示转化后的MF分泌的CTGF和FN明显升高。 FN是ECM的主要成分,过多沉积可导致ECM生成与降解失衡从而促进肺纤维化发展,FN还能诱导肺成纤维细胞向肌成纤维细胞转化,也可能是促使肺纤维化发生发展的重要原因[11]。CTGF 是一种促纤维化细胞因子,作为TGF-β1的下游信号介质协同 TGF-β1促进FN沉积,抑制FN降解。CTGF与FN及二者之间的相互作用可能是促进了ILD发生发展的重要方面。因此,抑制二者的生成与表达,对延缓CTD-ILD进展可能会有积极的作用。
本研究结果显示,中高浓度的MMF可抑LF表型转化,阻断CTGF表达和 FN沉积。但它对MF表型变化无影响,也不能降低MF分泌CTGF和FN,由此提示将MMF应用于ILD早期可能会取得良好的效果,根据研究结果不难解释临床研究结果不一致,可能同选择的病人ILD处于不同阶段有关。Karim等[12]认为MMF通过减少肾间质纤维肌细胞以及Ⅲ型胶原的沉积从而延缓肾硬化的发生。MMF也能抑制由大剂量葡萄糖刺激的小鼠肾小球系膜细胞纤维连接蛋白和氧自由基的生成[13]。因此,MMF可通过抑制CTGF和FN的表达,达到对纤维化干预作用。
肺纤维化机制复杂,治疗困难,特异性阻断成纤维细胞分泌促纤维化蛋白的功能可能有望延缓和改善间质性肺病发展,也需要更多的基础研究和多中心临床研究来探究ILD纤维化发病机制和寻求新的治疗方法。
[1] 高 建,刘 干,李 俊.肺成纤维细胞在肺纤维化进程中的作用[J].中国药理学通报,2010,26(9):1125-1128.
[2] Gross DC,Sasaki TM,Buick MK,etal.Acute respiratory failure and pulmonary fibrosis secondary to administration of mycophenolate mofetil[J].Transplantation,1997,64(11):1607-1609.
[3] Morrissey P,Gohh R,Madras P,etal.Pulmonary fibrosis secondary to ad ministration of mycophenolate mofetil[J].Transplantation,1998,65(10):1607-1609.
[4] Löfdahl A,Müller C,Martina Holst C,etal.5-HT2B receptor antagonists attenuate myofibroblast differentiation and subsequent fibrotic responses in vitro and in vivo[J].Physiol Rep,2016,4(15):1-15.
[5] Darby IA,Zakuan N,Billet F,etal.The myofibroblast,a key cell in normal and pathological tissue repair[J].Cell Mol Life Sci,2016,73(6):1145-1157.
[6] Clarke DL,Carruthers AM,Mustelin T,etal.Matrix regulation of idiopathic pulmonary fibrosis:the role of enzymes.[J].Fibrogenesis Tissue Repair,2013,6(1):1-9.
[7] Lafyatis R.Transforming growth factor β-at the centre of systemic sclerosis[J].Nat Rev Rheumatol,2014,10(12):706-719.
[8] Jie D,Qiang M.Myofibroblasts and lung fibrosis induced by carbon nanotube exposure[J].Part Fibre Toxicol,2016,13(1):1-22.
[9] 梅长林,张维莉.霉酚酸酯在非移植性肾脏疾病中的应用[J].肾脏病与透析肾移植杂志,2002,11(6):539-546.
[10] 张光峰,徐 婷,张红卫,等.吗替麦考酚酯与环磷酰胺治疗结缔组织病相关肺间质病变的随机对照研究[J].中华医学杂志,2015,95(45):3641-3645.
[11] 张晓光,刘新民.纤维连接蛋白能通过ILK和p-smad2诱导肺成纤维细胞向肌成纤维细胞转化[J].现代生物医学进展,2010,10(1):40-42.
[12] 赵绵松,黄 烽.吗替麦考酚酯在风湿性疾病的应用评价与展望[J].中华风湿病学杂志,2004,8(6):367-370.
[13] Zizzo G,De SM,Ferraccioli GF.Mycophenolic acid in rheumatology:mechanisms of action and severe adverse events[J].Reumatismo,2011,62(2):91-100.
Effectsofmycophenolatemofetilontransdifferentiationandfunctionoflungfibroblasts
LIUYu-Zhi,YINSong-Lou,YINHan-Qiu,WANGKai.
DepartmentofRheumatology,AffiliatedHospitalofXuzhouMedicalUniversity,Xuzhou221002,China
Objective:To investigate the effects of mycophenolate mofetil(MMF)on the differentiation and connective tissue growth factor(CTGF)and fibronectin(FN)expression of lung fibroblasts(LF)through interfering the transdifferentiation of LF into MF in vitro.MethodsLF of neonatal rat were cultured in vitro,induced into MF by transforming growth factor-β1(TGF-β1),and treated with different concentrations of MMF,which was 0 μmol/L(control group),0.1 μmol/L(low dose group),1 μmol/L(middle dose group)or 10 μmol/L(high dose group).Morphology of LF and MF were observed by inverted phase contrast microscope,the expressions of vimentin and α-smooth muscle actin (α-SMA)were identified by immunofluorescence staining,and then analyzed the effect of MMF on the transdifferentiation of fibroblasts.ELISA was used to detect the levels of connective tissue growth factor(CTGF)and fibronectin(FN).ResultsLF was induced into MF by TGF-β1 96 hours later.The immune fluorescence performance of α-SMA in the lung fibroblasts revealed MMF could suppress the expression of α-SMA,but had no effect on the phenotype of myofibroblasts.The results of ELISA showed that the levels of CTGF and FN were significantly decreased compar with that of control group and was concentration-dependent(P<0.05).ConclusionMMF can prevent lung fibroblasts from transdifferentiating into myofibroblasts and inhibit the expressions of CTGF and FN,suggesting that MMF has anti-fibrosis effect and one of the mechanisms is by suppressing the expressions of CTGF and FN.
TGF-β1;Mycophenolate mofetil;Connective tissue growth factor;Fibronectin;Lung fibroblast;Myofibroblast
10.3969/j.issn.1000-484X.2017.12.005
R563.1
A
1000-484X(2017)12-1779-05
①本文受徐州市科技项目(KC16SH111)基金资助。
刘玉芝(1989年-),女,硕士,住院医师,主要从事间质性肺病临床与基础研究,E-mail:2652263432@qq.com。
及指导教师:殷松楼(1965年-),男,硕士,主任医师,硕士生导师,主要从事风湿性疾病及其相关间质性肺病临床与基础研究,E-mail:yinsonglou@126.com。
[收稿2017-06-06 修回2017-06-26]
(编辑 许四平 刘格格)