SDF-1/CXCR4在糖尿病肾组织中的表达及其与微血管异常的关系①
2017-12-20陈玉琴张子阳王昌盛余丽梅杨亦彬
陈玉琴 林 丽 张子阳 王昌盛 余丽梅 杨亦彬
(遵义医学院附属医院肾内科, 遵义 563003)
SDF-1/CXCR4在糖尿病肾组织中的表达及其与微血管异常的关系①
陈玉琴 林 丽 张子阳 王昌盛 余丽梅②杨亦彬
(遵义医学院附属医院肾内科, 遵义 563003)
糖尿病肾病(Diabetic nephropathy,DN)是糖尿病最常见的慢性微血管并发症之一,其发病机制尚未完全阐明[1]。近年来强调微血管结构、功能异常以及慢性缺氧在各种慢性肾脏疾病进展中的重要性,尤其是糖尿病肾脏存在异常血管新生这一病理生理现象而倍受关注[2]。研究发现基质细胞衍生因子1(Stromal cell-derived factor1,SDF-1)能与其特异性受体CXCR4结合,参与新生血管形成、炎症反应、调控造血干细胞迁移及归巢、恶性肿瘤的浸润转移及组织修复等多种病理和生理过程[3,4],并在肿瘤、缺血性疾病、糖尿病心肌病变和视网膜病变等疾病中表达增高,但在糖尿病肾脏中是否存在异常表达,与DN微血管病变是否有关联尚罕见报道。
1 材料与方法
1.1实验材料 180~220 g清洁级雄性SD大鼠(第三军医大学野战外科研究所提供);链脲佐菌素(Sigma公司);兔抗大鼠SDF-1、 CXCR4(武汉博士德生物工程有限公司);兔抗大鼠Thrombomodulin-1单克隆抗体(武汉博士德);羊抗大鼠CD133(Santa cruz);乐康全血糖仪(美国罗氏公司);RNA逆转录试剂盒、扩增试剂(大连宝生物工程有限公司);逆转录仪(C1000);荧光定量PCR扩增仪(ICycler iQ)。
1.2实验方法 SD大鼠随机分为正常对照组(NC组)和糖尿病肾病组(DN组),每组设8、12、20、28周共4个观察时点,每个时点6只大鼠。DN组采用腹腔注射STZ(55 mg/kg)造模,NC组换用同等剂量枸橼酸-枸橼酸钠缓冲液一次性腹腔内注射,72 h后测血糖,连续3 d血糖>16.65 mmol/L,尿量>150%,24hUAlb>30 mg为成模标准。成模后均未使用降糖药,留取24 h尿后按上述时点处死各组大鼠,心脏采血,左肾取肾皮质区约200 mg,10%甲醛固定,行病理学检查及免疫组化检测;取相同标本一份快速冻于液氮,行免疫荧光检测;右肾取50~100 mg组织行qRT-PCR。
1.3检测指标
1.3.1血糖、尿蛋白 两组大鼠处死前测血糖,置于代谢笼,自由进食进水,收集24 h尿,计量后立即送检测24 h尿蛋白。
1.3.2肾脏常规病理 肾组织用10%甲醛固定后石蜡包理,病理切片在温水中展平,贴于经多聚赖氨酸处理过的干净载玻片上,90℃烤片2 h后备用。HE染色后光镜下观察肾脏病理结构。
1.3.3肾组织SDF-1、CXCR4免疫组化及CD133、TM-1免疫荧光 取石蜡包埋切片,常规脱蜡水化,3%H2O2封闭内源性过氧化物酶,微波修复抗原,山羊血清封闭游离结合位点,减少非特异染色,滴加SDF-1抗体(1∶100)、CXCR4抗体(1∶100),4℃冰箱过夜,次日分别滴加生物素标记的山羊抗兔IgG,经过DAB显色、苏木素复染、盐酸乙醇分化、中性树胶封固后,显微镜下观察,采用全自动图像分析系统(Image-pro plus 6.0)测量其平均积分光密度(IOD)。液氮冰冻组织用OCT液包埋、切片、固定、山羊血清封闭、室温孵育后,滴加CD133抗体(1∶200)、TM-1 (1:200)抗体,4℃冰箱过夜,次日滴加相应FITC荧光二抗,37℃孵育30 min,PBS液冲洗后荧光显微镜下观察。
1.3.4qRT-PCR检测肾组织SDF-1、CXCR4 mRNA的表达 RNA提取及纯化按说明书及参考文献操作步骤操作。引物由大连宝生物工程有限公司设计合成,SDF-1a上游5′-GAGCTCAAGGTTGGGCAGA-3′,下游5′-TTTGGAGGCAAGCAGAGATCA-3′;CXCR4上游5′-AGCAGGTAGCAGTGACCCTCTGA-3′,下游5′-GAAGCAGGGTTCCTTGTTGGAGT-3′;内参β-actin上游5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游5′-GACTCATCGTACTCCTGCTTGCTG-3′。

2 结果
2.1两组大鼠不同时点血糖,24hUAlb水平的比较 DN组血糖、24hUAlb明显高于NC组(P<0.01),且24hUAlb水平呈进行性增高。见表1。
2.2两组大鼠肾组织常规病理改变 NC组肾小球、小管间质、肾血管未发现明显异常。DN组早期即出现明显肾小球肥大,系膜基质渐进增多,中晚期部分肾小管上皮细胞颗粒和空泡变性,晚期可见部分肾小球缩小。见图1。
2.3两组大鼠肾组织SDF-1、CXCR4蛋白的表达 NC组不同时点可见部分肾小管轻度表达SDF-1 和CXCR4。DN组SDF-1突出表达于肾小管,于12周时小管间质也可见表达;CXCR4突出表达于肾小管间质、肾小管周毛细血管,于20周时肾小管也明显表达。DN组SDF-1、CXCR4蛋白的表达明显强于同时点NC组(P<0.01),峰值均在20周。见表2,图2、3。
2.4两组大鼠肾组织SDF-1、CXCR4 mRNA的表达 DN组SDF-1 mRNA在8周、28周时表达明显高于同时点NC组(P<0.05,P<0.01),但在12周、20周时却与同时点NC组无明显差异(P>0.05);而CXCR4 mRNA的表达较NC组同时点呈下调趋势,但差异无明显统计学意义(P>0.05)。见表2。



GroupsPG(mmol/L)8w12w20w28w24hUAlb(mg/24h)8w12w20w28wNC4.70±0.864.30±0.874.78±0.674.65±0.7011.00±1.7912.00±2.61113.67±3.0813.00±2.61DN26.60±0.581)25.72±0.971)23.17±1.701)2)26.05±1.001)44.33±10.151)57.67±15.241)66.00±14.531)75.50±13.001)2)3)
Note:Compared with NC group,1)P<0.01;compared with 8 w,2)P<0.01;compared with 12 w,3)P<0.05.


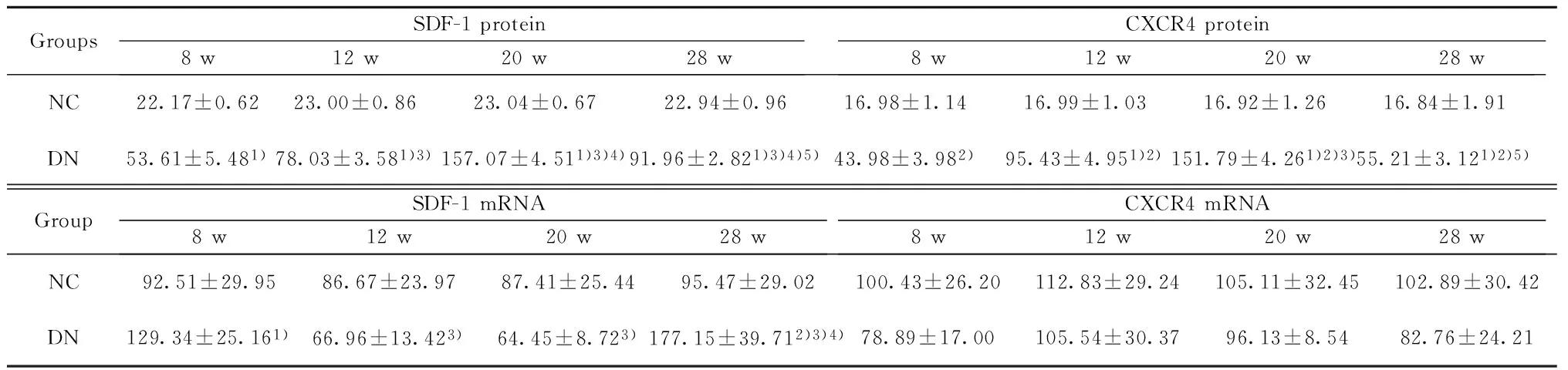
GroupsSDF-1protein8w12w20w28wCXCR4protein8w12w20w28wNC22.17±0.6223.00±0.8623.04±0.6722.94±0.9616.98±1.1416.99±1.0316.92±1.2616.84±1.91DN53.61±5.481)78.03±3.581)3)157.07±4.511)3)4)91.96±2.821)3)4)5)43.98±3.982)95.43±4.951)2)151.79±4.261)2)3)55.21±3.121)2)5)GroupSDF-1mRNA8w12w20w28wCXCR4mRNA8w12w20w28wNC92.51±29.9586.67±23.9787.41±25.4495.47±29.02100.43±26.20112.83±29.24105.11±32.45102.89±30.42DN129.34±25.161)66.96±13.423)64.45±8.723)177.15±39.712)3)4)78.89±17.00105.54±30.3796.13±8.5482.76±24.21
Note:Compared with NC group,1)P<0.05,2)P<0.01;compared with 8 w,3)P<0.01;compared with 12 w,4)P<0.01;compared with 20 w,5)P<0.01.

图1 两组大鼠肾组织HE染色结果(×400)Fig.1 HE staining of rats renal tissue(×400)

图2 两组大鼠肾组织SDF-1免疫组化图(×400)Fig.2 SDF-1 staining in rats renal tissue by immunohistochemistry(×400)



GroupCD133protein8w12w20w28wTM-1protein8w12w20w28wNC3.86±0.093.85±0.113.80±0.043.67±0.1037.46±1.4145.89±0.90155.79±0.9233.23±0.90DN4.68±0.091)4.89±0.051)2)4.99±0.081)2)4)5.05±0.061)2)3)66.09±1.181)72.22±0.991)2)98.18±0.491)2)3)50.99±0.981)2)3)5)
Note:Compared with NC group,1)P<0.01;compared with 8 w,2)p<0.01;compared with 12 w,3)p<0.01,4)p<0.05;compared with 20 w,5)P<0.01.

图3 两组大鼠肾组织CXCR4免疫组化图(×400)Fig.3 CXCR4 staining in rats renal tissue by immunohistochemistry(×400)

图4 两组大鼠肾组织CD133、TM-1免疫荧光图(20周,×200)Fig.4 CD133 and TM-1 staining in rats renal tissue by immunofluorescence(20 w, ×200)
2.5两组大鼠肾组织CD133、TM-1蛋白的表达 CD133主要表达在肾内微小血管内皮层和肾小管,TM-1突出表达在肾小球;DN组CD133、 TM-1表达明显较NC组增强(P<0.01)。见表3,图4。
2.6相关分析 DN组SDF-1、CXCR4与尿蛋白呈正相关(r=0.729,P<0.01;r=0.414,P<0.05);SDF-1表达与CD133、TM-1呈正相关(r=0.777,P<0.01;r=0.735,P<0.01),CXCR4表达与CD133、TM-1呈正相关(r=0.489,P<0.05;r=0.639,P<0.01)。
3 讨论
肾脏微血管病变及慢性缺氧在DN的发生和发展中起重要作用,两者关系密切且可能互为因果[2,5],众多研究表明糖尿病肾脏存在异常血管新生且与肾脏局部促血管生长因子密切相关,故不少学者呼吁重视这一病理生理性改变在糖尿病肾脏微血管病变发生发展中的作用。
SDF-1是骨髓基质类细胞产生的CXC类趋化蛋白,广泛表达于多种细胞和器官组织, CXCR4是其特异受体并主要表达在内皮细胞、单核细胞和淋巴细胞表面。在成人肾脏SDF-1主要表达在肾间质成纤维细胞、足细胞、血管平滑肌细胞和肾小管细胞;CXCR4主要表达在肾小球内皮细胞和肾小管周毛细血管[6]。 SDF-1/CXCR4轴参与一系列的生理过程,如胚胎发育和干细胞的能动性,能刺激内皮细胞表达血管内皮生长因子(Vascular endothelial growth factor,VEGF),并且可以促进内皮祖细胞(Endothelial progenitor cells,EPCs)募集至损伤部位,从而参与新生血管形成[7]。有学者发现SDF-1在结直肠癌中高表达且与CXCR4及VEGF的表达呈显著正相关,为SDF-1调节VEGF表达提供了直接证据[8],但它们在糖尿病肾脏微血管病变以及血管新生中作用尚不清楚。
本实验采用链脲佐菌素诱导1型糖尿病大鼠,并连续多时点观察,结果显示SDF-1和CXCR4蛋白主要表达于肾小管及间质、管周毛细血管,DN组大鼠肾组织各时点SDF-1/CXCR4蛋白表达均高于同时期NC组,峰值均在20周,而SDF-1 mRNA也呈现异常表达,提示糖尿病肾脏存在SDF-1/CXCR4轴异常表达。有学者发现抑制2型糖尿病小鼠肾小球SDF-1表达有助于减轻肾小球硬化、足突细胞丢失和蛋白尿排泄[9]。考虑SDF-1异常表达参与了糖尿病肾脏病变进展,改善其异常表达可缓解糖尿病肾脏病变。SDF-1通过其受体CXCR4诱导多个信号转导通路,其中PI3K/Akt途径的活化可以诱导VEGF的生成、促进细胞黏附和增殖。研究发现,基质金属蛋白酶(MMP-9)是一种可灭活SDF-1的蛋白酶,在高糖环境下,培养重组MMP-9的NRK-52E细胞可显著降低SDF-1诱导的CXCR4及Akt磷酸化;糖尿病大鼠随机接受 CXCR4拮抗剂(AMD3100)干预,使CXCR4无法与SDF-1结合,可导致大鼠尿蛋白排泄增加、VEGF分泌减少、肾小球毛细血管密度减少以及肾小管上皮细胞凋亡增加[10],提示糖尿病大鼠肾脏SDF-1/CXCR4信号转导通路受损,可影响其血管生成并且加快肾损害进程。此外,本实验显示糖尿病大鼠肾脏SDF-1/CXCR4并不是持续高表达,其SDF-1 mRNA表达呈双峰,而CXCR4 mRNA表达并未升高,分析可能与持续高血糖、肾脏众多生长因子、细胞因子异常表达(如TGF-β1、HIF-1)等相关[11]。有研究显示高糖、低氧条件下培养小鼠成纤维细胞和EPCs,发现糖酵解产生的代谢产物可改变HIF-1α的结构,从而使其调控的靶基因SDF-1、CXCR4和VEGF随之减少[12]。
研究表明,脑动静脉畸形(AVM)的血管生成和重构可通过激活SDF-1α/CXCR4通路,进一步募集骨髓来源的EPCs来完成[13]。也有人发现糖尿病小鼠脉络膜新生血管(CNV)严重程度与视网膜色素上皮细胞表达SDF-1及VEGF增多有关[14]。为了观察SDF-1/CXCR4与糖尿病肾脏微血管病变的关系,本实验选用CD133和血栓调节蛋白-1(Thrombomodulin-1,TM-1)两个内皮细胞标志物以及尿蛋白排泄作为观察指标,研究显示蛋白尿是糖尿病肾脏微血管广泛受损的标志物。CD133是造血干细胞和祖细胞表面的独特抗原之一,CD133+的EPCs处于成熟最早阶段,是内皮层修复的早期标志[15];TM-1 主要表达于血管内皮细胞的凝血酶受体,常作为内皮细胞标记分子。本研究发现DN组肾脏各时点CD133、TM-1蛋白表达明显强于同时点正常组,提示糖尿病肾脏微小血管内皮细胞增多,且可能与微小血管内皮细胞增生修复或新生血管生成相关;进一步相关分析显示SDF-1或CXCR4的蛋白表达与尿蛋白排泄、CD133和TM-1表达水平明显相关,提示糖尿病肾脏SDF-1和CXCR4蛋白异常表达与肾脏局部微血管病变相关。
本研究显示SDF-1/CXCR4异常表达参与了糖尿病肾脏微血管病变及肾损害进程,糖尿病肾脏SDF-1/CXCR4异常表达可能是机体器官缺血、缺氧状态下的适应反应,其目的可能是促进血管新生,改善局部缺血、缺氧,但这些新生血管不成熟、功能差、渗漏性高,血中大量物质渗出,促发或加剧周围组织炎症反应、氧化应激、残存的细胞凋亡和胞外基质积聚等,从而形成恶性循环加剧病变进行性发展。因此,糖尿病肾脏血管生成调控因子或许是干预治疗的靶点,并且在靶向治疗过程中,调节SDF-1/CXCR4相互作用,可以为减缓DN的发展提供一种新的策略。
[1] Gnudi L,Coward RJ,Long DA.Diabetic nephropathy:perspective on novel molecular mechanisms[J].Trends Endocrinol Metab,2016,27(11):820-830.
[2] Tanaka T,Nangaku M.Angiogenesis and hypoxia in the kidney[J].Nat Rev Nephrol,2013,9(4):211-222.
[3] Zgraggen S,Huggenberger R,Kerl K,etal.An important role of the SDF-1/CXCR4 axis in chronic skin inflammation[J].PLoS One,2014,9(4):e93665.
[4] Ziegler ME,Hatch MM,Wu N,etal.mTORC2 mediates CXCL12-induced angiogenesis[J].Angiogenesis,2016,19(3):359-371.
[5] Leung WK,Gao L,Siu PM,etal.Diabetic nephropathy and endothelial dysfunction:Current and future therapies,and emerging of vascular imaging for preclinical renal-kinetic study[J].Life Sci,2016,166:121-130.
[6] Chen LH,Advani SL,Thai K,etal.SDF-1/CXCR4 signaling preserves microvascular integrity and renal function in chronic kidney disease[J].PLoS One,2014,9(3):e92227.
[7] Puchert M,Engele J.The peculiarities of the SDF-1/CXCL12 system:in some cells,CXCR4 and CXCR7 sing solos,in others,they sing duets[J].Cell Tissue Res,2014,355(2):239-253.
[8] 张 磊,孙雪竹,孙景洲.SDF-1/CXCR4及VEGF在结直肠腺癌中的表达及其意义[J].中国免疫学杂志,2015,31(5):674-677.
[9] Darisipudi MN,Kulkarni OP,Sayyed SG,etal.Dual blockade of the homeostatic chemokine CXCL12 and the proinflammatory chemokine CCL2 has additive protective effects on diabetic kidney disease[J].Am J Pathol,2011,179(1):116-124.
[10] Siddiqi FS,Chen LH,Advani SL,etal.CXCR4 promotes renal tubular cell survival in male diabetic rats:implications for ligand inactivation in the human kidney[J].Endocrinology,2015,156(3):1121-1132.
[11] Zhang D,Shao S,Shuai H,etal.SDF-1α reduces fibronectin expression in rat mesangial cells induced by TGF-β1 and high glucose through PI3K/Akt pathway[J].Exp Cell Res,2013,319(12):1796-1803.
[12] Ceradini DJ,Yao D,Grogan RH,etal.Decreasing intracellular superoxide corrects defective ischemia-induced new vessel formation in diabetic mice[J].J Biol Chem,2008,283(16):10930-10938.
[13] Wang L,Guo S,Zhang N,etal.The role of SDF-1/CXCR4 in the vasculogenesis andremodeling of cerebral arteriovenous malformation[J].Ther Clin Risk Manag,2015,11:1337-1344.
[14] Cai Y,Li X,Wang YS,etal.Hyperglycemia promotes vasculogenesis in choroidal neovascularization in diabetic mice by stimulating VEGF and SDF-1 expression in retinal pigment epithelial cells[J].Exp Eye Res,2014,123:87-96.
[15] Ishige-Wada M,Kwon SM,Eguchi M,etal.Jagged-1 signaling in the bone marrow microenvironment promotes endothelial progenitor cell expansion and commitment of CD133+human cord blood cells for postnatal vasculogenesis[J].PLoS One,2016,11(11):e0166660.
10.3969/j.issn.1000-484X.2017.12.024
R587.1R692
A
1000-484X(2017)12-1870-04
①本文为国家自然科学基金(81260118)和遵义医学院博士科研启动基金项目[(2006)13]。
②贵州省细胞工程重点实验室,遵义 563003。
陈玉琴(1991年-),女,在读硕士,主要从事糖尿病肾病的研究。
及指导教师:杨亦彬(1962年-),男,博士 教授,主要从事肾衰竭和糖尿病肾病的相关研究,E-mail:yyb1011@sina.com。
[收稿2017-04-19 修回2017-07-17]
(编辑 倪 鹏)