连接SelS基因的携P—选择素单抗靶向微泡结合超声治疗早期糖尿病肾病的实验研究
2017-12-19王艳李静黄瑞珠黄萍黄玉宇
王艳++李静++黄瑞珠++黄萍++黄玉宇
[摘要] 目的 研究連接SelS基因的携P-选择素单抗靶向微泡结合超声治疗早期糖尿病肾病的效果。 方法 选取SPF级60只雄性SD大鼠为研究对象,制备2型糖尿病大鼠模型后随机分为对照组、单纯SelS组(SelS组)、SMBp组、超声+SMBp组(UE+SMBp组),各15只。比较四组大鼠摄食量、摄水量、尿量、体重、空腹血糖、24 h尿蛋白、β2微球蛋白、血尿生化指标及P-选择素、AngⅡ、TGF-β1、SelS水平。 结果 四组大鼠治疗前一般情况比较,差异无统计学意义(P > 0.05);四组治疗后空腹血糖、24 h尿蛋白、β2微球蛋白水平、血尿生化指标及P-选择素、AngⅡ、TGF-β1、SelS水平差异有统计学意义(P < 0.05)。 结论 连接SelS基因的携P-选择素单抗靶向微泡结合超声治疗早期糖尿病肾病效果确切,安全性高,可作为防治早期糖尿病肾病的有效手段。
[关键词] P-选择素;单抗靶向微泡;糖尿病肾病
[中图分类号] R587 [文献标识码] A [文章编号] 1673-7210(2017)11(a)-0015-05
Experimental study of monoclonal antibody targeted microbubble carrying P-selectin and connecting SelS gene in combination with ultrasound in treating early diabetic nephropathy
WANG Yan1 LI Jing2▲ HUANG Ruizhu3 HUANG Ping1 HUANG Yuyu2
1.Department of Geriatric Endocrinology, Guangzhou No.1 People's Hospital, Guangdong Province, Guangzhou 510180, China; 2.Department of Geriatric Nephrology, Guangzhou No.1 People's Hospital, Guangdong Province, Guangzhou 510180, China; 3.Department of Internal Medicine, 458th Hospital of Guangzhou Military Area, Guangdong Province, Guangzhou 510180, China
[Abstract] Objective To study the effect of monoclonal antibody targeted microbubble carrying P-selectin and connecting SelS gene in combination with ultrasound in treating early diabetic nephropathy. Methods A total of 60 specific pathogen free SD male rats were selected as the research objects to build type 2 diabetes rat models. Then the rat models were randomly divided into the control group, SelS group, SMBp group and UE+SMBp group, each group had 15 rats. The food intake, water intake, urine volume, body weight, fasting blood-glucose, 24 h urine protein, β2 microglobulin, blood and urine biochemical indexes, P-selectin, Ang Ⅱ, TGF-β1 and SelS levels of rats in the four groups were compared. Results Before treatment, the differences in general conditions of rats among the four groups were not statistically significant (P > 0.05). The differences in fasting blood-glucose, 24 h urine protein, β2 microglobulin level, blood and urine biochemical indexes, P-selectin, Ang Ⅱ, TGF-β1 and SelS levels were statistically significant after treatment (P < 0.05). Conclusion Monoclonal antibody targeted microbubble carrying P-selectin and connecting SelS gene in combination with ultrasound in treating early diabetic nephropathy has definite therapeutic effect and high safety, thus it can be used as an effective means for prevention and treatment of early diabetic nephropathy.endprint
[Key words] P-selectin; Monoclonal antibody targeted microbubble; Diabetic nephropathy
糖尿病肾病为糖尿病常见且严重程度最高的并发症之一,已经成为一个世界性公共健康问题。近些年来大量临床研究表明免疫、炎性反应在糖尿病肾病发生、发展之中扮演着至关重要的角色,但是仅仅通过控制血糖血脂、阻断肾素-血管紧张素系统并不能够取得理想效果,绝大多数患者依然进展至终末期肾病[1]。随着医学技术的快速发展,靶向超声分子成像技术逐渐引起了医学界的高度关注,该技术通过对普通超声微泡表面予以特殊处理,构成靶向超声微泡以直接作用于病变部位,使得疗效显著提高,与传统治疗方案相比较具有明显优势[2]。鉴于此,本研究围绕连接SelS基因的携P-选择素单抗靶向微泡结合超声治疗早期糖尿病肾病展开,报道如下:
1 材料与方法
1.1 实验动物
选取SPF级雄性SD大鼠60只,尿糖阴性,动物质量合格证号:SCXK(京)2009~0018。所有大鼠周龄均为8周,体重190~210 g,平均(200±10)g。
1.2 试剂及仪器
链脲佐菌素,美国ENZO公司;二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-生物素,美国Avanti Polar Lipids Inc;二棕榈酰磷脂酰胆碱,德国Lipoid;聚乙二醇4000,德国AppliChem公司;普洛沙姆-188,德国巴斯夫集团;抗生蛋白链菌素,美国西格玛奥德里奇公司;生物素化抗大鼠P-选择素单克隆抗体,美国BD公司;GCZZ型基因转染治疗仪,重庆医科大学超声影像研究所;罗康全优越型血糖仪,德国罗氏公司;AU4800全自动生化分析仪,美国贝克曼库尔特公司。
1.3 方法
1.3.1 实验前准备
1.3.1.1 饲养条件 所有实验用SD大鼠均采用笼养,按照每只笼2~3只饲养于实验动物中心的洁净实验室之中,采用独立通气笼具。饲养温度设定在20~24℃,相对湿度保持在60%~70%,每天实验用鼠光照以及黑暗时间各12 h[3]。饲养过程中所使用的笼具、饲料以及垫料均经过高压灭菌处理,试验期间所有的操作均于超净工作台进行[4]。
1.3.1.2 动物饲料 普通饲料:碳水化合物50%、脂肪10%、蛋白质20%,总热量为15.5 kJ/g;高糖高脂饲料:于普通饲料中加入20%蔗糖、10%猪油、2.5%胆固醇,使其成分含有碳水化合物51%、脂肪25%、蛋白质14%,总热量为20 kJ/g[5]。
1.3.1.3 糖尿病肾病大鼠模型制备 将60只实验用大鼠在普通饲养1周时间后改用高糖高脂饲料持续喂养4周,禁食不禁水12 h后向其腹腔内注射小剂量链脲佐菌素30 mg/(kg·d),连续注射2 d后采用25%葡萄糖灌胃处理,每次灌胃剂量为2 mL,以预防模型制备期间出现低血糖反应[6]。在持续灌胃3 d后检测所有实验用大鼠随机血糖,如果其數值均≥16.7 mmol/L亦或是24 h尿量超过模型制备前50%、24 h尿蛋白量>30 mg则表明2型糖尿病肾病模型制备成功[7]。如果检测结果未满足上述条件,可继续以高糖高脂饲料喂养,直至符合条件为止。在所有糖尿病肾病大鼠模型均制备成功后采用随机数字表法分为对照组、SelS组、SMBp组、UE+SMBp组,各15只。
1.3.1.4 超声微泡的制备 将包括二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-生物素、二棕榈酰磷脂酰胆碱、聚乙二醇4000、普洛沙姆-188等在内的脂质材料水溶于75℃蒸馏水中,通全氟丙烷气体,超声振荡至乳白色液体后静置,去除下清液后加入等量的蒸馏水并将未结合的脂质清除,重复4次后加入抗生蛋白链菌素,静置条件下去除下清液2次后制备成为MB微泡[8-9]。向制备好的MB微泡中加入生物素化抗大鼠P-选择素单克隆抗体,静置过夜后去除下清液2次,置于4℃冰箱中待用[10]。将SelS质粒经由感受态大肠埃希菌予以转化、扩增、内毒素质粒提取,通过XhoI内切酶以及EcoRI内切酶实施酶切[11]。选取制备好的MBp微泡3 mL以及浓度为1.5 g/L的SelS基因1 mL在4℃条件下混匀并静置2 h,促使SelS基因充分黏附于MBp微泡外壳,从而制备成为SMBp微泡[12]。
1.3.2 实验方法
经大鼠尾静脉分别注入同等剂量(1.5 mL/100 g)生理盐水(对照组)、SelS微泡(SelS组)、SMBp微泡(SMBp组和UE+SMBp组)。除了UE+SMBp组外,其余三组均利用GCZZ型基因转染治疗仪对大鼠双侧肾组织实施照射,辐照剂量为2 W/cm2,连续脉冲持续时间为3 min。四组均给予30 d治疗,随后观察治疗效果[13]。
1.4 观察指标
包括摄食量、摄水量、尿量、体重;空腹血糖、24 h尿蛋白、β2微球蛋白;血尿生化指标;P-选择素、血管紧张素Ⅱ(AngⅡ)、转化生长因子β1(TGF-β1)、SelS水平。其中,空腹血糖采用罗康全优越型血糖仪进行测定;24 h尿蛋白、β2微球蛋白、血尿生化指标(尿素氮、肌酐、胆固醇、三酰甘油、糖化血红蛋白、血清胱抑素)采用AU4800全自动生化分析仪予以测定;采用ELISA法检测大鼠血清P-选择素、AngⅡ、TGF-β1、SelS水平。
1.5 统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果
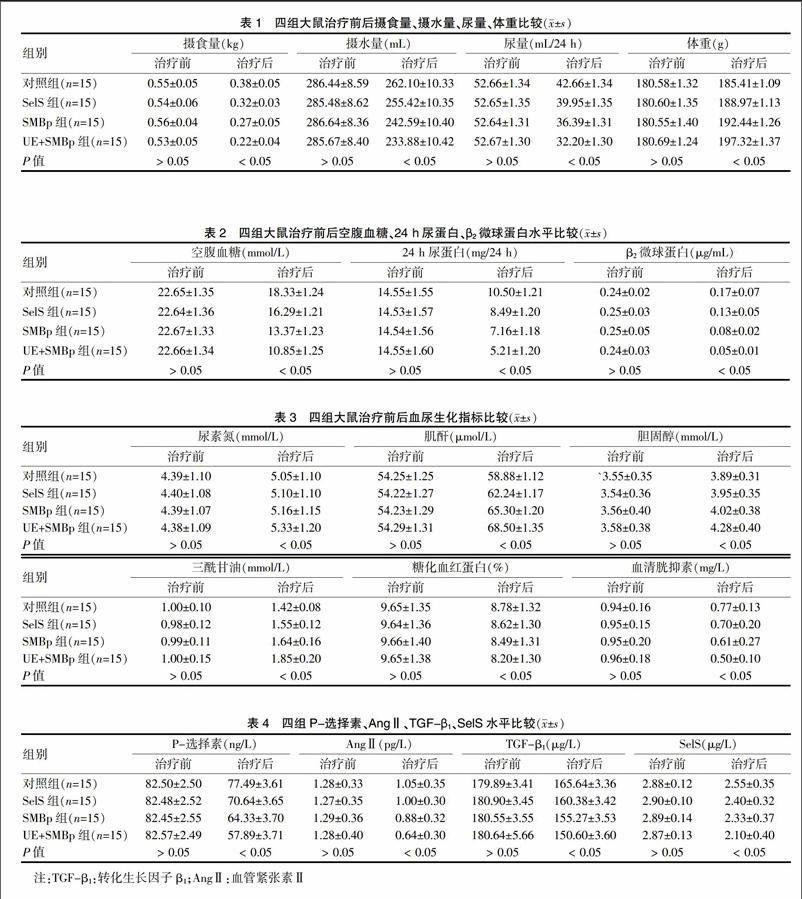
2.1 四组大鼠治疗前后摄食量、摄水量、尿量、体重比较
治疗前四组大鼠各项指标差异无统计学意义(P > 0.05);治疗后在摄食量、摄水量、尿量比较上,对照组>SelS组>SMBp组>UE+SMBp组,在体重比较上,对照组
2.2 四组大鼠治疗前后空腹血糖、24 h尿蛋白、β2微球蛋白比较
治疗前四组大鼠各项指标差异无统计学意义(P > 0.05);治疗后四组空腹血糖、24 h尿蛋白、β2微球蛋白比较,对照组>SelS组>SMBp组>UE+SMBp组,差异有统计学意义(P < 0.05)。见表2。
2.3 四组大鼠治疗前后血尿生化指标比较
四组大鼠治疗前尿素氮、肌酐、胆固醇、三酰甘油、糖化血红蛋白、血清胱抑素比较,差异无统计学意义(P > 0.05);治疗后尿素氮、肌酐、胆固醇、三酰甘油水平,对照组
2.4 四组大鼠治疗前后P-选择素、AngⅡ、TGF-β1、SelS水平比较
治疗前四组大鼠P-选择素、AngⅡ、TGF-β1、SelS水平比较,差异无统计学意义(P > 0.05),治疗后P-选择素、AngⅡ、TGF-β1、SelS水平,对照组>SelS组>SMBp组>UE+SMBp组,差异有统计学意义(P < 0.05)。见表4。
3 讨论
由于糖尿病肾病存在着非常复杂的代谢紊乱问题,一旦病情未能够得到有效控制而发展至终末阶段,则其治疗难度呈几何增长。所以及早诊断、及早有效治疗成为阻断病情持续恶化的关键所在[14-15]。随着医学技术的快速发展,靶向超声分子技术日益成熟,通过对普通的超声微泡进行制备处理,将能够直接作用于病变组织的特异配体与之结合,经由静脉注射后能够充分利用靶向作用来促使特定分子长时间黏附、聚集于病变部位,再辅之以超声检查,形成“主动性靶向超声分子成像”[16]。该手段能够在病症并未产生特异性临床表现之前提示组织或器官受损程度,继而为临床早期干预治疗工作开展提供指导依据,是其他传统检测手段以及影像学技术所无法比拟的。尤其是主动性靶向超声分子技术全程无创无痛,无论是敏感性还是特异性均处于较高水平,糖尿病肾病临床诊治工作中具有着广阔的潜能,日益引起医学界的重视与关注。
国外医学研究表明,超声微泡除了能够为诊断工作提供帮助外,还可以作为基因或者是药物的载体,将各种治疗性药物直接输送至病变部位并采用高能量的超声波将微泡击碎,其所携带的药物分子在靶区定点释放,大幅提高病变部位或组织周围血药浓度,使得治疗药物作用时间更加持久[17]。此外,此种超声靶向击破微泡技术已经在心血管系统的应用中取得了理想的效果,进一步证实了其有效性及实用性[18-19]。然而,时至今日尚未有将其应用在糖尿病肾病治疗工作中的报道,所以对此方面内容加以分析和研究,无疑具有重要的研究價值和现实意义。
本次研究通过动物实验证实,治疗前后大鼠摄食量、摄水量、尿量、体重存在显著差异,具体表现为模型制备后2型糖尿病肾病大鼠“三多一少”特征明显。比较空腹血糖、24 h尿蛋白、β2微球蛋白、尿素氮、肌酐、胆固醇、三酰甘油、糖化血红蛋白、血清胱抑素、P-选择素、AngⅡ、TGF-β1、SelS水平,UE+SMBp组取得的治疗效果优于其他三组,组间差异有统计学意义(P < 0.05)。由上述研究结果表明,超声靶向击破微泡技术在此次动物试验中取得了理想的治疗效果,为糖尿病肾病治疗提供了一种全新的思路和手段,尤其是该治疗方案基因药物在靶向组织处释放过程中具有时间和空间的可控性,充分利用了微泡在超声作用下产生的“声孔效应”,实现了基因药物在多种生物膜之间的跨膜传递,进一步提高了基因药物的治疗效果[20]。提示超声微泡介导基因治疗方案在糖尿病肾病临床治疗工作中具有着无限广阔的应用前景。但是,限制其在临床推广使用的因素仍然较多,其一在于经济因素,由于此种治疗方案运用了多种高尖端技术,使得其治疗成本高昂,无法被绝大多数糖尿病肾病患者承受;其二该治疗方案的有效性仅是通过动物实验证实,尚未进行人体实验,所以尚需要大样本、前瞻性实验研究予以支持。
综上所述,连接SelS基因的携P-选择素单抗靶向微泡结合超声治疗早期糖尿病肾病效果确切,安全性高,可作为防治早期糖尿病肾病的有效手段。
[参考文献]
[1] 苏金坤.超声微泡造影剂与基因转染及临床治疗的研究进展[J].海峡药学,2012,10(1):101-103.
[2] 朱娜,蔡颖娴,房春花,等.温肾解毒祛瘀方对早期糖尿病肾病患者血浆内皮素和P-选择素的影响[J].现代中西医结合杂志,2012,15(11):1146-1147.
[3] 傅永锦,张小牧,潘竞锵,等.川芎嗪对早期糖尿病肾病大鼠上调podocin、nephrin表达及抑制AGEs和P-选择素作用[J].中国新药与临床杂志,2012,14(10):618-623.
[4] Jazi MF,Biglari A,Mazloomzadeh S,et al. Recombinant fibromodulin has therapeutic effects on diabetic nephropathy by down-regulating transforming growth factor-β1 in streptozotocin-induced diabetic rat model [J]. Iran J Basic Med Sci,2016,19(3):265-271.
[5] Wang J,Cui CL,Fu L,et al. Genomic expression profiling and bioinformatics analysis on diabetic nephrology with ginsenoside Rg3 [J]. Mol Med Report,2016,14(2):1162-1172.
[6] Satirapoj BA,Sharon G. Prevalence and Management of Diabetic Nephropathy in Western Countries [J]. Kidney diseases(Basel,Switzerland),2015,1(1):61-70.
[7] Ann S,Rosetta MW,Dario G. Diabetes reversal via gene transfer: building on successes in animal models [J]. Res Rep Endocr Disord,2015,2015(default):15-29.
[8] Ka SM,Ye CX,Huang R,et al. Kidney-targeting Smad7 gene transfer inhibits renal TGF-β/MAD homologue(SMAD)and nuclear factor κB(NF-κB)signalling pathways,and improves diabetic nephropathy in mice [J]. Diabetologia,2012, 55(2):509-519.
[9] 馬建城,王峰,胡阿珍,等.靶向超声微泡MB_(ICAM-1)的制备及靶向实验研究[J].中国超声医学杂志,2016,14(9):840-843.
[10] Yang SM,Ka SM,Wu HL,et al. Thrombomodulin domain 1 ameliorates diabetic nephropathy in mice via anti-NF-κB/NLRP3 inflammasome-mediated inflammation, enhancement of NRF2 antioxidant activity and inhibition of apoptosis [J]. Diabetologia,2014,57(2):424-434.
[11] Ha SK,Ibrahim S. ACE Insertion/Deletion Polymorphism and Diabetic Nephropathy:Clinical Implications of Genetic Information [J]. J Diabetes Res ,2014,201(4):1059-1062.
[12] Flaquer M,Franquesa M,Vidal A,et al. Hepatocyte growth factor gene therapy enhances infiltration of macrophages and may induce kidney repair in db/db mice as a model of diabetes [J]. Diabetologia,2012,55(7):2059-2068.
[13] 郑智唯,赵云,刘朝奇.靶向超声微泡介导miRNA在疾病治疗中的研究[J].实用医学杂志,2017,5(4):654-656.
[14] Howard LP. Contrast ultrasound and targeted microbubbles:diagnostic and therapeutic applications in progressive diabetic nephropathy [J]. Semin Nephrol,2012,32(5):494-504.
[15] Geis NA,Katus HA,Bekeredjian R.Microbubbles as a vehicle for gene and drug delivery:current clinical implications and future perspectives [J]. Curr Pharm Des,2012, 18(15):2166-2183.
[16] Mestry SN,Dhodi,JB,Kumbhar SB,et al. Attenuation of diabetic nephropathy in streptozotocin-induced diabetic rats by Punica granatum Linn. leaves extract [J]. J Tradit Complement Med,2016,7(3):144-150.
[17] 季婷,田晨,王云从,等.L-选择素基因多态性在2型糖尿病肾病家系中的相关性分析[J].甘肃医药,2016,14(5):326-329.
[18] Brooks D,Lindsey SE,Shelton K,et al. High Resolution Ultrasound Superharmonic Perfusion Imaging: In Vivo Feasibility and Quantification of Dynamic Contrast-Enhanced Acoustic Angiography [J]. Ann Biomed Eng,2017, 45(4):939-948.
[19] Keum DH,Mun JH,Hwang BW,et al. Smart Microbubble Eluting Theranostic Stent for Noninvasive Ultrasound Imaging and Prevention of Restenosis [J]. Small,2017,13(10):110-124.
[20] Flaquer M,Franquesa M,Vidal A,et al. Hepatocyte growth factor gene therapy enhances infiltration of macrophages and may induce kidney repair in db/db mice as a model of diabetes [J]. Diabetologia,2012,55(7):2059-2068.
(收稿日期:2017-07-05 本文编辑:程 铭)endprint
