鲮鱼致病性迟钝爱德华氏菌的鉴定及药敏分析
2017-12-18陈言峰卓孝磊郑宗正
陈言峰,卓孝磊,王 超,郑宗正,付 强
( 1.佛山科学技术学院 生命科学与工程学院,广东 佛山 528231; 2. 清远市北江水产科学研究所,广东 清远 511510; 3. 清远市水生动物防疫检验站,广东 清远 511510 )
鲮鱼致病性迟钝爱德华氏菌的鉴定及药敏分析
陈言峰1,卓孝磊2,王 超3,郑宗正1,付 强1
( 1.佛山科学技术学院 生命科学与工程学院,广东 佛山 528231; 2. 清远市北江水产科学研究所,广东 清远 511510; 3. 清远市水生动物防疫检验站,广东 清远 511510 )
自广东省清远市某养殖场患病鲮鱼的肝、肾、脾组织分离到两株优势菌QY15814、QY15815,通过细菌生化鉴定管与16S rDNA序列分析对这两株菌进行鉴定,采用纸片扩散法进行药敏试验,并测定了这两株菌对鲮鱼的半致死剂量。试验结果显示,这两株菌为革兰氏阴性短杆菌,兼性厌氧,有动力,能利用蔗糖、甘露糖、麦芽糖,硝酸盐还原、吲哚、MR试验均为阳性;根据其生理生化特性,鉴定为迟钝爱德华氏菌,通过PCR扩增其16S rDNA基因,经测序及NCBI比对,结果与迟钝爱德华氏菌的同源性高达99%。这两株致病菌对头孢噻肟、头孢吡肟、头孢曲松、头孢西丁、头孢哌酮、头孢呋辛等抗生素高度敏感,对链霉素、克拉霉素、红霉素中度敏感,对阿米卡星、复方新诺明、大观霉素、克林霉素不敏感。这两株菌对鲮鱼具有较强的致病力,半致死剂量分别为1.93×105cfu/g和9.65×104cfu/g。
鲮鱼;迟钝爱德华氏菌;鉴定;药物敏感性
鲮鱼(Cirrhinusmolitorella),俗名土鲮、雪鲮、鲮公、花鲮,属鲤科、野鲮亚科、鲮属,是我国南方地区重要的经济鱼类[1]。该品种具有食性杂、产量高、饲料来源广等特点,且肉质细嫩,味道鲜美[2],深受广大消费者喜爱。目前关于鲮鱼的研究主要涉及其生长特性[3]、形态变异特征[4]、肌肉营养成分[1]、营养需求[5]、生长因子[6]、线粒体基因组序列[7],群体遗传结构[8]与遗传多样性[9-10]等方面。自然条件下,鲮鱼抗病能力较强,但在高密度养殖条件下,一旦养殖水体水质恶化,鲮鱼患病也时有发生,已造成了较大的经济损失[11]。长期以来,引发鲮鱼病害的病原主要以各类寄生虫为主[12-15],而有关鲮鱼细菌性疾病的报道并不多,目前仅方苹等[11]报道过由嗜水气单胞菌(Aeromonashydrophila)与荧光假单胞菌(Pseudomonasfluorescens)混合感染引发鲮鱼的红鳃病、刘礼辉等[16]报道过由无乳链球菌(Streptococcusagalactiae)引发的鲮鱼病害。笔者于2015年8月从广东省清远市某养殖场得到部分患病的鲮鱼,并对病原菌进行了分离鉴定及药物敏感性分析,可为鲮鱼养殖过程中疾病的防治提供参考。
1 材料与方法
1.1 试验材料
病鱼为采自广东省清远市某养殖场所养殖的鲮鱼。症状为体表充血,有部分溃烂的病灶,肛门红肿,解剖发现肝、肾肿大,并有血红色的腹水。健康的鲮鱼取自广东省佛山市某养殖场。
营养琼脂培养基、营养肉汤培养基、SS琼脂培养基、细菌微量生化鉴定管购于广东环凯微生物有限公司,抗生素纸片购于杭州滨和微生物试剂有限公司。Taq聚合酶、dNTP和PCR缓冲液(含Mg2+)购于宝生物工程(大连)有限公司。细菌16S rDNA引物由上海英潍捷基生物技术有限公司合成。
1.2 病原菌的分离纯化
无菌操作从濒死鲮鱼的肝、肾、脾及体表病灶处取样,接种于营养琼脂培养基,37 ℃培养48 h。挑取优势菌落进行纯培养,并接种于营养肉汤培养基,37 ℃培养24 h后,加入无菌甘油,置于冰箱-80 ℃保存备用。
1.3 病原菌的生理生化特征
对已纯化的优势菌(QY15814、QY15815)按常规方法[17]进行革兰氏染色,显微镜下观察。并将细菌接种于营养琼脂培养基、SS琼脂培养基,37 ℃培养48 h,观察其菌落的形态特征。按照细菌微量生化鉴定管的说明书操作并判定该细菌各项生化指标的结果。
1.4 半致死剂量的测定
将分离所得的菌株QY15814接种于营养琼脂培养基37 ℃培养24 h后,用无菌生理盐水将其菌落洗下,依次稀释成密度为1.53×109、1.53×108、1.53×107、1.53×106、1.53×105cfu/mL和1.53×104cfu/mL的菌悬液,并按每尾0.3 mL的剂量,分别将6个密度的菌悬液对6个组(每组10尾,共60尾)的健康鲮鱼[(167±19) g]进行腹腔注射,为6个感染组;对照组的10尾鲮鱼,每尾注射0.3 mL无菌生理盐水。连续观察15 d。试验过程中,每日观察记录受试鱼的发病症状和死亡情况,并对死亡的鱼进行细菌再分离、鉴定,根据改进的寇氏法[18]计算半致死剂量(LD50)。相同的方法用于QY15815对鲮鱼的半致死剂量的测定。
1.5 16S rDNA序列分析
选用细菌16S rDNA通用引物(正向: 5′-AGAGTTTGATCCTGGCTCAG-3′;反向: 5′-TACGGCTACCTTGTTACGACTT-3′),菌落PCR法直接扩增QY15814和QY15815的16S rDNA。50 μL的PCR反应体系包含:新鲜菌液2 μL,上、下游引物(浓度10 mmol/L)各1 μL,dNTP (2.5 mmol/L) 4 μL,10×PCR缓冲液(含Mg2+) 5 μL,Taq聚合酶(5 units/μL) 0.25 μL,ddH2O 36.75 μL。PCR反应条件为:94 ℃预变性5 min 1次;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min 30 s,共进行30个循环。PCR产物经琼脂糖凝胶电泳后,送上海美吉生物医药科技有限公司纯化后测序。测序结果经BLAST分析后,选取相似性高的序列,采用ClustalX 1.83软件进行多重序列比对分析,并通过Mega 4.1软件构建系统发育树。
1.6 抗生素敏感试验
用灭菌棉签将QY15814和QY15815的新鲜菌液均匀涂布于营养琼脂表面,用无菌镊子夹取每种抗生素纸片并贴在上面,37 ℃培养48 h后,测量抑菌圈直径的大小。根据美国临床实验室标准化研究所(CLSI)抗菌药物敏感性试验执行标准(CLSI-M100-S18)[19],判定该菌对34种抗生素的敏感程度。
2 结 果
2.1 病原菌的形态特征
分离得到的QY15814和QY15815为革兰氏阴性短杆菌,在营养肉汤里培养时菌液呈均匀浑浊,接种到营养琼脂培养基上37 ℃培养48 h,形成圆形、凸起、灰白色、有光泽的菌落,直径1.0~2.0 mm。该菌在SS琼脂培养基上生长,其菌落中央有黑色小点。
2.2 病原菌的生化特征
除QY15814、QY15815蔗糖为阳性、QY15815 L-阿拉伯糖为阳性外,其他指标与迟钝爱德华氏菌(Edwardsiellatarda)一致(表1)。根据《常见细菌系统鉴定手册》[17],鉴定菌株QY15814、QY15815为迟钝爱德华氏菌。
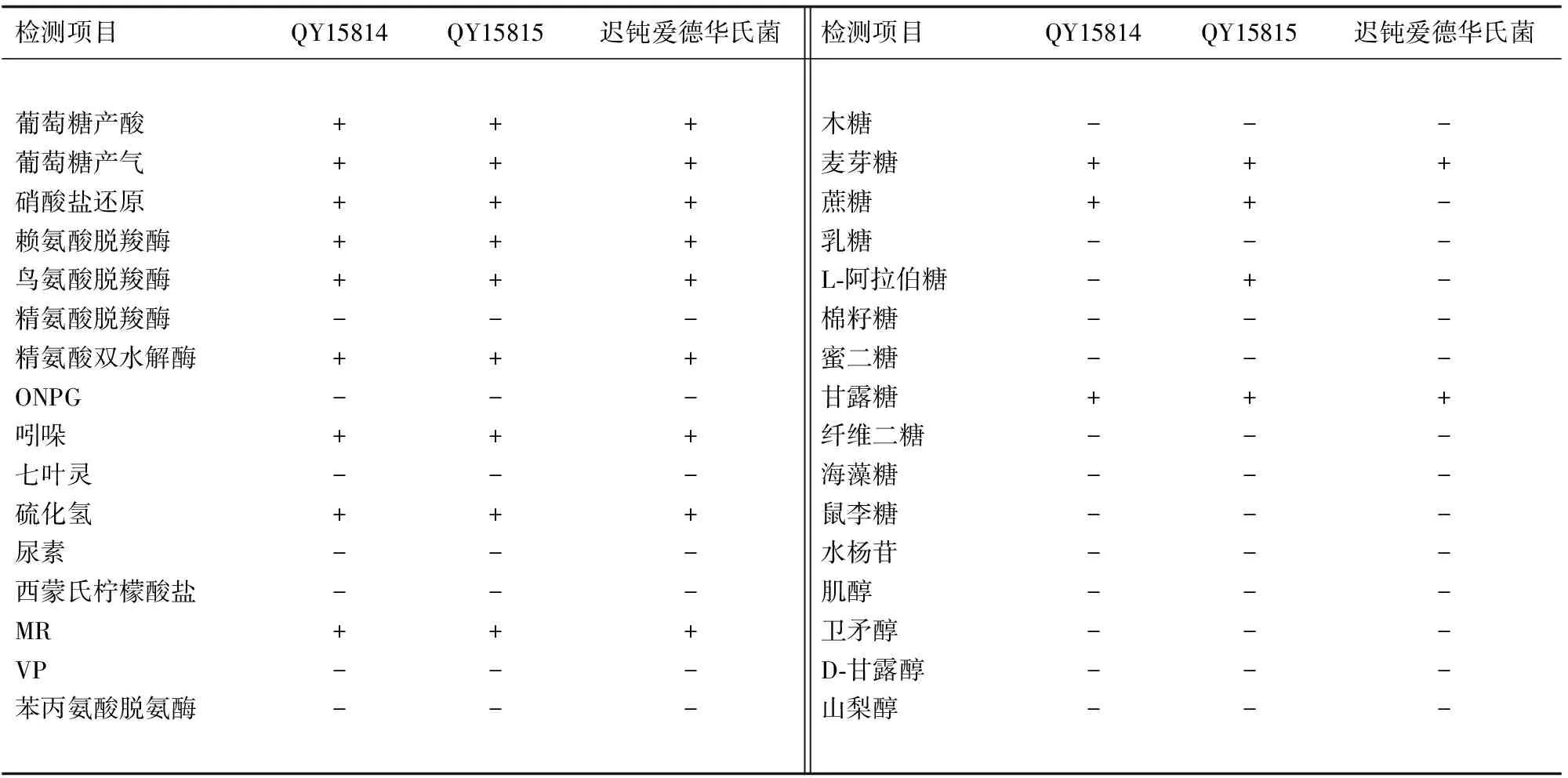
表1 分离菌的生化特征
注:“+”表示阳性反应,“-”表示阴性反应.
2.3 半致死剂量的测定
人工感染后,发病鲮鱼的主要症状与自然发病鲮鱼的症状相似,从感染后濒死鱼的肝、肾等处均能分离到与原致病菌形态、特征一致的菌株。对照组的鱼无发病症状和死亡现象。计算得到菌株QY15814和QY15815对鲮鱼的半致死剂量分别为1.93×105cfu/g和9.65×104cfu/g (表2)。
2.4 16S rDNA序列分析及发育树的构建
将测序得到的菌株QY15814和QY15815的16S rDNA的序列 (Accession No. KU711814和KU711815)分别在GenBank中进行BLAST分析,显示与迟钝爱德华氏菌的同源性均为99%,表明这两株菌为迟钝爱德华氏菌。根据上述序列构建系统发育树,菌株QY15814、QY15815与迟钝爱德华氏菌亲源关系最近(图1)。
2.5 药敏试验
迟钝爱德华氏菌QY15814和QY15815对头孢噻肟、头孢吡肟、头孢曲松、头孢西丁、头孢哌酮、头孢呋辛等抗生素高度敏感,对链霉素、克拉霉素、红霉素中度敏感,对阿米卡星、复方新诺明、四环素、麦迪霉素、万古霉素、大观霉素、克林霉素与苯唑西林不敏感(表3)。

表2 人工感染试验结果

图1 根据菌株QY15814和QY15815的16S rDNA序列构建的系统发育树
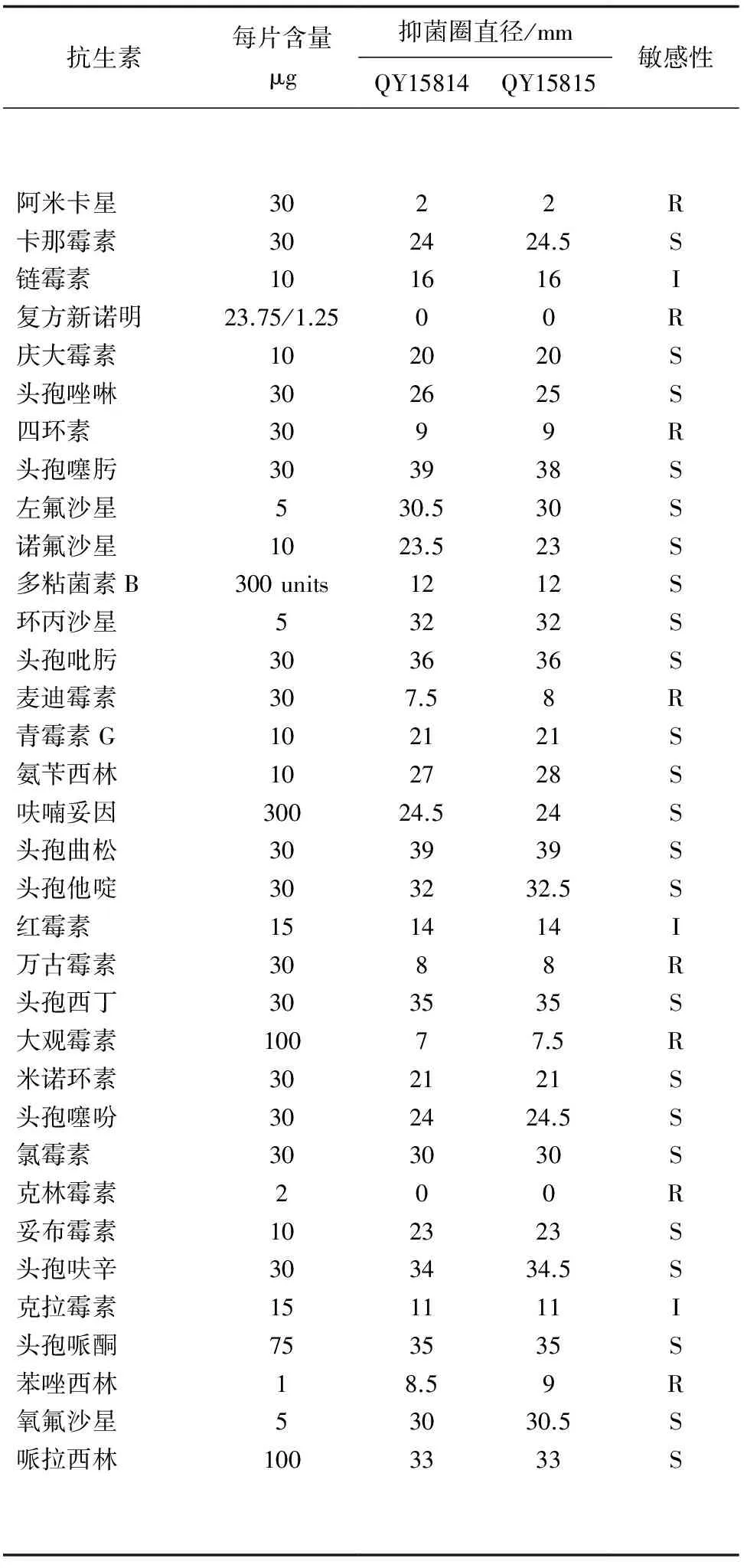
抗生素每片含量μg抑菌圈直径/mmQY15814QY15815敏感性阿米卡星卡那霉素链霉素复方新诺明庆大霉素头孢唑啉四环素头孢噻肟左氟沙星诺氟沙星多粘菌素B环丙沙星头孢吡肟麦迪霉素青霉素G氨苄西林呋喃妥因头孢曲松头孢他啶红霉素万古霉素头孢西丁大观霉素米诺环素头孢噻吩氯霉素克林霉素妥布霉素头孢呋辛克拉霉素头孢哌酮苯唑西林氧氟沙星哌拉西林30301023.75/1.2510303030510300units530301010300303015303010030303021030157515100224160202693930.523.51232367.5212724.539321483572124300233411358.53033224.51602025938302312323682128243932.5148357.52124.53002334.51135930.533RSIRSSRSSSSSSRSSSSSIRSRSSSRSSISRSS
注:“S”为高度敏感,“I”为中度敏感,“R”为不敏感.
3 讨 论
3.1 病原菌的分离及对鲮鱼的致病力
近年来,鲮鱼除可用于加工、食用外,还可作为尖塘鳢(Oxyeleotris)、鳜鱼(Sinipercachuatsi)等品种的饵料鱼,因此需求量逐年上涨,已成为华南地区热门的养殖品种之一。尽管目前国内外有关鲮鱼病原的文献报道主要集中于各类寄生虫,但在实际生产中,由病原细菌引发的鲮鱼病害已日趋严重[11,16]。本次从患病鲮鱼分离到迟钝爱德华氏菌,这在鲮鱼的细菌性疾病研究中尚属首次。
本研究中,人工感染后鲮鱼的症状与自然发病时的症状相似,并从濒死的鱼体内重新分离到了与迟钝爱德华氏菌QY15814和QY15815形态、生化特征一致的细菌,证实这两株菌即为本次导致鲮鱼发病的病原菌。经计算迟钝爱德华氏菌QY15814和QY15815对鲮鱼的半致死剂量依次为1.93×105cfu/g和9.65×104cfu/g,显示这两株菌对鲮鱼具有较强的致病力[20]。
3.2 病原菌的表型特征
Grimont等[21]根据迟钝爱德华氏菌的生理生化特征,将其分为野生型和生物型Ⅰ。野生型的菌株能够产生硫化氢,但不能利用某些糖类(如蔗糖、D-甘露醇、L-阿拉伯糖)作为能源,并与人和动物的感染密切相关;生物型Ⅰ菌株的以上4个生化指标的特征与野生型的相反,该类型的菌株只从水体中和蛇体内分离过,也尚未见生物型Ⅰ感染动物致病的文献报道[22]。本研究所检测的生化指标中,除蔗糖和L-阿拉伯糖之外,其他指标的结果与迟钝爱德华氏菌一致。本研究中,QY15814蔗糖为阳性,而硫化氢、D-甘露醇、L-阿拉伯糖均为阴性;QY15815蔗糖、L-阿拉伯糖为阳性,而硫化氢、D-甘露醇为阴性,此两菌株均未严格符合野生型和生物型Ⅰ的特征。因此,本次分离到的两株迟钝爱德华氏菌,属于表型有差异的野生型,还是属于表型有差异的生物型Ⅰ,尚需进一步验证。
3.3 可防治鲮鱼迟钝爱德华氏菌病的抗生素的筛选
当前,使用抗生素仍是防治水产养殖动物细菌性疾病的主要手段[23]。本研究得出的对34种抗生素敏感性的结果,可为在对由迟钝爱德华氏菌引发的鲮鱼感染症防治用药时提供参考。然而,抗生素选用时要以不同地区、不同来源、不同菌株的药敏试验结果为依据,避免药物的滥用。目前对青霉素G耐药的鱼源迟钝爱德华氏菌的菌株[24-27]较多,而本次分离得到的两株迟钝爱德华氏菌QY15814和QY15815对青霉素G敏感,此外,Xiao等[28-30]也分别报道过对青霉素G敏感的大菱鲆(Scophthalmusmaximus)源、褐牙鲆(Paralichthysolivaceus)源与斑马鱼(Daniorerio)源迟钝爱德华氏菌菌株。本研究发现迟钝爱德华氏菌QY15814和QY15815对水产养殖中常用渔药如克拉霉素、红霉素、链霉素的敏感性降低,且对四环素、麦迪霉素、大观霉素、克林霉素已产生耐药性,推测由养殖户长期投放此类药物所致。
本研究还发现,分离得到的两个菌株对34种抗生素的敏感性并未由于菌株的不同而出现明显的差异。此外,有趣的是,本次分离到的两个菌株对部分二、三、四代头孢类抗生素(如头孢噻肟、头孢吡肟、头孢曲松、头孢西丁、头孢哌酮、头孢呋辛)的敏感性最高。通过比较抑菌圈直径,这些抗生素的抑菌能力明显强于第一代头孢菌素如头孢唑啉、头孢噻吩。本研究的药敏试验结果又一次证实,新型头孢类抗生素相比早期头孢类抗生素在抗菌作用方面具有更显著的优势。
[1] 林小植, 林鸿生, 李冬梅, 等. 广东韩江不同年龄鲮鱼鱼体化学组成的研究[J]. 四川动物, 2011, 30(4): 564-568.
[2] 朱新平, 刘家照, 夏仕玲, 等. 鲤鱼DNA 对鳗鱼耐寒性能的影响[J]. 淡水渔业, 1996, 26(3):14-16.
[3] 陈永乐, 陈奋昌, 钟海浪. 西江鲮鱼年龄与生长的研究[J]. 水产学报, 1990, 14(3):198-205.
[4] 卫二建, 朱新平, 郑光明, 等. 珠江鲮的形态变异及与人工繁殖群体的比较[J]. 大连水产学院学报, 2007, 22(5):357-360.
[5] 毛永庆, 蔡发盛, 林鼎. 鲮鱼最适生长的营养素需要量研究[J]. 水生生物学报, 1985, 9(3):213-223.
[6] Zhang D C, Huang Y Q, Shao Y Q, et al. Molecular cloning, recombinant expression, and growth- promoting effect of mud carp (Cirrhinusmolitorella) insulin-like growth factor-I [J]. General and Comparative Endocrinology, 2006, 148 (2):203-212.
[7] Zhang D,Guo H, Zhu C, et al. The complete mitochondrial genome of mud carpCirrhinusmolitorella(Cypriniformes, Cyprinidae) [J]. Mitochondrial DNA, 2013, 26(1):149-150.
[8] Nguyen T T T, Sunnucks P. Strong population genetic structure and its management implications in the mud carpCirrhinusmolitorella, an indigenous freshwater species subject to an aquaculture and culture-based fishery [J]. Journal of Fish Biology, 2012, 80(3):651-668.
[9] Cheng F, Ye W, Ye F L. Isolation of microsatellite DNA and preliminary genomic analysis of mud carp (Cirrhinamolitorella) [J]. Zoological Research, 2007, 28(2):119-125.
[10] Yang C, Zhu X P, Sun X W. Development of microsatellite markers and their utilization in genetic diversity analysis of cultivated and wild populations of the mud carp (Cirrhinamolitorella) [J]. Journal of Genetics and Genomics, 2008, 35(4):201-206.
[11] 方苹, 陈静, 李婧慧, 等. 鲮鱼“红鳃病”病原的分离鉴定与药物敏感性试验研究[J]. 科学养鱼, 2010(1):54-55.
[12] 郎所. 中华鲮鱼的寄生单殖吸虫[J]. 上海师范大学学报:自然科学版, 1978(1):87-93.
[13] 陈如作. 寄生于鲮鱼(Cirrhinusnolitorella)粘孢子虫的一新种[J]. 暨南理医学报, 1988(1):115-117.
[14] 华鼎可. 广东鲮鱼鱼种的粘孢子虫病[J]. 动物学杂志, 1979, 14(2):43-47.
[15] 王方华, 邹为民, 李安兴. 广东贺江水域野生鲮鱼体表寄生虫典型海弯水虱的种群动态[J]. 动物学报, 2008, 54(3):407-415.
[16] 刘礼辉, 张德锋, 李宁求, 等. 鲮鱼源无乳链球菌的鉴定、血清型分析及药敏试验[J]. 南方农业学报, 2015, 46(11):2053-2058.
[17] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001:76.
[18] 李杰. 致病性迟缓爱德华氏菌的鉴定、PCR检测及esaC基因的功能鉴定[D]. 青岛:中国海洋大学, 2008.
[19] Wikler M A. M100-S18. Performance standards for antimicrobial susceptibility testing:Eighteenth Informational Supplement [S]. USA:Clinical and Laboratory Standards Institute (CLSI), 2008.
[20] Santos Y, Toranzo A E, Barja J L, et al. Virulence properties and enterotoxin production ofAeromonasstrains isolated from fish [J]. Infection and Immunity, 1989, 56(12):3285-3293.
[21] Grimont P A D, Grimont F, Richard C, et al.Edwardsiellahoshinae, a new species of Enterobacteriaceae [J]. Current Microbiology, 1980, 4(6):347-351.
[22] 王波, 莫照兰. 迟缓爱德华氏菌及其致病机理[J]. 海洋科学集刊, 2007(48):133-139.
[23] 刁菁, 杨秀生, 叶海斌, 等. 一种水产迟钝爱德华氏菌快速药敏检测方法的研究[J]. 水产科学, 2014, 33(1):22-28.
[24] 王燕, 张晓华, 吕俊超, 等. 养殖大菱鲆病原菌迟缓爱德华氏菌的分离鉴定及其疫苗研制[J]. 中国水产科学, 2009, 16(3):394-403.
[25] 张晓君, 战文斌, 陈翠珍, 等. 牙鲆迟钝爱德华氏菌感染症及其病原的研究[J]. 水生生物学报, 2005, 29(1):31-37.
[26] 杨春志, 王秀华, 黄倢. 养殖大菱鲆迟缓爱德华氏菌的分离鉴定与系统发育分析[J]. 上海水产大学学报, 2008, 17(3):280-284.
[27] 葛慕湘, 靳晓敏, 张艳英, 等. 迟钝爱德华氏菌耐药表型及4种耐药基因检测[J]. 水产科学, 2015, 34(5):300-304.
[28] Xiao J F, Wang Q Y, Liu Q, et al. Isolation and identification of fish pathogenEdwardsiellatardafrom mariculture in China[J]. Aquaculture Research, 2009, 40(1):13-17.
[29] 肖颖, 李晓玥, 张亚宁, 等. 牙鲆迟钝爱德华氏菌的分离及其鉴定[J]. 河北师范大学学报:自然科学版, 2010, 34(4):481-486.
[30] 刘春, 李凯彬, 王庆, 等. 斑马鱼迟缓爱德华氏菌的鉴定、致病性及药物敏感性[J]. 华中农业大学学报:自然科学版, 2013, 32(3):105-111.
IdentificationandAnalysisofAntibioticSensitivityofPathogenicBacteriumEdwardsiellatardafromCulturedMudCarp(Cirrhinusmolitorella)
CHEN Yanfeng1, ZHUO Xiaolei2, WANG Chao3, ZHENG Zongzheng1, FU Qiang1
( 1. College of Life Science and Engineering, Foshan University, Foshan 528231, China; 2. Qingyuan North River Fishery Science Institute,Qingyuan 511510, China; 3. Epidemic Prevention Station of Aquatic Animal in Qingyuan City, Qingyuan 511510, China )
Two dominant bacterial strains (QY15814 and QY15815) were isolated from hepatopancreas, kidney and spleen of diseased mud carp (Cirrhinusmolitorella) in an aquafarm in Qingyuan city, Guangdong province. They were identified through biochemical identification tubes and 16S rDNA sequence analysis, and antibiotic susceptibility test was performed through Kirby-Bauer disk diffusion method. Moreover, the median lethal dose values (LD50) for the isolates to mud carp were determined. The results showed that the isolates were facultative anaerobes which were gram negative, rod in shape, and motile. Their indole, MR and nitrate reduction test were positive, and they utilized sucrose, mannose and maltose. The isolates were identified asEdwardsiellatardaaccording to their physiological and biochemical characteristics. The 16S rDNA sequences of the isolates showed a high similarity (99%) to that ofE.tardavia BLAST network services in NCBI. The isolates were highly susceptible to cefotaxime, cefepime, ceftriaxone, cefoxitin, cefoperazone, cefuroxime and the others, intermediately susceptible to phytomycin, clarithromycin, erythromycin, and not susceptible to amikacin, complex sinomin, spectinomycin, and clindamycin. The LD50values for the isolates to healthy mud carps were 1.93×105cfu/g and 9.65×104cfu/g, respectively, indicating that they had strong pathogenicity to mud carp.
Cirrhinusmolitorella;Edwardsiellatarda; identification; drug sensitivity
10.16378/j.cnki.1003-1111.2017.01.008
S941.42
A
1003-1111(2017)01-0048-06
2016-03-08;
2016-06-03.
广东省自然科学基金资助项目(2014A030310020); 广东高校优秀青年创新人才培养计划项目(2014KQNCX183); 佛山科学技术学院优秀青年教师培养计划项目(fsyq201507).
陈言峰(1981-), 男, 博士;研究方向: 水产养殖病害防治技术. E-mail: chyfwf@126.com.
