辽宁近岸海域生物灾害及分布现状
2017-12-18宋广军
宋 伦,宋广军,姜 冰
( 辽宁省海洋水产科学研究院,辽宁省海洋生物资源与生态学重点实验室,辽宁 大连 116023 )
辽宁近岸海域生物灾害及分布现状
宋 伦,宋广军,姜 冰
( 辽宁省海洋水产科学研究院,辽宁省海洋生物资源与生态学重点实验室,辽宁 大连 116023 )
辽宁沿海;海洋生物灾害;赤潮;褐潮;绿潮;水母灾害;外来海洋生物入侵
海洋生物灾害为一种或几种海洋生物数量过度增殖引起的海洋生态异常现象[1-4]。辽宁省濒临黄海与半封闭的渤海,大陆岸线长2110 km,近岸海域面积68 000 km2,近些年海洋生态灾害在我国沿海频繁发生,为了掌握辽宁省的海洋生物灾害发生现状,提高防灾减灾工作的针对性和有效性,笔者系统地论述了赤潮、褐潮、绿潮、水母和外来种入侵等海洋生态灾害的分布现状,探讨了辽宁海洋生态灾害发生特点及趋势,以期为海洋生态灾害管理提供科学依据。
1 赤潮灾害
赤潮是辽宁沿海最常见的生态灾害,多发生在黄海北部即大连市至丹东市沿岸,渤海各市赤潮发生频率较低。引发赤潮的主要有夜光藻(Noctilucascintillans)、中肋骨条藻(Skeletonemacostatum)、海洋卡盾藻(Chattonellamarina)、尖刺拟菱形藻(Pseudo-nitzschiapungens)、赤潮异弯藻(Heterosigmaakashiwo)、塔马亚历山大藻(Alexandriumtamarense)、多纹膝沟藻(Gonyaulaxpolygramma)、螺旋环沟藻(Gyrodiniumspirale)、三角角藻(Ceratiumtripos)、丹麦细柱藻(Leptocylindrusdanicus)、梭角藻(Ceratiumfusus)、原甲藻(Prorocentrumsp.)等[5]。赤潮除2011年5月在鸭绿江口海域(赤潮面积4000 km2)和2008年6月在在丹东市附近海域(赤潮面积500 km2)爆发的夜光藻赤潮规模较大外,赤潮发生面积多在50 km2以内。近5年辽宁沿海赤潮灾害统计见表1。
辽宁近海赤潮多发区主要集中在大连南部海域,赤潮类型复杂,其中发生频率最高的为无毒的夜光藻,毒性最强的为产麻痹性贝毒的塔马亚历山大藻,其次为产腹泻性贝毒的原甲藻,产溶血毒素的赤潮异弯藻和海洋卡盾藻[6]。
2 褐潮灾害
综合目前的研究报道,已知能引发褐潮的为海金藻纲的抑食金球藻(Aureococcusanophagefferens)和Aureoumbralagunensis两种微微型藻类。已发生褐潮的海域中,只有美国德克萨斯州的马德雷湖和巴芬湾的褐潮原因种为A.lagunensis,其他更为常见的是抑食金球藻。近几年在我国渤海近岸海域发生的褐潮原因种亦是抑食金球藻[7-8]。
抑食金球藻,属金藻门、海金藻纲,是一种微微型藻,个体大小2~3 μm。由20世纪80年代至今,抑食金球藻多次在美国东海岸形成大范围有害赤潮,因赤潮期间细胞密度极高(109个/L)、能特异性地抑制贝类摄食、赤潮水体呈黄褐色而被称作“褐潮”,该命名被美国研究与管理部门应用,也为国际有害赤潮研究界所接受[8]。
自2009年我国首次发现褐潮以来,至2015年,河北秦皇岛—辽宁绥中沿岸海域已连续7年发生抑食金球藻褐潮,持续时间长、影响范围大,该藻种每年5月中下旬开始形成褐潮,一般持续2个月以上,其分布面积常达1000 km2以上。由2013年至今,在辽东湾东南部长兴岛局部海域每年5月中下旬—7月下旬也定期出现褐潮现象。在褐潮爆发海域,中小型浮游植物密度显著降低,硅藻、甲藻密度不及正常年份的1%。褐潮区海水浑浊呈黄绿色,透明度约为0.8 m,仅为该海域正常情况下透明度(2.5 m)的1/3,水体溶解氧含量低,微微型浮游生物密度异常高,而作为扇贝饵料生物的硅藻、甲藻密度极低。褐潮致使养殖扇贝出现生长停滞现象,甚至大规模死亡,对海水养殖业危害严重[9]。
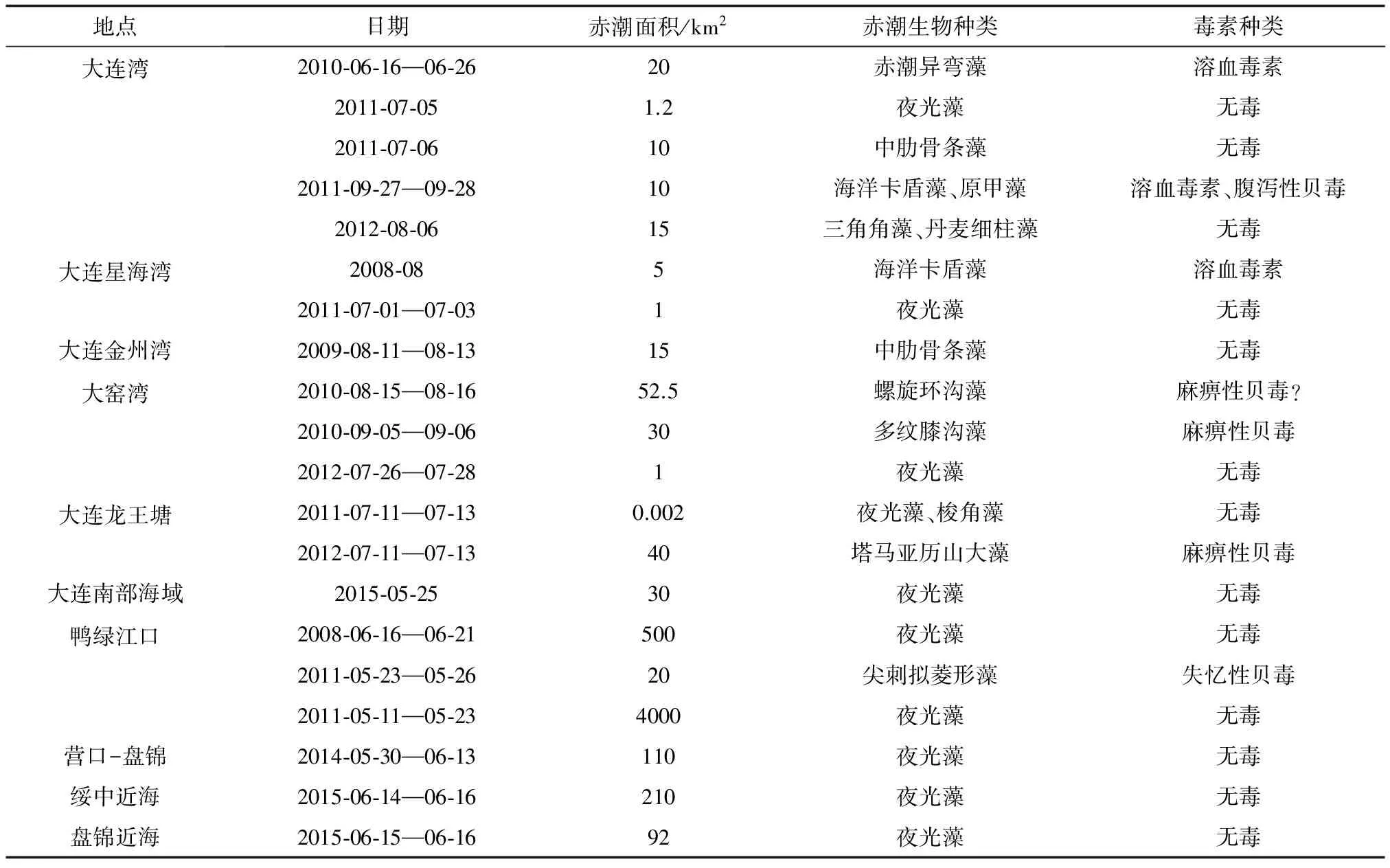
表1 近5年辽宁沿海赤潮发现情况统计表
注:2014年前数据参考赵冬至等[5]研究结果;2014年后数据通过卫星遥感监测统计;“?”为尚待证实.
3 绿潮灾害
绿潮是指在特定的环境条件下,海水中某些大型藻类爆发性增殖或高度聚集的一种生态异常现象。自上世纪70年代起,法国等欧洲国家沿海开始出现绿潮。近年来,包括我国沿海多个地区均发生过不同规模的绿潮灾害,已成为我国沿海新型的海洋生态灾害[9-15]。
自2007年首次爆发大规模浒苔(Enteromorpha)绿潮以来,黄海南部海域成为我国乃至世界浒苔绿潮灾害最严重的海域之一。2013年在山东半岛东部海域首次发现马尾藻(Sargassum)绿潮。2015年在辽宁近海发现大量绿潮藻涌入,6月25日在大连湾、星海湾、黑石礁、小平岛沿岸发现大量漂浮褐藻,经鉴定主要为铜藻(S.horneri),少量间杂海黍子(S.muticum),最大覆盖厚度近1 m。7月4日卫星遥感监测到大连东南和西部海域异常条带,分布面积达96 km2,7月下旬逐渐消失。
2015年7月8日,在盘锦辽河口、鲅鱼圈—红沿河海域卫星遥感监测到大量海藻漂浮,8月11日在葫芦岛兴城觉华岛海域也发现大量漂浮海藻,同期在黄海北部的丹东沿海和长山群岛海域以及朝鲜近岸发现大量漂浮藻类,分布面积最大为1600 km2,丹东近岸绿潮样品经鉴定为条浒苔(E.clathrata),此次绿潮事件一直持续至9月上旬(表2)。

表2 辽宁沿海绿潮发现情况统计表
4 水母灾害
水母灾害是由局部海域大型水母数量异常增多形成的一种生态异常现象,对浴场人身安全、滨海取水口正常运行以及渔业捕捞危害严重。近些年,水母灾害作为一种新型生态灾害引起了世界各沿海国家政府和科研工作者的高度关注,大型水母的爆发导致渔业减产,破坏食物链结构,致使生态系统失衡[16-22]。辽宁沿海大型水母主要有4种:沙海蜇(Nemopilemanomurai)、海月水母(Aureliasp.)、霞水母(Cyaneasp.)、海蜇(Rhopilemaesculentum)。海蜇虽然食用价值较高,也有大规模的增养殖,但是在海水浴场和工业取水口等区域,也应将其划入灾害水母范畴。水母爆发对海水浴场和滨海电厂安全运行的影响尤为严重。近年来大连、营口等城市都有水母伤人记录,2006年营口海滨浴场两名游客被水母蜇伤致死;2014年8月11日在大连星海湾浴场,一名游客在距离岸边5 m处被沙海蜇蛰伤致死。2013年7月下旬,辽宁红沿河核电站附近海域形成了高密度海月水母群,这也是在辽东湾首次发现大规模海月水母聚集现象。
海蜇是我国海区常见的大型水母,为暖水性河口种类,适温和适盐范围较广。在辽宁沿海,从丹东至葫芦岛均有分布,且池塘养殖规模也逐年上升。近10年来,由于人为及自然原因,加之灾害水母频发,海蜇自然资源量呈显著下降趋势,海蜇的多个地理种群可能已不复存在,如黄海北部的海蜇群体自1986年后已经逐渐消失。到目前为止,渤海的辽东湾是尚能形成海蜇集中渔汛的代表性渔场。海蜇分布与移动规律与其生态特征有关。辽东湾海蜇分布水深范围5~15 m,最适盐度为23~28,为嗜低盐的河口种类。辽东湾海蜇生活期1年,终年栖息在辽东湾,为一个相对独立的群体,主要分布区在N 40°30′以北的5 m等深线两侧水域,其数量约占辽东湾资源量的90%以上[23]。
沙海蜇广泛分布黄海北部及辽东湾海域。沙海蜇生存最适温度15~21 ℃。自20 世纪90年代中后期起,黄海海域连年发生大型水母爆发性增殖的现象,其中2003年发生程度最为严重。沙海蜇已成为大型致灾水母的主要优势种类之一,其生物量最高、影响范围最广。王彬等[24]调查发现,每年6月辽东湾北部近岸河口区均出现沙海蜇幼水母的密集分布区,渔获密度的最高值出现在辽河口近岸5 m等深线内,西北部和东北部的非河口水域沙海蜇幼水母的数量较少。7月,沙海蜇向深水区移动,幼水母至成体阶段,有从浅水移动到深水的趋势,辽东湾北部河口区是沙海蜇的可能发生地之一。
霞水母在辽宁沿海分布较少,仅在2004年发现辽东湾霞水母爆发现象,海蜇大面积减产。2004年7月12日前,调查的辽东湾海蜇资源为近几年最好,7月15日后,海蜇逐渐消失,随后7月20日在海区发现大量白色霞水母(C.nozakii),伞径30~100 cm,触须4~6 m。7月28日开捕后统计,辽东湾海蜇大面积减产,与上年相比减产逾八成,其主要原因就是白色霞水母的爆发所致。而近十年调查发现,辽东湾北部白色霞水母数量呈逐年下降的趋势,主要出现在辽东湾西部和东南部、离河口较远、盐度相对较高区域[25-27]。
海月水母是一种世界性水母,广泛分布于N 70°~S 40°间的沿岸水域。海月水母对环境的适应能力较强,爆发几率较高。近些年渤海海月水母有逐渐北移的趋势,2004—2008年的调查中,辽东湾北部近海未发现海月水母,自2009年以来,辽东湾北部近海海月水母的数量逐渐增多。王彬等[28]调查发现,辽东湾北部海区5月下旬未发现海月水母幼水母,6月下旬数量较多,7月上旬数量减少,7月中下旬数量进一步减少。2009年海月水母在辽东湾南部近海零星出现;2010年6月下旬,海月水母在辽东湾南部近海渔获密度高达533个/(网·h),在北部近海也有发现,渔获密度仅为1~15个/(网·h);2011年海月水母在辽东湾北部近海较多站位出现,渔获密度最高可达153个/(网·h)。2011年—2014年在大连星海湾和黑石礁湾经常发现大量海月水母聚集现象,密度高达200个/km2。2013年至2015年在大连长兴岛红沿河核电站附近海域也常有大量海月水母聚集,严重威胁核电站安全运行。
5 外来物种入侵灾害
外来海洋生物,是指某物种在当地海洋生态系统中没有分布,通过自然或人为活动从其他海域引入。当海洋外来物种在自然或半自然生态系统中建立了种群,改变或危害本地生物多样性的时候,就成为外来海洋入侵种。外来种入侵关注的重点不是物种,而是对本地生态系统带来的“入侵”后果,入侵物种通过改变环境条件和资源的可利用性而对本地物种产生致命的影响,不仅使生物多样性减少,而且使系统的能量流动、物质循环等功能受到影响,严重者会导致整个生态系统的崩溃[29-33]。
辽东湾作为中国的内湾,生物多样性非常丰富,由于海水养殖引种、鲜活水产品频繁贸易和远洋运输船舶压舱水排放等原因,导致海洋外来物种广泛传播。通过收集中国生物多样性数据库、中国外来入侵物种数据库、中国外来海洋生物入侵数据库、全球入侵物种数据库美国海岸警戒压舱水管理项目数据库资料及相关文献,笔者发现,至2014年,渤海已从国外引进鱼、虾、贝、藻类等海洋经济生物24种、盐碱地栽培植物2种,无意引进病菌8种、赤潮生物21种、污损生物16种(表3,不包含水族馆引进的观赏生物)。某些外来海洋生物入侵已对局部区域造成严重破坏,造成当地物种消失、生态结构失衡[34-37]。
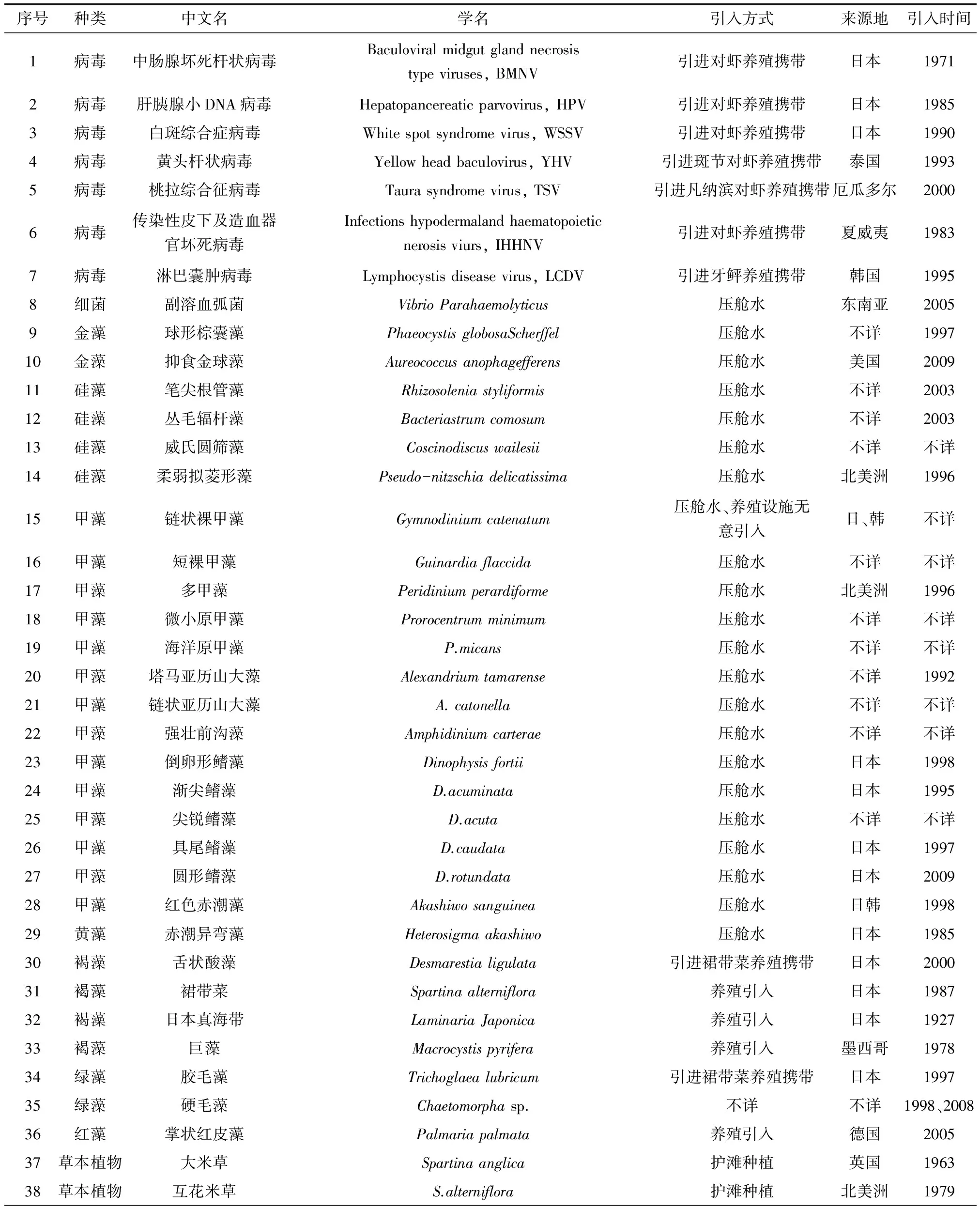
表3 渤海主要的外来海洋生物引入及时间[38-52]
(续表3)
序号种类中文名学名引入方式来源地引入时间39水母海月水母Aureliasp.海流或压舱水日本200740藤壶象牙纹藤壶Amphibalanuseburneus船底附着不详197841藤壶致密纹藤壶A.improvisus船底附着不详197842藤壶纹藤壶A.amphitrite船底附着北美洲197843虾类凡纳滨对虾Litopenaeusvanmamei养殖引入美国198844虾类细角滨对虾L.stylirostris养殖引入美国200045虾类日本囊对虾Marsupenaeusjaponicus养殖引入日本不详46苔虫独角裂孔苔虫Schizoporellaunicornis船底附着欧美不详47苔虫扇形管孔苔虫Tubuliporaflabellaris船底附着欧美不详48苔虫多室草苔虫Bugulaneritina船底附着欧美不详49苔虫加州草苔虫B.californica船底附着欧美不详50苔虫透明小分胞苔虫Celleporapumicosa船底附着欧美不详51盘管虫华美盘管虫Hydroideselegans船底附着不详不详52贝类绿鲍Haliotisfulgens养殖引入美国198553贝类红鲍H.rufescens养殖引入美国198554贝类硬壳蛤Mercenariamercenaria养殖引入美国199755贝类太平洋潜泥蛤Panopeaabrupta养殖引入美国199856贝类长牡蛎Crasostreagigas养殖引入日本197957贝类海湾扇贝Argopectensirradias养殖引入美国198258贝类虾夷扇贝Patinopectenyessoensis养殖引入日本198059乌贼日本枪乌贼Loligojaponica不详日本不详60海胆中间球海胆Strongylocentyotusintermedius养殖引入日本198961海鞘柄瘤海鞘Styelaclava船底附着不详不详62海鞘曼哈顿皮海鞘Molgulamanhattensis船底附着、养殖携带不详不详63海鞘玻璃海鞘Cionaintestinalis船底附着、养殖携带不详不详64海鞘真海鞘Halocynthiaroretzi养殖引入日韩200065鱼类星斑川鲽Platichthysstellatus养殖引入不详不详66鱼类条斑星鲽Veraspermoseri养殖引入日本200467鱼类红鳍东方鲀Takifugurubripes养殖引入日本不详68鱼类大西洋牙鲆Paralichthysdentatus养殖引入美国200269鱼类大菱鲆Scophthalmusmaxima养殖引入英国199270鱼类金头鲷Sparusaurata养殖引入法国200171鱼类欧鳎Soleasolea养殖引入法国2003
6 结 论
辽宁沿海海洋生物灾害呈现出类型增多、频率增高的趋势,传统的赤潮、外来种入侵生物灾害依然严重,新型的褐潮、绿潮、水母等生物灾害频发;褐潮、绿潮新型生物灾害可能成为以后重点关注对象,大连周边海域逐渐成为赤潮、褐潮、绿潮、水母、外来物种入侵灾害的重灾区;褐潮、绿潮今后在辽宁各沿海海域爆发的几率较高;外来海洋物种入侵状况应列入业务化监测体系,重点关注外来海洋赤潮、褐潮致灾种入侵状况。
[1] 王志霞. 海洋溢油对浮游生物种群的影响[J]. 环境科学与管理,2010,35(9):88-92.
[2] 左书华,李蓓. 近20年中国海洋灾害特征、危害及防治对策[J]. 气象与减灾研究,2008,31(4):28-33.
[3] 王爱军. 近年来我国海洋灾害损失及防灾减灾策略[J]. 江苏地质,2005,29(2):98-101.
[4] 董月娥,左书华. 1989年以来我国海洋灾害类型、危害及特征分析[J]. 海洋地质动态,2009,25(6):28-33.
[5] 赵冬至. 中国典型海域赤潮灾害发生规律[M].北京:海洋出版社,2010.
[6] 宋伦,宋广军,王年斌,等.黄渤海贝毒机理及产毒藻类的研究现状[J]. 水产科学,2013,32(7):428-434.
[7] 段金华.秦皇岛海域抑食金球藻种群动态及其浮游植物群落结构[D].广州:华南师范大学,2013:1-63.
[8] 宋广军,宋伦,王年斌,等.褐潮研究现状[J].河北渔业,2014(9):61-66.
[9] 张洪亮,张继民. 北海区海洋生态灾害的主要类型及分布现状研究[J]. 激光生物学报,2014,23(6):566-571.
[10] 范士亮,傅明珠,李艳,等. 2009—2010年黄海绿潮起源与发生过程调查研究[J]. 海洋学报,2012,34(6):187-194.
[11] Charlier R H, Philippe M, Charles W F,et al.Green tides on the Brittany coast[J]. Environmental Research, Engineering and Management, 2007, 3(41): 52-59.
[12] Liu D, Keesing J K,Dong Z, et al. Recurrence of Yellow Sea green tide in June 2009 confirms coastal seaweed aquaculture provides nursery for generation of macroalgal blooms[J]. Marine Pollution Bulletin, 2010,60(9): 1423-1432.
[13] Nelson T A, Haberlin K, Nelson A V, et al.Ecological and physiological controls of species composition in green macroalgal blooms[J]. Ecology, 2008,89(5):1278-1298.
[14] Pang S J, Liu F, Shan T F, et al. Tracking the algal origin of theUlvabloom in the Yellow Sea by a combination of molecular, morphological and physiological analyses[J]. Marine Environment Research, 2010, 69(4): 207-215.
[15] Yabe T, Ishii Y, Amano Y, et al.Green tide formed by free-floatingUlvaspp. at Yatsu tidal flat, Japan[J]. Limnology, 2009,10(3): 239-245.
[16] Brodeur R D, Sugisaki H, Hunt G L J. Increases in jellyfish biomass in the Bering Sea: implications for the ecosystem[J]. Marine Ecology Progress Series, 2002(233):89-103.
[17] Kawahara M, Uye S, Ohtsu K, et al. Unusual population explosion of the giant jellyfishNemopilemanomurai(Scyphozoa: Rhizostomeae) in East Asian waters[J].Marine Ecology Progress Series, 2006 (307): 161-173.
[18] Purcell J E, Uye S, Lo W T. Anthropogenic causes of jellyfish blooms and direct consequences for humans: a review [J].Marine Ecology Progress Series, 2007(350): 153-174.
[19] Willcox S, Moltschaniwskyj N A, Crawford C. Asexual reproduction in scyphistomae ofAureliasp.: effects of temperature and salinity in an experimental study[J]. Journal of Experimental Marine Biology and Ecology, 2007,353(2):107-114.
[20] Purcell J E, Hoover R A, Schwarck N T. Interannual variation of strobilation by the scyphozoanAurelialabiatain relation to polyp density, temperature, salinity, and light conditionsinsitu[J]. Marine Ecology Progress Series, 2009(375):139-149.
[21] Liu W C, Lo W T, Purcell J E, et al.Effects of temperature and light intensity on asexual reproduction of the scyphozoan,Aureliaaurita(L.) in Taiwan[J]. Hydrobiologia, 2009, 616(1):247-258.
[22] Han C H, Uye S. Combined effects of food supply and temperature on asexual reproduction and somatic growth of polyps of the common jellyfishAureliaaurita[J]. Plankton Benthos Res, 2010, 5(3):98-105.
[23] 王彬,董婧,刘春洋,等. 夏初辽东湾海蜇放流区大型水母和主要浮游动物[J].渔业科学进展, 2010, 31(5):83-90.
[24] 王彬,秦宇博,董婧,等.辽东湾北部近海沙蜇的动态分布[J].生态学报, 2013,33(6):1701-1712.
[25] 王彬,李玉龙,沈鸿,等. 2005~2013年辽东湾北部近海白色霞水母的数量分布[J]. 海洋渔业,2014,36(2):146-154.
[26] 董婧,王彬,刘春洋. 白色霞水母各发育阶段的形态[J]. 水产学报, 2006, 30(6):761-766.
[27] 孙明,董婧,刘春洋,等.光照对白色霞水母螅状体生长的影响[J]. 水产科学, 2009, 28(7):399-401.
[28] 王彬,董婧,王文波,等. 辽东湾北部近海大型水母数量分布和温度盐度特征[J]. 海洋与湖沼,2012,43(3):568-578.
[29] Bax N, Williamson A, Aguero M, et al. Marine invasive alien species a threat to global biodiversity[J]. Marine Policy, 2003, 27(4): 313-323.
[30] 杜萱,李志文.我国海洋生物入侵应对现状及对策[J]. 环境保护, 2013, 41(16):50-51.
[31] 郝林华,石红旗,王能飞,等. 外来海洋生物的入侵现状及其生态危害[J]. 海洋科学进展, 2005, 23(增刊):121-126.
[32] 徐海根,强胜,韩正敏,等. 中国外来入侵物种的分布与传入路径分析[J]. 生物多样性, 2004, 12(6): 626-638.
[33] 石红旗,姜伟,衣丹.外来海洋物种入侵风险评价研究进展[J].海洋科学进展,2005,23(增刊):127-131.
[34] 迟永雪,王丽梅,栾日孝,等.中国硬毛藻属新记录种—强壮硬毛藻[J]. 水产科学,2009, 28(3):162-163.
[35] 梁玉波,王斌.中国外来海洋生物及其影响[J].生物多样性,2001, 9(4):458-465.
[36] 刘艳,吴惠仙,薛俊增. 海洋外来物种入侵生态学研究[J]. 生物安全学报, 2013, 22(1):8-16.
[37] 沈欣军,百希尧,汤红,等. 船舶压舱水携带外来物种及其对水域生态环境的影响[J]. 生态学杂志, 2004, 23(1):125-128.
[38] Hallegraeff G M, Bolch D J. Transport of diatom and dinoflagellate resting spores in ships ballast water: impications for plankton biogeography and aquaculture[J]. Plankton Res, 1992, 14(8):1067-1084.
[39] 陈菊芳, 徐宁, 江天久,等.中国赤潮新记录种—球形棕囊藻[J]. 暨南大学学报:自然科学版, 1999, 20(3):124-129.
[40] 陈中义,李博,陈家宽.米草属植物入侵的生态后果及管理对策[J].生物多样性, 2004, 12(2):280-289.
[41] 邓蕴彦. 硬毛藻及其附生藻的实验分类学[D].青岛:中国科学院研究生院海洋研究所, 2010.
[42] 葛蔚, 王金叶, 柴超. 强壮前沟藻(Amphidiniumcarterae)毒素的溶血活性研究[J]. 海洋与湖沼, 2009, 40(6):732-737.
[43] 韩笑天,颜天,邹景忠,等. 强壮前沟藻(Amphidiniumcarterae)形态特征及其生长特性研究[J]. 海洋与湖沼,2004,35(3):279-283.
[44] 刘芳明,缪锦来,郑洲,等.中国外来海洋生物入侵的现状、危害及其防治对策[J]. 海岸工程, 2007, 26(4):50-57.
[45] 罗璇.青岛近海鳍藻种群动态与产毒特征研究[D].青岛:中国科学院研究生院海洋研究所, 2011.
[46] 王蔚, 张凯, 汝少国,等.米草生物入侵现状及防治技术研究进展[J].海洋科学, 2003, 27(7):38-42.
[47] 徐晓斐.牙鲆群体遗传多样性及鲽形目鱼类系统关系分析研究[D].青岛:中国海洋大学, 2005.
[48] 张淑梅, 栾日孝.大连地区底栖海藻分类研究概况[J].大连水产学院学报,1998, 13(1):19-29.
[49] 宋伦,宋广军,王年斌,等.辽东湾网采浮游植物粒级结构的胁迫响应[J].中国环境科学,2015,35(9):2764-2771.
[50] 宋伦,宋广军,王年斌.辽东湾浮游生物粒径结构稳定性分析[J].中国环境科学,2015,35(10):3117-3126.
[51] Song L,Yang G J,Wang N B,et al.Relationship between environmental factors and plankton in the Bayuquan Port, Liaodong Bay, China: a five-year study[J]. Chinese Journal of Oceanology and Limnology, 2016,34(4):654-671.
[52] 姜冰,宋伦,时明明,等.辽宁近海外来赤潮海洋微藻入侵现状[J].水产科学,2015,34(12):795-800.
MarineEcologicalDisastersandTheirDistributioninLiaoningCoastalWaters
SONG Lun,SONG Guangjun,JIANG Bing
( Key Laboratory of Marine Biological Resources and Ecology, Liaoning Province, Liaoning Ocean and Fisheries Science Research Institute, Dalian 116023,China )
Liaoning littoral zone; marine ecological disaster; red tide; brown tide; green tide; jellyfish disaster; alien marine organism invasion
10.16378/j.cnki.1003-1111.2017.01.021
S917
C
1003-1111(2017)01-0118-07
2015-09-26;
2016-02-29.
中国海洋发展研究会重大项目(CAMAZDA201605);国家海洋公益行业科研专项(201505019);辽宁省自然科学基金资助项目(2014020182);辽宁省科学技术计划项目(2015103044).
宋伦(1980—),男,副研究员;研究方向:海洋生物生态.E-mail: lunsong2014@163.com.
