阿特拉津对红耳龟胚胎发育及肝脏、肾脏组织结构的影响
2017-12-18傅丽容阮亦麒史海涛
傅丽容,倪 俊,阮亦麒,董 蓉,史海涛
( 海南师范大学 生命科学学院,海南 海口571158 )
阿特拉津对红耳龟胚胎发育及肝脏、肾脏组织结构的影响
傅丽容,倪 俊,阮亦麒,董 蓉,史海涛
( 海南师范大学 生命科学学院,海南 海口571158 )
为探索除草剂阿特拉津对红耳龟胚胎发育及肝脏、肾脏组织学变化的影响,本试验模拟不同含量阿特拉津污染环境,设置对照组(蒸馏水)和0.005 mg/cm2、0.025 mg/cm2、0.125 mg/cm23个试验组,在温度(30±0.5) ℃、相对湿度为85%~90%的条件下孵化红耳龟受精卵,检测孵化率、孵化期及肝、肾脏组织结构变化指标。结果表明,0.005 mg/cm2、0.025 mg/cm2的阿特拉津对孵化率和孵化期没有显著影响,0.125 mg/cm2组孵化期显著延长(P<0.01);试验处理组肝脏和肾脏有不同程度的损伤,0.005 mg/cm2组主要表现增生性病变,0.025 mg/cm2和0.125 mg/cm2组损伤作用加重,主要表现为退行性病变。试验结果说明,阿特拉津长时间作用红耳龟受精卵可能导致胚胎发育迟缓,并导致肝脏和肾脏组织病变。
阿特拉津;脏器;胚胎;红耳龟
农业生产中除草剂大量使用,已成为严重的环境安全问题。阿特拉津,又名莠去津,属三氮苯类除草剂,具有化学结构相对稳定,降解速度缓慢,半衰期长等特点[1]。其可随径流进入养殖水体,对鱼类、甲壳类等水生动物具有毒性作用[2-4]。曾报道施用阿特拉津9年后的土壤中,50%阿特拉津以结合态存在,这些残留物通过自然环境因素的相互作用无法除去[5]。如果进入土壤中的农药含量在数量和速度上超过土壤的自净能力,将会对土壤进而对整个生态系统构成潜在威胁。
龟鳖动物成体具有坚硬的龟甲,有很长的寿命,环境污染物在其体内的蓄积作用与龟的年龄大小成正相关性[6]。其繁殖行为有别于其他动物,卵生亲体无孵卵行为,卵壳具有高柔软性和通透性。野外环境中,受精卵一般就在随地而挖的沙穴或土壤穴孵化,孵化期长,孵化环境理化性质的改变显著影响龟卵胚胎发育。已有的研究表明,基质酸碱度、硝酸盐胁迫对胚胎发育有影响,随着基质酸碱度的降低,红耳龟(Trachemysscriptaelegans)和中华条颈龟(Mauremyssinensis)受精卵孵化率降低,孵化稚龟非特异性免疫机能下降[7];硝酸盐胁迫抑制孵化稚龟免疫机能[8]。
鉴于诸多龟鳖动物的野生种群均属于濒危物种及其胚胎期对土壤的依赖性,本研究模拟阿特拉津污染的环境孵化红耳龟受精卵,研究红耳龟胚胎发育生理机能变化,探讨龟鳖类动物胚胎发育可能受到的潜在危害,为加强农药使用量的管理和保护濒危野生动物提供理论依据。
1 材料与方法
1.1 试剂和仪器
1.2 试验方法
1.2.1 受精卵获取
试验用受精卵240枚(已受精2~3 d),于2014年4月9日购自海口泓旺龟鳖养殖场。择取外观良好、发育正常、胎盘明显的受精卵,经可孵性鉴别。
1.2.2 阿特拉津配制
根据美国农业产品和安大略政府推荐,在玉米地使用控制杂草生长的喷洒用量1.479 kg/hm2阿特拉津(0.01 mg/cm2)[9],设置3个含量梯度阿特拉津,分别为0.005 mg/cm2、0.025 mg/cm2、0.125 mg/cm2和蒸馏水(空白对照组)。配制方法:孵化盒面积400 cm2,按照试验设置的含量,相应孵化盒阿特拉津添加量分别为2 mg/盒、10 mg/盒、50 mg/盒;称取阿特拉津,用蒸馏水溶解后(按质量比1∶1)与干蛭石充分混合,空白对照组为加等量蒸馏水。
1.2.3 人工孵化
试验前采用1∶5000高锰酸钾溶液浸泡孵化盒、擦拭培养箱。受精卵随机分组,每组30枚,每个孵化盒15枚,2个平行组,龟卵编号。孵化盒规格25 cm×16 cm×9 cm,底铺5 cm蛭石,放入受精卵,水平间隔0.5~1 cm依次排放,覆盖2 cm蛭石。孵化温度(30±0.5) ℃,保持智能生化培养箱空气相对湿度为85%~90%,基质湿度为6%~8%,在孵化盒2 cm处插入水银温度计,以此处温度为基准控温。每隔2 d检查孵化基质水分含量,及时补水,维持基质所需湿度;孵化过程中,适时按顺序调整各孵化盒的位置,减少和避免培养箱内温偏差对孵化的影响。
1.2.4 组织病理学分析
孵化出壳稚龟暂养3 d,测量相关形态学指标。每组解剖16只,取肝脏、肾脏称量质量。
脏器指数=脏器质量/体质量×100%
(2)钻井设备及钻井工具应用的精准化。对钻井设备进行精准化升级,如为井队配置20m3以上的胶液罐,统一规范整改加重漏斗、循环罐标尺,实行二开固控设备验收制度。
石蜡组织切片制作方法:新鲜样本放入波恩氏固定液中,24 h以后移入70%酒精内固定保存。制作切片时取出放入固定染色液(染核)12 h,分别用70%→80%→90%→100%酒精洗去余色,无水乙醇脱水,二甲苯透明,渗蜡,包埋,然后按照常规法制备红耳龟肝脏和肾脏组织切片,进行病理观察并显微拍摄。
1.3 数据处理
所得数据利用SPSS 22.0软件进行统计分析,各计量资料均以平均值±标准差表示。(1)Kruskal-Wallis多独立样本非参数检验和χ2-检验不同阿特拉津处理对胚胎孵化率的影响;(2)采用单因素方差分析对各组间孵化期和脏器指数进行差异显著性比较,P<0.05判定为具有统计学意义。
2 结果与分析
2.1 阿特拉津对孵化率、孵化期的影响
孵化稚龟外部形态观察、行动能力观测,各组均未发现畸形个体。统计孵化稚龟(表1),0.025 mg/cm2、0.005 mg/cm2阿特拉津处理组孵化率与对照组相比差异不显著,0.125 mg/cm2组虽低于对照组,经Kruskal-Wallis多独立样本非参数检验差异不显著(χ2=2.05,df=1,P>0.05)。0.025 mg/cm2、0.005 mg/cm2组孵化期与对照组相比,无明显变化,0.125 mg/cm2组比对照组延长6 d,差异极显著(P<0.01)。
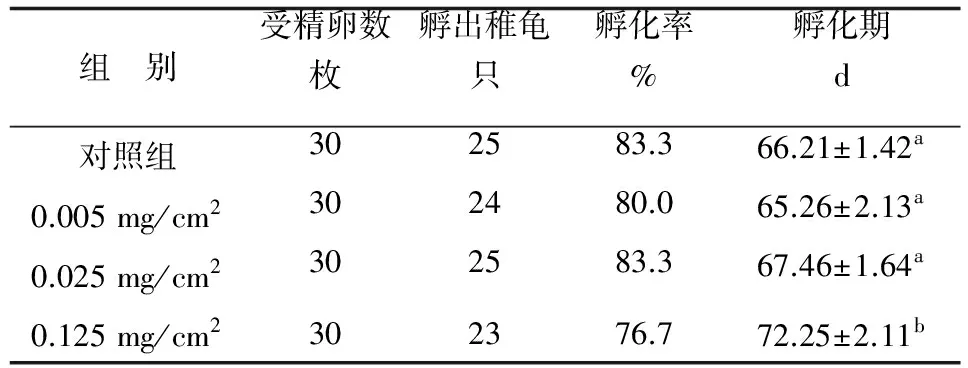
表1 阿特拉津对受精卵孵化率及孵化期的影响
注:同一列肩标记不同小写字母表示各组差异显著(P<0.05),标记不同大写字母表示各组差异极显著(P<0.01),下同.
2.2 阿特拉津对肝脏、肾脏脏器指数的影响
肝脏脏器指数经方差齐性检验,P=0.661>0.05,表明各组方差差异不显著,方差齐性。进行差异显著性检验分析(表2),阿特拉津处理组脏器指数均高于对照组,并随着用量的升高脏器指数增大,0.005 mg/cm2、0.025 mg/cm2、0.125 mg/cm2组分别高于对照组1.89%、5.30%和8.71%,0.005 mg/cm2组与对照组差异不明显,0.025 mg/cm2、0.125 mg/cm2组皆高于对照组和0.005 mg/cm2组,差异极显著(P<0.01)。
方差齐性检验肾脏脏器指数,P=0.497>0.05,表明各处理组方差差异不显著,方差齐性。差异显著性检验(表2),各处理组均极显著低于对照组(P<0.01),3个处理组间差异显著(P<0.05),并随着处理用量的升高肾脏指数明显降低,各处理组分别低于对照组14.29%、21.90%和23.81%。
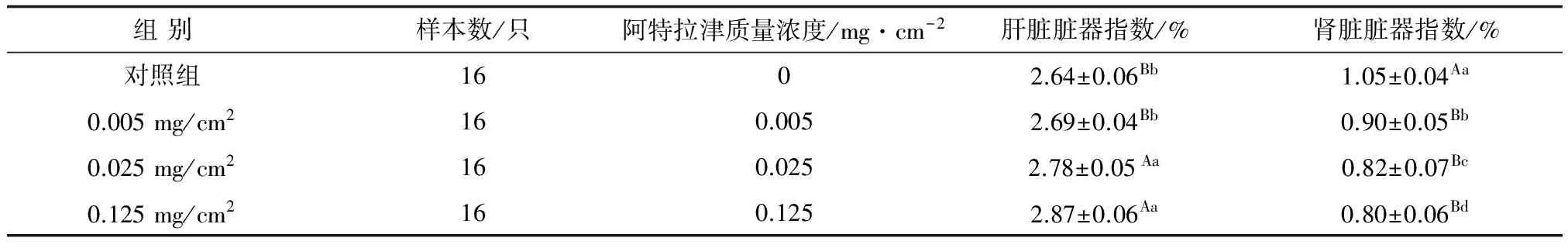
表2 阿特拉津对孵化稚龟肝脏、肾脏脏器指数的影响
2.3 孵化稚龟肝脏和肾脏组织结构观察
2.3.1 肝脏组织结构变化
显微观察可见,对照组肝细胞大小匀称、排列有序、结构清晰、胞浆均匀,细胞饱满,未见组织学病理改变(图1a)。处理组肝脏组织结构出现明显变化,0.005 mg/cm2组肝细胞间结缔组织出现断裂,出现空泡,肝细胞排列不整齐、细胞体积变小,胞浆染色不均,现未被伊红染色的透明小球状脂肪滴,肝脏出现脂肪性病变(图1b)。0.025 mg/cm2组肝细胞排列紊乱,细胞大小差异明显,胞浆浑浊程度加重,细胞界限不清,脂肪滴融合变大,部分肝细胞的核溶解(图1c);0.125 mg/cm2组脂肪滴愈发增大(图1d),偶见肝实质细胞坏死出现空泡变性区域。

图1 孵化稚龟肝脏组织切片
a:对照组;b:0.005 mg/cm2组(箭头A示结缔组织断裂,出现空泡,箭头B示脂肪滴);c:0.025 mg/cm2组(箭头示增大的脂肪滴);d:0.125 mg/cm2组(箭头示融合增大的脂肪滴).每张图片皆为放大400×.
2.3.2 肾脏组织结构变化
显微观察肾脏组织结构,对照组肾小管上皮细胞排列有序、大小均匀、结构清晰,肾小管管径较小,上皮细胞低矮,管腔大,肾小球结构完整(图2a)。0.005 mg/cm2组肾小管上皮细胞轻度肿胀,管腔变窄,肾小球未见明显改变(图2b);0.025 mg/cm2组肾小管上皮细胞肿胀加剧,部分上皮细胞坏死、脱落,肾小球轻度充血,小管之间距离轻度增宽(图2c);0.125 mg/cm2组肾小管上皮细胞严重空泡变性,与基底膜分离或坏死、脱落,肾小球毛细血管扩张充血、体积膨大,个别球囊黏连,部分肾小球萎缩、消失(图2d)。
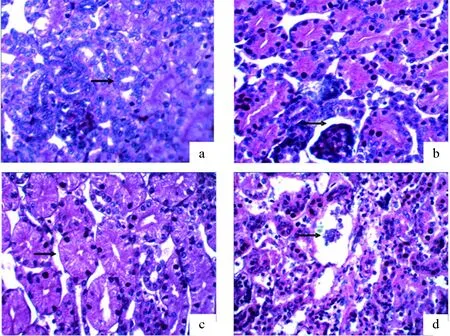
图2 孵化稚龟肾脏组织切片
a :对照组(箭头示结构正常肾小管);b:0.005 mg/cm2组(箭头示肾小球);c:0.025 mg/cm2组(箭头示肿胀肾小管);d:0.125 mg/cm2组(箭头示肾小球萎缩坏死).每张图片皆为放大400×.
3 讨 论
3.1 阿特拉津对红耳龟受精卵发育的影响
阿特拉津可通过环境进入动物体内,对动物生理过程产生影响,有一定的毒性作用,毒性效应表现在诱发畸形、发育迟缓、免疫力低下等方面[10]。本试验处理组受精卵孵化率和对照组无显著差异,无畸形个体且不会使胚胎致死,说明在规定的喷洒用量范围内,红耳龟受精卵卵壳和卵膜有一定的阻隔保护作用。0.125 mg/cm2组红耳龟的受精卵孵化期延长,胚胎发育受抑制。已有的研究证实,阿特拉津可抑制小鼠、鱼等红细胞生成,降低血液的携氧能力[11-12],红细胞供氧不足,能量利用率降低,从而增加代谢损耗,因此需要将内源性储能物质转化为机体可利用的能量[2],因此导致胚胎发育迟缓。可预见在野外环境中,无亲体护卵的孵化期延长,来自于环境的其他威胁将加大其生存的风险。
3.2 阿特拉津对红耳龟稚龟肝、肾重要脏器的影响
梁秋云等[13]检测阿特拉津及其主要代谢物在大鼠体内的分布发现,阿特拉津在大鼠体内被快速且大量地代谢为脱乙基脱异丙基阿特拉津,该代谢产物在各组织中广泛分布,并能透过血脑屏障,且在肝、肾等部位长时间蓄积。阿特拉津能够影响哺乳动物和鸟类肝脏中糖元和脂类的代谢,可引起肝炎和脂肪变性[14]。栾新红等[15-17]对动物脏器功能的影响研究,发现阿特拉津对大鼠的代谢器官(肝脏、肾脏)具有损伤作用,使其发生退行性病变,提示肝脏、肾脏可能是阿特拉津作用的靶器官。阿特拉津对于红耳龟胚胎发育期的肝、肾损伤作用亦非常明显,0.005 mg/cm2的阿特拉津作用可致孵化稚龟肝、肾脏脂肪的增加,器官相对比重增大,表现为增生性病变,可能阿特拉津经过肝脏的代谢,产生的肝毒性物质使载脂蛋白减少,甘油三脂转运障碍,导致肝脏的脂肪变性[18]。阿特拉津超过规定使用剂量将产生污染胁迫,在代谢过程中可以对机体组织产生氧化压力[19],明显抑制体内超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶活性[2],过量的自由基攻击细胞膜,引起细胞膜发生脂质过氧化而生成脂质过氧化物,最终导致整个细胞功能失常,基因突变,蛋白质交联,造成细胞死亡,表现明显的退行性病变,损伤程度与剂量成正相关。
通过以上模拟试验,认为阿特拉津在规定使用范围内,对龟鳖动物胚胎期毒性作用不明显,长时间或过量使用阿特拉津,可致胚胎发育迟缓,损伤肝、肾重要脏器组织结构。
[1] Solomon K R,Baker D B.Ecological risk assessment of atrazine in North American surface water [J]. Environ Toxicol Chem,1996,15(1):31-76.
[2] 苑宇哲,徐士霞,姚春生,等.阿特拉津溶液对弹琴蛙(Ranaadenopleura)蝌蚪形态发育的影响[J].应用与环境生物学报,2004,10(3):318-323.
[3] 李康.阿特拉津和毒死蜂对中华绒螯蟹(Eriocheirsinensis)的毒性效应研究[D].上海:华东师范大学, 2005.
[4] 赵颖.淡水鱼类对3种农药的敏感性分布(SSDs)初探[D].杭州:浙江大学, 2013.
[5] Capriel P,Haisch A,Khan S U.Supercritical method an efficacious technique for the extraction of bound pesticide residues from soil and plant samples[J].Agric Food Chem, 1986(34):70.
[6] 王瀛寰,王会利,张艳峰,等.爬行动物应用于毒理学研究的现状[J].生态毒理学报,2012, 7(6):585-592.
[7] 傅丽容,陈美玲,史海涛.孵化基质 pH 对红耳龟和中华条颈龟胚胎的毒性效应[J].四川动物,2013,32 (2):237-240.
[8] 傅丽容,贺斌,王雪,等.硝酸铵影响红耳龟和中华条颈龟孵化及血液生理指标的研究[J]. 四川动物,2012,31(2):252-255.
[9] Ministry of Agriculture. Food and Rural Affairs Field Crop Protection Guide[M]. Ontario-Toronto,ON,Canada,2001.
[10] 逯娟.莠去津对斑马鱼生殖发育影响的研究[D].保定:河北大学,2009.
[11] Mencoboni M, Lerza R,Bogliolo G, et al. Effect of atrazine on hemopoietic system[J]. In Vivo,1992,6(1):41-44.
[12] Hussein S Y,El-Nasser M A,Ahmed S M.Comparative studies on the effects of herbicide atrazine on freshwater fishOreochromisniloticusandChrysichthyesauratusatAssiut, Egypt[J]. Bull Environ Contam Toxicol,1996(57):503-510.
[13] 梁秋云,朱丹,黄慧学,等.阿特拉津及其主要代谢物在大鼠体内的组织分布[J].中国实验方剂学杂志, 2011,17(9):222-225.
[14] Curic S,Gojmerac T,Zuric M.Morphological changes in the organs of gilts induced with low-dose atrazine[J].Vet Arhiv,1999,69(3):135-148.
[15] 栾新红,丁鉴峰,孙长勉,等.除草剂阿特拉津影响大鼠脏器功能的毒理学研究[J].沈阳农业大学学报,2003,34(6):441-445.
[16] 栾新红,石娇,刘梅,等.阿特拉津对大鼠抗氧化功能及肝脏组织学变化的影响[J].沈阳农业大学学报,2010,41(5):560-565.
[17] 栾新红,王越,曹中赞,等.阿特拉津对雄性大鼠骨髓微核率及肾脏和脾脏组织学变化的影响[J].沈阳农业大学学报,2013,44 (2):166-171.
[18] 李双明.苯丙胺对大鼠肝脏毒性损害的实验研究[D].广州:暨南大学,2007:18-19.
[19] Stolze K,Nohl H.Effects of xenobiotics on the respiratory activity of rat heart mitochondria and the concomitant formation of superoxide radicals[J].Environ Toxicol Chem,1994,13(3):499-502.
EffectsofAtrazineonEmbryonicDevelopmentandHistologicalStructureofLiverandKidneyinRed-earedTurtle(Trachemysscriptaelegans)
FU Lirong, NI Jun, RUAN Yiqi, DONG Rong, SHI Haitao
( College of Life Science, Hainan Normal University, Haikou 571158, China )
To investigate the effects of atrazine on embryonic development and histological changes in liver and kidney in red-eared turtle (Trachemysscriptaelegans), the fertilized eggs of red-eared turtle were incubated in the water containing atrazine at a dose of 0.005 mg/cm2(low-dose group), 0.025 mg/cm2(middle-dose group), 0.125 mg/cm2(high-does group) and distilled water (control group) at (30±0.5) ℃ under the relative humidity range of 85 to 90 percent in a laboratory. During the incubation, the hatching rate, incubation period and histological changes in liver and kidney were observed. The results showed that the incubation period was significantly prolonged in high-dose group whilst the incubation period and hatching rate were no significant effect in both low-dose and middle-dose groups. Also the damaged liver and kidney tissues had hyperplastic lesions in low-dose group and the degenerative changes in the middle-dose and high-dose groups. The findings illustrated that atrazine may lead to developmental delay in the red-eared turtle embryo and to histological lesions in the kidney and liver.
atrazine; viscera; embryo;Trachemysscriptaelegans
10.16378/j.cnki.1003-1111.2017.01.018
S966.5
A
1003-1111(2017)01-0104-05
2016-02-23;
2016-04-26.
国家自然科学基金资助项目(NO.31372228);海南省自然科学基金资助项目(NO.314078).
傅丽容(1964—), 女, 教授; 研究方向:龟鳖动物生理学. E-mail:flr@hainnu.edu.cn.通讯作者:史海涛(1963—),男,教授;研究方向:两栖爬行动物生态学与保护生物学.E-mail:haitao-shi@263.net.
