ASIC3在慢性偏头痛大鼠三叉神经脊束尾核的表达*
2017-12-18吴白雪刘超阳秦光成周冀英陈力学
王 莎 吴白雪 刘超阳 秦光成 周冀英 陈力学△
(1重庆医科大学附属第一医院实验研究中心,重庆400016;2 重庆市神经病学重点实验室,重庆400016 )
•论 著•
ASIC3在慢性偏头痛大鼠三叉神经脊束尾核的表达*
王 莎1吴白雪1刘超阳1秦光成1周冀英2陈力学1△
(1重庆医科大学附属第一医院实验研究中心,重庆400016;2重庆市神经病学重点实验室,重庆400016 )
目的:本文通过检测酸敏感离子通道3 (acid sensing ion channel 3, ASIC3)在慢性偏头痛大鼠三叉神经脊束尾核(trigeminal nucleus caudalis, TNC)的表达变化,探讨其在慢性偏头痛发病中的作用及可能机制。方法:将SD 雄性大鼠随机分为7组,假手术组 (n= 18),模型组 (n= 18),模型+溶剂组 (n= 5),模型+ ASIC3抑制剂5 μM组 (n= 5),模型+ ASIC3抑制剂10 μM组 (n= 5),模型+ASIC3激动剂100 μM组 (n= 5),模型+ASIC3激动剂200 μM组 (n= 5)。使用Von Frey纤维丝测定大鼠眶周及足底的机械痛阈值,实时定量聚合酶链反应 (qRT-PCR) 检测ASIC3 mRNA,蛋白质印迹法(Western blotting) 检测ASIC3、CGRP蛋白表达,免疫荧光技术检测ASIC3和CGRP在TNC部位的表达和定位情况。结果:(1) 硬脑膜反复给予“炎性汤”后,大鼠眶周及足底的机械痛阈值显著降低 (P< 0.01);(2) 与Sham组相比,CM组大鼠ASIC3在TNC的表达明显升高 (P< 0.05);(3) 给予ASIC3抑制剂后,大鼠眶周及足底机械痛阈值均显著增加 (P< 0.05),CGRP蛋白的表达也明显降低 (P< 0.05),而给予ASIC3激动剂后,大鼠眶周及足底机械痛阈值均显著降低 (P< 0.05),CGRP蛋白的表达明显增加 (P< 0.05);(4) 免疫荧光检测显示在TNC部位,ASIC3主要表达于神经元,且与CGRP有少量共表达。结论:ASIC3在慢性偏头痛大鼠TNC部位表达上调,且通过调节机械痛阈值的变化及CGRP的表达参与了慢性偏头痛的发生发展过程。
慢性偏头痛;ASIC3;三叉神经脊束尾核
偏头痛是一种临床上常见的神经功能障碍性疾病,以反复发作为特征,慢性偏头痛是其严重类型,发作时多表现为单侧的搏动样疼痛,可伴有畏光、畏声、恶心、呕吐等症状,严重影响病人的日常生活和工作。调查表明,慢性偏头痛在普通人群中患病率为1%~3%[1],偏头痛病人中,每年约有2.5%~3.0%由发作性偏头痛 (episodic migraine,EM) 发展为慢性偏头痛 (chronic migraine, CM)[2],然而目前尚无治疗慢性偏头痛的有效方法,因此探索慢性偏头痛的发生机制及其治疗手段尤其重要。
慢性偏头痛的病生理机制尚不清楚,目前多认为可能与疼痛通路调控异常、中枢敏化、皮质兴奋性增高及神经源性炎症有关,其中神经肽类物质如降钙素基因相关肽、P物质和神经激肽A等的释放以及所导致的神经源性炎症被认为是导致偏头痛慢性化的关键机制之一[3~5]。酸敏感离子通道3(Acidsensing ion channel 3)是一种与痛觉及伤害性感受密切相关的阳离子通道[6,7],对酸性环境极敏感,ASIC3主要表达于外周神经传入纤维。在偏头痛研究中,已证实ASIC3在外周三叉神经感受中的重要作用,ASIC3的活化不仅可激活硬脑膜传入纤维还可促进CGRP的释放,引起神经源性炎症反应,最终导致偏头痛的发生[8,9]。然而关于ASIC3是否在偏头痛的慢性化病理机制发挥作用研究甚少,本研究通过建立慢性偏头痛大鼠模型,首次观察到ASIC3不仅在中枢二级神经元TNC部位表达明显增加,并且可调节大鼠机械痛阈的变化以及CGRP的释放,这为探索慢性偏头痛的机制及治疗方法提供了新的方向。
方 法
1.材料
(1)实验动物
SPF级雄性SD大鼠61只,购自重庆医科大学实验动物中心,实验动物生产许可证号:SYXK(渝)2012-0001,体重250~300 g,随机分成7组。实验动物均放置于温度为22 ± 2℃、湿度为50 ± 5%的环境中,保证正常昼夜规律,自由摄食和饮水。适应性饲养一周后进行试验,为避免手术过程引起的肠麻痹,实验前大鼠禁食禁水12 h。
(2)主要试剂
“炎性汤”,包括组胺(1 mmol/L)、5-羟色胺(1 mmol/L)、缓激肽 (1 mmol/L) 和前列腺素E2(0.1 mmol/L),均购自Sigma–Aldrich,用PBS稀释;兔抗大鼠ASIC3抗体、APETx2、GMQ (Alomone Labs);兔抗大鼠CGRP抗体 (Abcam)、小鼠抗大鼠CGRP抗体 (Santa Cruz)、小鼠抗大鼠NeuN (Millipore)、Cy3标记的山羊抗兔 (Proteintech)、FITC标记的山羊抗小鼠(Proteintech)、DAPI (Beyotime)、兔抗大鼠β-actin抗体(Proteintech)、HRP标记羊抗兔IgG抗体(北京中杉金桥),BCA蛋白浓度检测试剂盒( Beyotime ),TRIzol试剂和逆转录试剂盒(Takara),ECL化学发光显影液(Beyotime)。
2.实验方法
(1)大鼠慢性偏头痛模型的建立
参照 Melo-Carrillo[10]等人的实验方法:采用硬脑膜反复给予“炎性汤”(in fl ammatory soup, IS)刺激的方法建立大鼠慢性偏头痛模型。大鼠称重,10%水合氯醛腹腔麻醉(4 ml/kg),将大鼠固定于立体定位仪上。头部正中去毛、消毒,沿头部正中剪开长约1 cm的切口,逐层分离皮下组织直至颅骨表面暴露清晰。用颅骨钻钻取直径约1 mm的骨窗,避免损伤硬脑膜,在骨窗安装微量软管,周围用牙托粉和牙托水固定,逐层缝合,涂抹新霉素预防感染。术后将大鼠置于37℃恒温板上,待苏醒后放回笼中单独喂养。术后恢复一周,选择伤口恢复良好的大鼠进行后续的实验。CM组大鼠硬脑膜滴注IS 2 µl,使用微螺旋定量推进装置匀速缓慢泵入,Sham组给予同样体积的PBS (0.01 M),重复7天。
(2)侧脑室注射
本实验经侧脑室给予ASIC3的特异性抑制剂 APETx2,分为低浓度组(5 μM, 每只 5 µl)、高浓度组(10 μM, 每只5 µl),ASIC3的激动剂GMQ,即低浓度组(100 μM, 每只 5 µl)、高浓度组(200 μM, 每只5 µl)。滴注7天“炎性汤”后,将大鼠麻醉、固定在立体定位仪上,常规消毒,用止血钳取出安置的微量套管,清理、分离周围组织,使颅骨暴露清晰,在前囟向左1.5 mm,向后1 mm处,用颅骨钻钻取直径约1 mm骨窗。将微量注射器用立体定位仪固定,从颅骨窗平面向下进入约4 mm到达侧脑室,匀速缓慢地泵入干预试剂,约10 min。试剂注射完成后留针5 min再拔出,骨窗用骨蜡封闭,逐层缝合皮肤,将大鼠放置于37℃恒温板上,待苏醒后放回笼中。
(3)大鼠机械痛阈值的检测
参照 Oshinsky[10]的实验方法,检测每次给药前的基础机械痛阈值的变化。将大鼠分别放入透明笼子中适应30 min,使用电子Von Frey纤维丝测痛仪(WoodLand Hills, CA, USA) 测定大鼠面部及后爪足底的机械痛阈值。用痛阈仪纤维丝的头端轻触大鼠眶周或后爪足底的皮肤,当大鼠出现头部快速撤回、发声、用爪搔抓面部或剥开纤维丝、抬足、甩足时为阳性反应,记录痛阈值,重复测量3次,间隔时间为10 min,取其平均值作为该部位的机械痛阈值。
(4)实时定量聚合酶链反应
大鼠麻醉后迅速断头取脑,分离TNC部位冻存于液氮中。按照Takara的TRIzol试剂盒说明书提取TNC的总RNA,用分光光度法测定其浓度,然后以此为模板逆转录合成 cDNA,反转录体系 20 µl反应如下:37℃ 15 min,85℃ 5 s,4℃ 10 min,所得cDNA保存于-20℃待用。引物由生工生物工程(上海)股份有限公司合成, ASIC3上游引物5’-TAAGACCACCCTGGATGAGC-3’, 下 游 引物 5’-TCCAGATGGGCAGATACTCC- 3’。 内参GAPDH上游引物:5’-ATG ACT CTA CCC ACG GCA AG- 3’,下游引物:5’-GGA TGC AGG GAT GAT GTT CT- 3’。取适量体积逆转录后的cDNA为模板,在CFX-96热循环仪中进行PCR扩增反应,条件如下:95℃ 30 s,95℃ 5 s,58℃ 30 s,65℃ 5 s,循环50 次,通过软件得到各组相应的Cq值,用2-ΔΔCT值表示其基因的相对表达量。
(5)蛋白质印迹法
大鼠麻醉后断头取脑,迅速分离TNC部位,保存于-80℃待用。取适量组织,加入相应体积含有 PMSF (Beyotime, China)的RIPA组织裂解液(Beyotime, China),用超声匀浆器充分匀浆后置
使用SPSS 19.0软件对数据进行统计学分析,数据以均数±标准差(±SD)表示,两组数据用独立样本t检验,多组数据用单因素方差分析,P< 0.05为差异有统计学意义。于4℃冰箱裂解90 min。然后低温离心15 min,12 000 rpm,取其上清液用BCA法测定蛋白浓度。向蛋白样品中加入5xSDS-PAGE蛋白上样缓冲液(Beyotime, China),100℃水浴变性5 min。取适量体积蛋白样品上样,配制10%的SDS-PAGE凝胶电泳2 h,恒流电转(250 mA, 1.5 h)至PVDF膜上,5%脱脂奶粉室温封闭2~3 h,孵育一抗:兔抗大鼠ASIC3 (1:400),兔抗大鼠CGRP(1:2 000),兔抗大鼠 β-actin (1:2 000),4℃冰箱过夜。TBST洗膜3次,每次10 min,然后滴加二抗由HRP标记的山羊抗兔(1:8 000),37℃孵育1.5 h,TBST漂洗3次,每次10 min。采用ECL试剂盒化学发光显影,灰度值使用Fusion软件进行分析,以 β-actin 作为参照,计算目的蛋白的相对表达量。
(6)免疫荧光染色
大鼠麻醉后用生理盐水和4%多聚甲醛经心灌注,分离脑组织,放于4%多聚甲醛中后固定24 h,然后用20%的蔗糖溶液脱水24 h,换为30%的蔗糖溶液继续脱水72 h。将处理好的脑组织放于冰冻切片机中,切取10 μm厚的脑片,放于-80℃保存备用。PBS洗片后滴加0.3% Triton穿破细胞膜,37℃孵育10 min,用PBS充分洗片后加山羊血清进行封闭,于37℃孵育30 min,随后擦掉血清滴加一抗混液,包括兔抗大鼠ASIC3 (1:100)、小鼠抗大鼠CGRP (1:100)、小鼠抗大鼠NeuN (1:100),4℃孵育过夜。次日用PBS冲洗后滴加二抗,包括Cy3标记的山羊抗兔 (1:60),FITC标记的山羊抗小鼠 (1:60),于37℃孵育1.5 h,随后用PBS洗片,滴加DAPI,37℃孵育5 min,最后用PBS洗片并用50%甘油封片,保存于4℃冰箱备用。
3. 统计学分析
结 果
1.机械痛阈值检测
用von Frey纤维丝检测大鼠硬脑膜滴注前的基础机械痛阈。当给予PBS后大鼠出现缩头行为学表现,而给予IS后,大鼠出现发声、缩头、用后爪搔抓面部、爬笼等行为学表现,表明建模成功。IS组大鼠眶周和足底的痛阈值依次下降,自第3次滴注前的痛阈值显著下降(5.64 ± 0.60 g; 11.57 ±1.58 g),与首次之间(8.11 ± 0.80 g; 17.46 ± 0.70 g)有统计学差异 (P< 0.05, 见图1);而PBS组7次滴注前痛阈值变化不明显,无统计学差异。
2. ASIC3 mRNA和蛋白相对表达量的检测
通过qRT-PCR反应检测在两组大鼠TNC部位ASIC3 mRNA的表达,结果显示,在CM组大鼠TNC部位ASIC3 mRNA的表达量明显高于Sham组 (P< 0.05, 见图 2B)。Western bloting 结果同样表明CM组的ASIC3蛋白表达显著高于Sham组 (P<0.05, 见图 2A)。
3.给予干预试剂后机械痛阈值和CGRP蛋白表达的检测
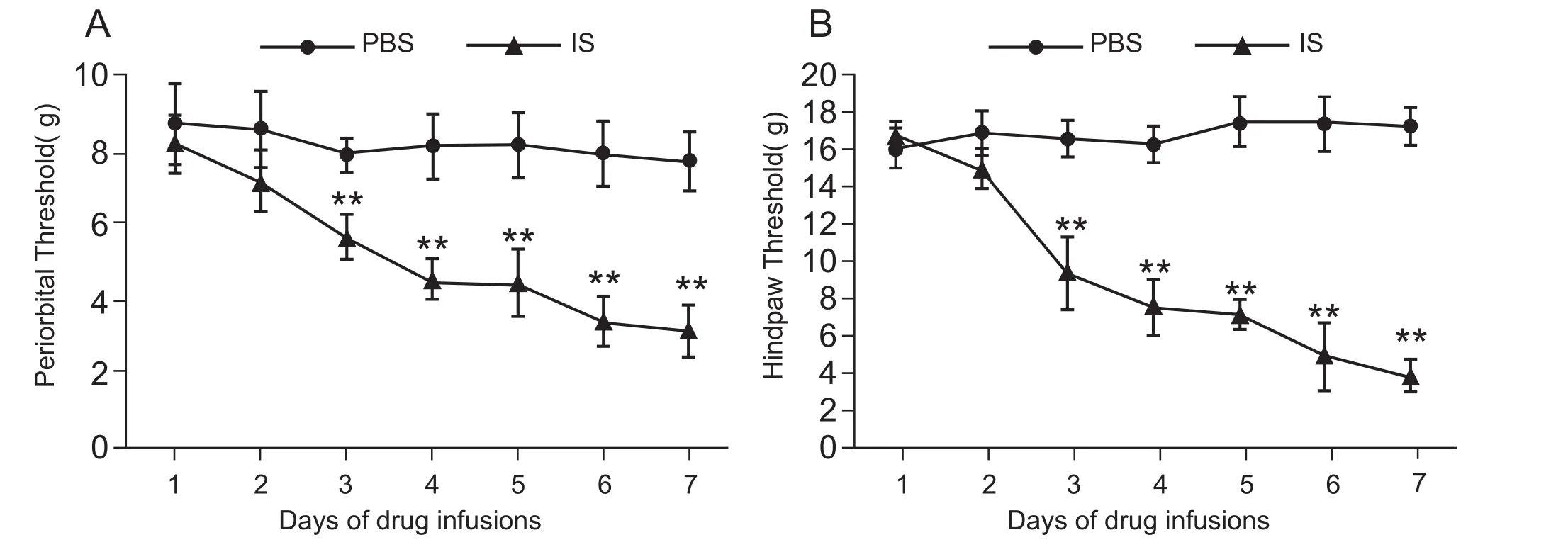
图1 PBS (Sham组) /IS (CM组) 7次滴注前眶周(A)和后足(B)的机械痛阈值(n = 10,±SD)**P < 0.01,与首次痛阈值相比Fig.1 Periorbital and hindpaw mechanical pain threshold in PBS (Sham) group and IS (CM) group before 7 times infusions(n = 10,±SD)
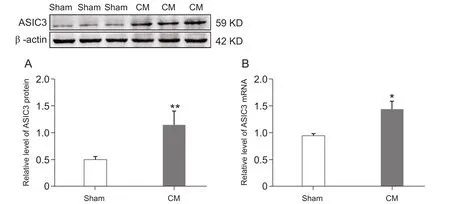
图2 CM组大鼠TNC部位ASIC3 mRNA (B)和蛋白(A)的表达明显增加(±SD)*P < 0.05,**P < 0.01,与 Sham 组相比Fig.2 The mRNA and protein expressions of ASIC3 in TNC in two groups of rats, which were increased signi fi cantly in CM group compared with the Sham group (±SD)
在给予7次IS滴注后,经侧脑室给予ASIC3的抑制剂APETx2和激动剂GMQ。CM组(3.57 ± 0.45 g; 6.98 ± 0.38 g)和 CM+DMSO 组(3.80 ± 0.66 g; 7.20 ± 1.41 g) 眶周与足底的痛阈值与Sham组 (7.76 ± 0.78 g; 17.57 ± 0.99 g) 比较明显降低 (P< 0.05, 见图3),而CM组和CM+DMSO组之间痛阈值无显著差异,表明溶剂对痛阈值无明显影响。给予ASIC3抑制剂后,与CM+DMSO组相比,大鼠眶周 (6.38 ± 0.69 g, 5.53 ± 0.40 g)及后足 (11.17 ± 0.73 g, 11.46 ± 0.91 g) 的痛阈值显著增高 (P< 0.05),但两种浓度的抑制剂对痛阈值的影响无明显差异。给予ASIC3激动剂后发现,与CM + DMSO组相比,大鼠眶周 (2.39 ± 0.55 g,2.01 ± 0.33 g) 及足底 (4.27 ± 0.64 g, 4.78 ± 0.83 g)的痛阈值显著降低 (P< 0.05),且与使用的两种不同的浓度无明显关系,表明痛阈值与干预试剂的浓度无依赖性。CGRP蛋白表达在 CM 组大鼠中显著增高 (P< 0.05, 见图4),而给予ASIC3抑制剂可显著降低CGRP的表达 (P< 0.05),给予ASIC3激动剂后CGRP的表达显著增高 (P< 0.05)。
4.免疫荧光检测结果
采用免疫荧光技术检测ASIC3、CGRP在TNC部位的表达及定位情况,结果显示,ASIC3表达于神经元,且在神经元的胞膜和胞质均有表达。CGRP主要表达于TNC的Ⅰ-Ⅱ层,呈颗粒状,并且ASIC3与CGRP有少量共表达(见图5)。
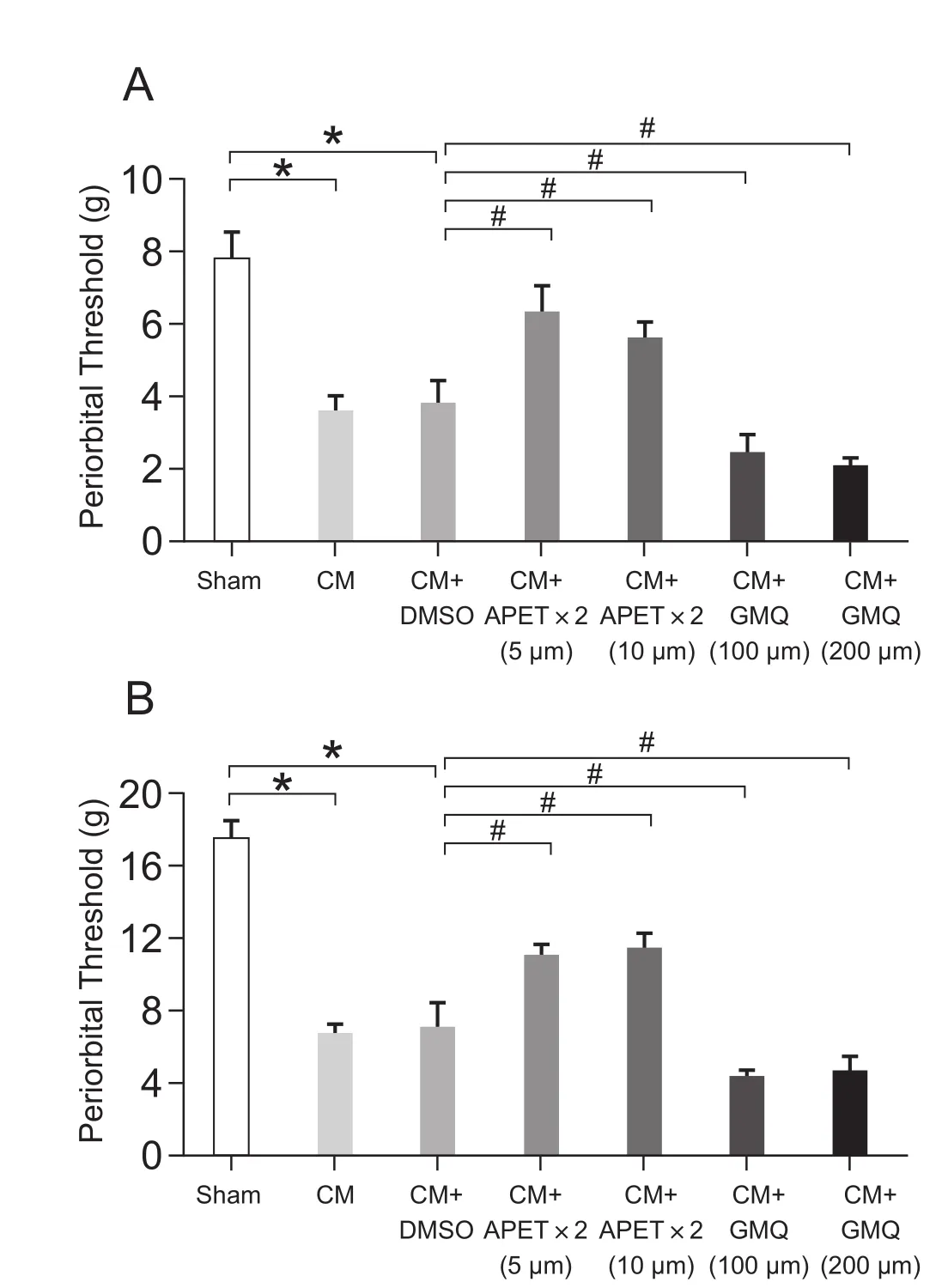
图3 给予ASIC3抑制剂和激动剂后眶周(A)和后足(B)痛阈值的变化 (±SD)*P < 0.05,与 Sham 组相比;#P < 0.05,与 CM+DMSO组相比Fig.3 The changes of thresholds in periorbital and hindpaw after administration of ASIC3 inhibitor and agonist(±SD)*P < 0.05, compared with the Sham group; #P < 0.05,compared with the CM+DMSO group.
讨 论
慢性偏头痛的病理生理机制尚未阐明,理想的慢性偏头痛模型应可以模拟CM病人头痛发作的特征以及由急性演变成慢性痛的过程,但在目前的慢性偏头痛动物模型中,如硬脑膜神经炎症模型、硝酸甘油模型、基因修饰模型[11]等,均不能完全模拟这种过程。本实验基于三叉神经血管系统激活是偏头痛发病的重要机制这一假说,参照Melo-Carrillo[10]的实验方法,给予硬脑膜化学刺激,建立硬脑膜神经源性炎症模型。即反复滴注IS,激活硬脑膜周围伤害感受器,促使三叉神经末梢释放神经肽类物质,如降钙素基因相关肽、P物质,导致血管扩张、血浆外渗及肥大细胞脱颗粒,引起神经源性炎症[3]。本课题组已报道[12]多次给予IS不仅可诱发大鼠偏头痛发作,并且可促进中枢敏化的发展并引起皮肤的异常性疼痛,即表现为外周的痛觉过敏和痛觉超敏[13],IS作为一种复合致炎剂已被广泛用于CM的模型研究。
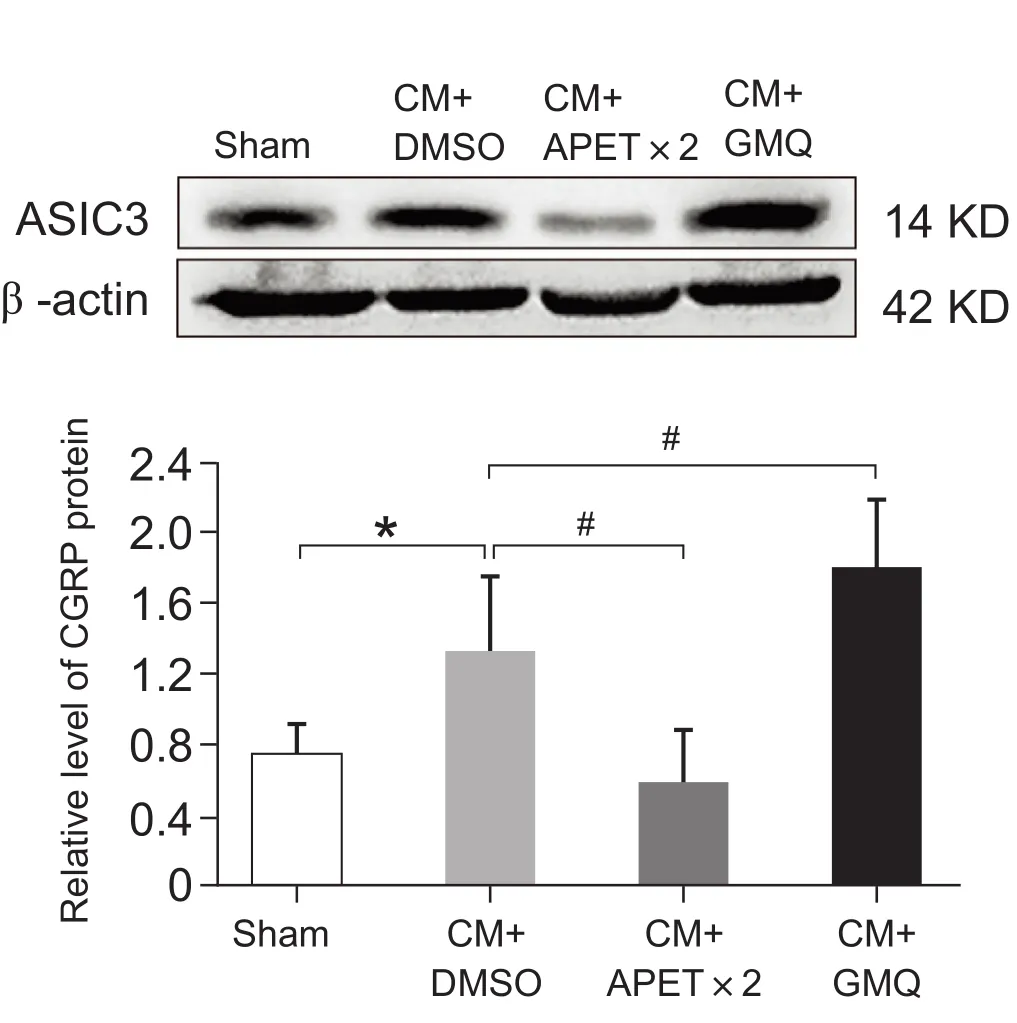
图4 CGRP在各组的表达 (±SD)*P < 0.05,与 Sham 组相比;#P < 0.05,与 CM +DMSO组相比Fig.4 The expression of CGRP in different groups (±SD)*P < 0.05, compared with the Sham group; #P < 0.05,compared with the CM + DMSO group.

图5 免疫荧光检测ASIC3、CGRP在TNC部位的定位:A-E:TNC部位,DAPI(蓝色),NeuN (绿色)与ASIC3(红色)重合;F-J:TNC部位,DAPI(蓝色),CGRP(绿色)与ASIC3(红色)部分重合bar:A, F = 500 μm,B, C, D, G, H, I = 75 μm,E, J = 25 μmFig.5 Location of ASIC3 and CGRP in TNC detected by immuno fl uorescence
ASICs属于上皮钠离子通道/退化蛋白 (ENaC/DEG) 超家族成员,是一种感受细胞外酸碱环境的阳离子通道,可被氢离子激活,主要通透钠离子和少量的钙离子[14]。迄今为止,ASICs共发现4种基因编码6种酸敏感离子通道亚基蛋白即ASIC1a、ASIC1b、ASIC2a、ASIC2b、ASIC3 和 ASIC4[15],Krishtal和Pidoplichko[16]于1980年发现,pH的骤降可引起大鼠三叉神经元大量的钠离子传导,因此提出酸敏感离子通道的概念和体内存在“质子受体”的理论[17],在此基础上,历经30余年的研究,Yan[9]团队不仅明确了ASICs在外周伤害感受中的作用,还证实了在酸性环境中硬脑膜传入纤维可被激活并且在炎症反应条件下被敏化。前期研究结果均显示ASICs在偏头痛的发病机制中发挥重要作用,且为主要中介物质。而在这些亚基中,ASIC3对胞外PH值的降低最为敏感(PH0.5= 6.7)[15]。研究表明,ASIC3主要分布在外周背根神经节,此外,软骨组织、心脏、胃也有表达,在伤害性感受和传递中起重要作用[18,19],另有研究显示,硬脑膜可被酸性细胞外环境直接激活且这种作用主要由ASIC3介导,活化的ASIC3可引起钠离子大量内流,产生动作电位,激活伤害感受器并促进三叉神经元中CGRP大量释放,且这种作用不依赖胞内的钙离子,从而导致头痛发作,而预先给予ASIC3的特异性抑制剂APETx2处理,偏头痛的行为可被减轻,证实ASIC3在偏头痛的发病机制中的重要作用[20]。
本实验通过硬脑膜外置管,在大鼠清醒状态下连续给予7天的IS,引起三叉神经伤害感受器的反复激活,建立慢性偏头痛大鼠模型,观察大鼠行为学及组织学变化。本研究发现,随着IS滴注次数的增多,CM组大鼠眶周及后爪的机械痛阈值明显降低,脑干TNC部位CGRP表达显著增加,同时ASIC3蛋白表达也明显上调,提示多次滴注IS可促使偏头痛的慢性化,引起大鼠皮肤的异常性疼痛,这与临床上慢性偏头痛病人的表现类似,并且ASIC3在慢性偏头痛病生理机制中起着重要作用。
研究表明,在慢性偏头痛病理机制中,CGRP在脑干区作为一种兴奋性递质被释放,继而诱发TNC以及下丘脑的中枢敏化[21,22],并且,在临床研究中,慢性偏头痛受试者脑脊液中CGRP的水平较对照组明显增加[23],故理论上CGRP可作为慢性偏头痛的生化指标。APETx2是ASIC3的一种选择性抑制剂,可特异性地阻断ASIC3,减少伤害性感受的传递[24]。本研究显示,经侧脑室给予APETx2后,大鼠眶周及后爪的机械痛阈显著增高,并可明显减少CGRP的表达,这表明通过阻断ASIC3可影响慢性偏头痛的发展。GMQ为ASIC3非特异性激动剂[25],给予GMQ后可显著降低大鼠的机械痛阈值以及增加CGRP的表达,这与ASIC3可促进三叉神经元释放CGRP的结果相一致。荧光染色显示ASIC3主要表达于TNC部位的神经元胞膜和胞质,并与CGRP有少量的共表达,表明ASIC3不仅表达于周围神经系统,参与疼痛的感受和传递,在中枢神经系统也有表达,尤其在脑干TNC部位的表达显著增加,并能调节神经肽CGRP的释放,这些结果提示ASIC3可能参与慢性偏头痛的病生理机制,但ASIC3究竟是通过哪些中间机制参与慢性偏头痛的发生有待后续实验研究。而本研究局限于单一造模方法及痛阈指标的检测进行研究,也需进一步完善。
综上所述,本文证实了ASIC3在慢性偏头痛发病机制中的潜在作用,为临床上慢性偏头痛的治疗提供了新的靶点。
[1] Manack AN, Buse DC, Lipton RB. Chronic Migraine:Epidemiology and Disease Burden. Current Pain &Headache Reports, 2011, 15(1):70 ~ 78.
[2] Lipton RB. Tracing transformation: chronic migraine classi fi cation, progression, and epidemiology. Neurology, 2009, 72(5 Suppl):3 ~ 7.
[3] Rakesh M. Understanding migraine: Potential role of neurogenic in fl ammation. Ann Indian Acad Neur, 2016,19(2):175 ~ 182.
[4] Alina B, Rubesh G, Randa N,et al. Current Understanding on Pain Mechanism in Migraine and Cluster Headache. Anesthesiology & Pain Medicine, 2016,6(3):e35190.
[5] Tajti J, Szok D, Majláth Z,et al. Migraine and neuropeptides. Neuropeptides, 2015, 52:19 ~ 30.
[6] 秦光成, 陈力学, 周冀英. 慢性偏头痛研究进展. 中国疼痛医学杂志, 2011, 17(3):176 ~ 178.
[7] Deval E, Lingueglia E. Acid-Sensing Ion Channels and nociception in the peripheral and central nervous systems. Neuropharmacology, 2015, 94:49 ~ 57.
[8] Yan J, Dussor G. Ion channels and migraine. Headache the Journal of Head & Face Pain, 2014, 54(4):619 ~ 639.
[9] Yan J, Wei X, Bischoff C,et al. pH-evoked dural afferent signaling is mediated by ASIC3 and is sensitized by mast cell mediators. Headache, 2013, 53(8):1250 ~ 1261.
[10] Melo-Carrillo A, Lopez-Avila A. A chronic animal model of migraine, induced by repeated meningeal nociception, characterized by a behavioral and pharmacological approach. Cephalalgia An Intern-ational Journal of Headache, 2013, 33(13):1096 ~ 1105.
[11] Storer R J, Supronsinchai W, Srikiatkhachorn A. Animal models of chronic migraine. Curr Pain & Headache Rep, 2015, 19(1):467 ~ 475.
[12] 吴白雪, 王莎, 秦光成,等. 蛋白激酶C参与大鼠慢性偏头痛中枢敏化. 中国疼痛医学杂志, 2017(5):331 ~ 337.
[13] Nelly B, Radhouane D, Alain A,et al. General trigeminospinal central sensitization and impaired descending pain inhibitory controls contribute to migraine progression. Pain®, 2014, 155(7):1196 ~ 1205.
[14] Gründer S, Pusch M. Biophysical properties of acid-sensing ion channels (ASICs). Neuropharmacology,2015, 94(404):9 ~ 18.
[15] Lingueglia E. Acid-sensing ion channels in sensory perception. J Biol Chem, 2007, 282(24):17325 ~ 17329.
[16] Krishtal OA, Pidoplichko VI. A receptor for protons in the nerve cell membrane. Neuroscience, 1980,5(12):2325 ~ 2327.
[17] Krishtal O. The ASICs: signaling molecules? Modul-ators? Trends Neurosci, 2003, 26(9):477 ~ 483.
[18] Sutherland SP, Benson CJ, Adelman JP,et al. Acid-sensing ion channel 3 matches the acid-gated current in cardiac ischemia-sensing neurons. Nat Acad Sci USA, 2001, 98(2):711 ~ 716.
[19] Rd JR. The mechanosensitivity of mouse colon afferent fi bers and their sensitization by in fl ammatory mediators require transient receptor potential vanilloid 1 and acid-sensing ion channel 3. J Neurosci, 2005,25(47):10981 ~ 10989.
[20] Durham PL, Masterson CG. Two Mechanisms Involved in Trigeminal CGRP Release: Implications for Migraine Treatment. Headache the Journal of Head & Face Pain,2013, 53(1):67 ~ 80.
[21] Bigal ME, Walter S, Rapoport AM. Calcitonin generelated peptide (CGRP) and migraine current understanding and state of development. Headache, 2013,53(8):1230 ~ 1244.
[22] Messlinger K, Fischer MJ, Lennerz JK. Neuropeptide effects in the trigeminal system: pathophysiology and clinical relevance in migraine. Keio J Med, 2011,60(3):82 ~ 89.
[23] Sarchielli P, Pini LA, Coppola F,et al. Endocanna-binoids in chronic migraine: CSF findings suggest a system failure. Neuropsychopharmacology Official Publication of the American College of Neuropsy-chopharmacology, 2007, 32(6):1384 ~ 1390.
[24] Diochot S, Baron A, Rash LD,et al. A new sea anemone peptide, APETx2, inhibits ASIC3, a major acid-sensitive channel in sensory neurons. Embo J, 2004,23(7):1516 ~ 1525.
[25] Yu Y, Chen Z, Li WG,et al. A Nonproton Ligand Sensor in the Acid-Sensing Ion Channel. Neuron, 2010,68(1):61 ~ 72.
EXPRESSION OF ASIC3 IN TRIGEMINAL NUCLEUS CAUDALIS IN A RAT MODEL OF CHRONIC MIGRAINE*
WANG Sha1, WU Bai-Xue1, LIU Chao-Yang1, QIN Guang-Cheng1, ZHOU Ji-Ying2, CHEN Li-Xue1Δ
(1Laboratory Research Center, The First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China2; Chongqing Key Laboratory of Neurology, Chongqing 400016, China)
Objective: The purpose of this study was to detect the expression of acid-sensing ion channel 3(ASIC3) in trigeminal nucleus caudalis (TNC) in a rat model of chronic migraine (CM) and to explore its role in the pathogenesis of chronic migraine. Methods: Sprague-Dawley male rats were randomly divided into 7 groups: They were Sham (n= 18), CM (n= 18), CM+DMSO (n= 5), CM+APETx2 5 μM(n= 5), CM+APETx2 10 μM (n= 5), CM+GMQ 100 μM (n= 5) and CM+GMQ 200 μM (n=5). Then the mechanical pain thresholds of periorbital and hindpaw were measured by Von Frey filaments.Real-time quantitative polymerase chain reaction (qRT-PCR) was used to examine the expression of ASIC3 mRNA. Expression of ASIC3 and CGRP protein were examined by Western blotting. Localization of ASIC3 and CGRP in TNC were examined by immuno fl uorescence. Results: (1) Mechanical pain thresholds of rats in periorbital and hindpaw were greatly decreased after repeatitive administration of "inflammatory soup"(P< 0.01). (2) ASIC3 expression in CM group was signi fi cantly higher than that in sham group (P< 0.05).(3) Mechanical pain threshold was significantly enhanced when treated with ASIC3 antagonist APETx2(P< 0.05), furthermore, the protein expression of CGRP was significantly reduced (P< 0.05). In addition,mechanical pain threshold was sharply decreased after activation of ASIC3 by its agonist GMQ, and the expression of CGRP was increased (P< 0.05). (4) Immunofluorescence assay showed that ASIC3 was mainly expressed in TNC neurons and was co-expressed with CGRP. Conclusion: ASIC3 protein levels is up-regulated in the TNC of chronic migraine rats and participates in the development of chronic migraine by regulating the changes of mechanical pain threshold and the expression of CGRP.
Chronic migraine; ASIC3; Trigeminal nucleus caudalis
10.3969/j.issn.1006-9852.2017.12.004
国家自然科学基金(No. 81671093, No. 81500957);重庆市渝中区科技计划项目(20160107)
△通讯作者 chenlixue@hospital.cqmu.edu.cn
