南极磷虾脂质的亚临界提取及磷脂分析
2017-12-11孙德伟陈洪建李进伟曹培让刘元法江南大学食品学院江苏无锡214122
孙德伟,李 波,陈洪建,李进伟,曹培让,刘元法(江南大学 食品学院,江苏 无锡 214122)
油脂加工
南极磷虾脂质的亚临界提取及磷脂分析
孙德伟,李 波,陈洪建,李进伟,曹培让,刘元法
(江南大学 食品学院,江苏 无锡 214122)
研究了南极磷虾脂质的亚临界丁烷提取工艺。测定了南极磷虾脂质的酸值、过氧化值、氟含量、生育酚含量、虾青素含量、磷脂含量及磷脂种类组成、脂肪酸组成。结果表明,通过单因素试验确定了亚临界丁烷提取南极磷虾脂质的较佳工艺条件为:动态提取时间120 min(单次提取时间30 min、提取4次)、提取压力1.0 MPa、提取温度40℃;在较佳工艺条件下南极磷虾脂质提取率为21.39%;提取的南极磷虾脂质的酸值(KOH)10.6 mg/g,过氧化值3.01 meq/kg,虾青素含量248.4 mg/kg,生育酚含量67.7 mg/kg,磷脂含量28.68%,其中磷脂中磷脂酰胆碱占71.20%;磷脂酰胆碱中脂肪酸组成与甘三酯的基本一致,但磷脂酰胆碱中EPA和DHA含量明显高于甘三酯的。
亚临界丁烷;南极磷虾;脂质;脂肪酸;磷脂
南极磷虾是具有世界上最大生物量的物种之一,可作为海鲜被直接食用,也可以作为鱼类食物或添加剂,但更为重要的是用于提取南极磷虾脂质等工业深加工的原料[1-2]。南极磷虾含水77.9%~83.1%、脂质0.4%~3.6%、蛋白质11.9%~15.4%,以及2.0%的甲壳素[3]。南极磷虾脂质富含n-3多不饱和脂肪酸(EPA和DHA)、磷脂和虾青素等功能性成分[4]。因此,南极磷虾及其脂质的开发和利用近年来受到广泛的研究。
南极磷虾脂质提取的原料有新鲜虾、冷冻虾、冷冻干燥虾或虾粉,脂质的提取方法主要包括溶剂提取和无溶剂提取。就溶剂提取而言,南极磷虾脂质通常由单一溶剂如丙酮、乙醇、正己烷等提取,但该法存在耗费时间长、效率不高、溶剂污染及物料中生物活性物质易被破坏等缺点。另有研究采取先丙酮后乙醇两步法溶剂提取[5-6],但两步法提取耗时较长、工业脱溶分离技术成本高。部分学者采用超临界二氧化碳夹带20%乙醇提取[7],但该方法提取之前需要先进行干燥,高温可能破坏南极磷虾中热敏成分。无溶剂提取有酶法提取[8]、超临界流体提取[9]等,但存在费用高问题。因此,目前亟需寻求一种经济、污染低和对脂质成分破坏性低的提取方法。
亚临界流体提取技术因其提取时压力低、温度低、效率高以及投资低,已被广泛应用于植物脂质[10-12]和动物脂质[13-14]的提取。亚临界流体提取技术应用于南极磷虾脂质的提取可以最大程度地减少氧化的发生,保护多不饱和脂肪酸、虾青素和生育酚等生物活性物质。本文以冷冻干燥南极磷虾为原料,采用亚临界流体丁烷提取技术分离制备南极磷虾脂质并检测其基本物性指标。利用硅胶柱层析对南极磷虾中的磷脂进行了分离;采用高效液相色谱对分离的磷脂组成进行分析,并采用气相色谱对甘三酯和磷脂酰胆碱的脂肪酸组成进行了分析。
1 材料与方法
1.1 实验材料
冰冻南极磷虾,实验室冷冻干燥后粉碎过40目筛,-40℃保存备用。脂肪酸、磷脂、生育酚标准品:美国西格玛公司;CBE-5L亚临界丁烷提取装置:河南亚临界生物技术有限公司;1100高效液相色谱仪、7820A气相色谱仪:美国安捷伦科技公司。
1.2 实验方法
1.2.1 南极磷虾及其脂质相关指标分析
南极磷虾水分(GB 5009.3—2010)、蛋白质(GB 5009.5—2010)、脂肪(GB/T 5009.6—2003)、灰分(GB 5009.4—2010)、氟元素(GB/T 5009.18—2003)、其他微量元素[15],脂质酸值(AOCS Cd 3d-63)、过氧化值(AOCS Cd 8-53)、生育酚含量(AOCS Ce 8-89)、氟含量(GB/T 5009.18—2003)、磷脂含量(AOCS Ja 7-86)和虾青素含量[16]参照相应方法测定。
1.2.2 亚临界丁烷提取南极磷虾脂质
工艺如下:冰冻南极磷虾→冷冻干燥(水分约8.0%)→粉碎过40目筛→亚临界丁烷提取。亚临界丁烷提取具体如下:将500 g南极磷虾粉用布袋封口放入提取罐,抽真空。按照料液比1∶5将亚临界丁烷泵入提取罐,外套热水循环控制提取温度,设定条件提取完成后将提取混合液导入分离罐减压蒸发分离目标物。多次提取后合并提取物,离心过滤称重。总脂质提取率=提取的脂质质量/物料质量×100%。
1.2.3 南极磷虾磷脂分离及分析
薄层色谱(TLC)进行磷脂分离,硅胶板,展开剂氯仿-丙酮-甲醇-乙酸-水(体积比50∶20∶10∶10∶5),刮板溶于氯仿提取后高效液相色谱(HPLC)分析,以氯仿-甲醇-水(体积比70∶30∶1)作为流动相进行洗脱,流速1.0 mL/min,进样量20 μL,根据峰面积进行定量。
1.2.4 脂肪酸组成分析
样品按Tang等[3]方法甲酯化,气相色谱(GC)检测。分析条件:初温60℃,保持3 min, 以5℃/min 升温至175℃,以2℃/min升温至220℃后保持;载气为高纯氦气,流速1.0 mL/min;进样量1 μL;进样口温度250℃;检测器温度150℃;整个分析过程为70 min。
2 结果与分析
2.1 南极磷虾基本组分
本实验采用低温空气自然解冻样品,对冰冻南极磷虾的基本指标进行了测定,并检测了南极磷虾中部分微量元素含量,结果见表1。

表1 南极磷虾部分微量元素含量(湿基) mg/kg
南极磷虾(湿基)含水80%、蛋白质12%、脂肪4.9%、灰分3%,以及丰富的铁、锌、硒等对人体有益的微量成分。由表1可知,南极磷虾(湿基)氟元素含量1 520 mg/kg,该结果与张海生等[17]报道的1 232 mg/kg 相近。南极磷虾主要成分随捕捞季节、性别、生长周期等有较大变化[18]。赵玲等[15]测定了南极磷虾20 种元素含量,结果显示钙、钠、钾、镁、铁、锌和硒等含量较高,钴、镍、铬、镉和铅等含量较低。本实验测定的微量元素含量结果与赵玲等[15]的检测结果基本一致。
2.2 亚临界丁烷提取条件确定
2.2.1 提取次数对提取率的影响
在提取温度40℃、单次提取时间30 min、提取压力1.0 MPa的条件下,考察不同提取次数对南极磷虾脂质提取率的影响,结果如图1所示。
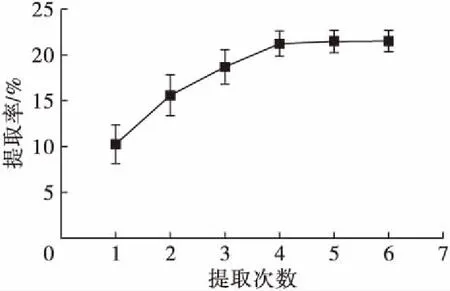
图1 提取次数对南极磷虾脂质提取率的影响
由图1可知,随着提取次数的增加,提取率呈增加趋势。从提取1次增至4次提取率增加明显,达到21.23%,从提取4次增至6次,动态提取时间由120 min增至180 min,提取率基本不变。基于简化操作流程、增加效率考虑,提取次数确定为4次。
2.2.2 单次提取时间对提取率的影响
在提取温度40℃、提取压力1.0 MPa、提取4次的条件下,考察不同单次提取时间对南极磷虾脂质提取率的影响,结果如图2所示。
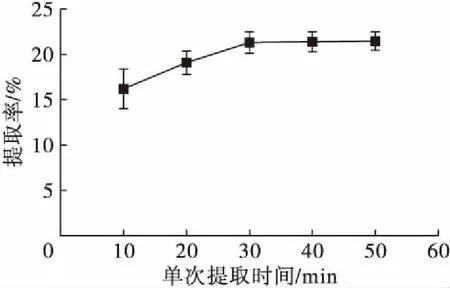
图2 单次提取时间对南极磷虾脂质提取率的影响
由图2可知,随着单次提取时间的延长,提取率呈增加趋势。单次提取时间由10 min延长至30 min时,提取率增至21.33%。随后单次提取时间逐渐延长至50 min,提取率增加不明显。提取次数和单次提取时间关联度较大,动态提取时间120 min,绝大部分脂质被提取出来(见图1)。若减少提取次数,延长单次提取时间,由于脂质在溶剂中存在饱和度,其效果不如更换新溶剂进行提取。综上,选择单次提取时间30 min,动态提取时间120 min作为本实验较佳条件。
2.2.3 提取温度对提取率的影响
在提取压力1.0 MPa、动态提取时间120 min(单次提取时间30 min,提取4次)条件下,考察不同提取温度对南极磷虾脂质提取率的影响,结果如图3所示。
由图3可知,随着提取温度升高,提取率呈现增加趋势。当提取温度由30℃升至40℃,提取率迅速增加至21.22%,继续升高提取温度,提取率基本保持不变。这是由于温度升高使亚临界丁烷的挥发性和扩散系数增大,可更好溶解脂质从而增加提取率;但在其他因素如提取压力、提取时间、提取次数不变的情况下,提取温度升高丁烷分子运动加速导致了其密度有所降低,对提取率有负面影响。此外,提取温度升高还会加速脂质中虾青素、生育酚、多不饱和脂肪酸等生物活性物质的分解,故提取温度宜选择40℃。

图3 提取温度对南极磷虾脂质提取率的影响
2.2.4 提取压力对提取率的影响
在提取温度40℃、动态提取时间120 min(单次提取30 min,提取4次)条件下,考察不同提取压力对南极磷虾脂质提取率的影响,结果如图4所示。

图4 提取压力对南极磷虾脂质提取率的影响
由图4可知,随着提取压力增大,提取率呈增加趋势。当提取压力由0.6 MPa升高至1.0 MPa时提取率迅速增加,当提取压力继续增加时提取率基本不变。这是因为亚临界状态下丁烷扩散性高、黏度低利于提取,但提取压力增大达到一定值后,提取罐内溶剂与溶质作用趋于平衡,提取率不再增加。此外,更高的提取压力也意味着更多的能量消耗,会增加设备运行成本。因此,提取压力确定为1.0 MPa。
在单因素实验基础上确定较佳亚临界丁烷提取条件为:动态提取时间120 min(单次提取时间30 min、提取4次),提取温度40℃,提取压力1.0 MPa。在较佳提取条件下,南极磷虾脂质提取率可达21.39%。
在较佳条件下提取的南极磷虾脂质酸值(KOH)(10.6 mg/g)和过氧化值(3.01 meq/kg)较高。比较了不同批次提取的南极磷虾脂质,其变化较大,这可能是因为原料在储藏和运输过程中,部分脂质被氧化成游离脂肪酸的缘故。亚临界丁烷提取南极磷虾脂质氟含量为1.5 mg/kg,低于我国对水产中氟元素限量2.0 mg/kg的要求(GB 2762—2005),可见氟元素主要残留在提余物中。亚临界丁烷制备的南极磷虾脂质中主要抗氧化性物质虾青素和生育酚含量分别为248.4 mg/kg和67.7 mg/kg。
2.3 亚临界丁烷提取南极磷虾脂质中磷脂分析
亚临界丁烷提取南极磷虾脂质中含有丰富的磷脂,通过TLC及HPLC对磷脂的种类组成和含量进行了分析,结果见表2。

表2 亚临界丁烷提取脂质中甘三酯及磷脂组成 %
由表2可知,亚临界丁烷提取南极磷虾脂质主要为甘三酯和磷脂,有3种磷脂被检出,其中磷脂酰胆碱占71.20%。曹文静等[19]采取正己烷无水乙醇混合溶剂提取的南极磷虾脂质中磷脂含量为29.13%,与本实验提取的南极磷虾脂质中的磷脂含量相近。
为进一步了解亚临界丁烷提取的南极磷虾脂质中的磷脂,利用GC对南极磷虾脂质中的甘三酯和磷脂中最主要成分磷脂酰胆碱的脂肪酸组成分别进行了检测,结果见表3。

表3 亚临界丁烷提取脂质中甘三酯及磷脂酰胆碱脂肪酸组成及含量 %
由表3可知,南极磷虾脂质的甘三酯和磷脂酰胆碱的脂肪酸组成基本一致,均主要由C16∶0、C18∶1、C20∶5(EPA)、C22∶6(DHA)组成。磷脂酰胆碱的脂肪酸中多不饱和脂肪酸高于甘三酯的,其中EPA和DHA总含量高约11个百分点。
由此可见,亚临界丁烷提取南极磷虾脂质具有较高的磷脂含量,其磷脂以磷脂酰胆碱为主,磷脂酰胆碱中EPA和DHA总含量达到了40.81%。这说明该法提取的南极磷虾脂质具有很好的应用前景。
3 结 论
研究了南极磷虾脂质的亚临界丁烷提取工艺,探讨提取次数、单次提取时间、提取温度及提取压力对南极磷虾脂质提取率的影响。采用硅胶柱层析及薄层色谱技术对磷脂进行了分离,利用高效液相色谱、气相色谱进一步对磷脂种类组成及脂肪酸组成进行分析。结果表明,亚临界丁烷提取南极磷虾脂质的较佳工艺条件为:动态提取时间120 min(单次提取时间30 min,提取4次),提取温度40℃,提取压力1.0 MPa;在较佳工艺条件下南极磷虾脂质提取率达21.39%。亚临界丁烷提取的南极磷虾脂质中磷脂含量较高,其中磷脂酰胆碱占71.20%。亚临界丁烷提取南极磷虾脂质甘三酯和磷脂酰胆碱的脂肪酸组成基本一致,但磷脂酰胆碱中EPA和DHA含量明显高于甘三酯的。
[1] OLSEN R E, SUONTAMA J, LANGMYHR E, et al. The replacement of fish meal with Antarctic krill,Euphausiasuperbain diets for Atlantic salmon,Salmosalar[J]. Aquacult Nutr, 2006, 12(4): 280-290.
[2] CHI H, LI X Y, YANG X S. Processing status and utilization strategies of Antarctic krill (Euphausiasuperba) in China[J]. World J Fish Marine Sci, 2013, 5(3):275-281.
[3] TANG B, TIAN M, ROW K H, et al. Optimized analytical conditions for eicosapentaenoic and docosahexaenoic acids in Antarctic krill using gas chromatography[J]. Anal Lett, 2012, 45(13): 1885-1893.
[4] GIGLIPTTI J C, DAVENPPRT M P, BEAMER, et al. Extraction and characterisation of lipids from Antarctic krill (Euphausiasuperba)[J]. Food Chem, 2011, 125(3): 1028-1036.
[5] BEAUDOIN A, MARTIN G. Method of extracting lipids from marine and aquatic animal tissues: US20046800299[P].2004-10-05.
[6] SAMPALIS T. Krill and/or marine extracts for prevention and/or treatment of cardiovascular diseases arthritis, skin cancer diabetes, premenstrual syndrome and transdermal transport: US20070098808[P].2007-05-03.
[7] BRUHEIM I, MANCINELLI D. Bioeffective krill oil compositions: US9072750[P].2015-07-07.
[8] 徐晓斌, 李俊玲, 杨阳,等. 南极磷虾油酶解法提取工艺研究[J]. 中国油脂, 2015, 40(5):5-8.
[9] ALI-NEHARI A, SEON-BONG K, YANG-BONG L, et al. Characterization of oil including astaxanthin extracted from krill (Euphausiasuperba) using supercritical carbon dioxide and organic solvent as comparative method[J]. Korean J Chem Eng, 2012, 29(3): 329-336.
[10] ZANQUI A B, DE MORAIS D R, DA SILVA C M, et al. Subcritical extraction of flaxseed oil withn-propane: composition and purity[J]. Food Chem, 2015, 188: 452-458.
[11] ZANQUI A B, DE MORAIS D R, DA SILVA C M, et al. Subcritical extraction ofSalviahispanicaL. oil withn-propane: composition, purity and oxidation stability as compared to the oils obtained by conventional solvent extraction methods[J]. J Braz Chem Soc, 2014, 26(2): 282-289.
[12] 张明, 万楚筠, 黄凤洪. 亚临界萃取菜籽脱皮低温压榨饼中油脂[J]. 中国油脂, 2015, 40(5):14-17.
[13] LIU K, WANG L, XUE C H, et al. Subcritical R134a extraction of euphausia pacifica oil and analysis of fatty acid composition[J]. Food Sci, 2013, 34(14): 96-99.
[14] LIU P, SHI J, SHEN S J. Subcritical fluid extraction of astaxanthin from shrimp and crab shell waste[J]. Fine Chem, 2011, 28(5): 497-500.
[15] 赵玲, 殷邦忠, 陈岩,等. 2种解冻方式的南极磷虾中20种元素含量分析[J]. 农产品加工(学刊),2014(3):37-39.
[16] TOLASA S, CAKLI S, OSTERMEYER U. Determination of astaxanthin and canthaxanthin in salmonid[J]. Eur Food Res Technol, 2005, 221(6): 787-791.
[17] 张海生, 夏卫平,程先豪,等.南大洋氟的生物地球化学研究I.南极磷虾富氟异常的研究[J].南极研究, 1991, 3(4):24-30.
[18] CRIPPS G C. Fatty acid content of Antarctic krillEuphausiasuperbaat South Georgia related to regional populations and variations in diet[J].Mar Ecol Prog Ser, 1999, 181: 177-188.
[19] 曹文静, 惠欢庆, 沈俊涛,等. 混合溶剂提取南极磷虾油的工艺研究[J]. 中国油脂, 2013, 38(12):6-9.
SubcriticalbutaneextractionofAntarctickrilllipidandphospholipidsanalysis
SUN Dewei, LI Bo, CHEN Hongjian, LI Jinwei, CAO Peirang, LIU Yuanfa
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China)
The subcritical butane extraction process of Antarctic krill lipid was studied, and the acid value, peroxide value, fluoride content, tocopherol content, astaxanthin content, phospholipid content and phospholipid species composition, fatty acid composition of Antarctic krill lipid were determined. The results showed that the better subcritical butane extraction conditions of Antarctic krill lipid were obtained by single factor experiment as follows: dynamic extraction time 120 min (single extraction time 30 min, extraction for four times), extraction pressure 1.0 MPa and extraction temperature 40℃. Under the better extraction conditions, the extraction rate of Antarctic krill lipid was 21.39%, and the acid value, peroxide value, astaxanthin content, tocopherol content and phospholipid content were 10.6 mgKOH/g, 3.01 meq/kg, 248.4 mg/kg, 67.7 mg/kg and 28.68%, respectively. The phosphatidylcholine (PC) accounted for 71.20% of phospholipid. The fatty acid composition in triglycerides (TAG) was almost the same as that in PC, but EPA content and DHA content in PC were significantly higher than that in TAG.
subcritical butane; Antarctic krill; lipid; fatty acid; phospholipid
2017-01-11;
2017-06-16
国家自然科学基金(31671786、31571878);国家“十三五”重点研发项目(2016YFD0401404);苏北科技专项(BN2016137)
孙德伟(1980),男,助理研究员,在读博士,研究方向为粮食、油脂及植物蛋白工程(E-mail)sundewei1912@163.com。
刘元法,教授,博士生导师(E-mail)yfliu@jiangnan.edu.cn。
TS224;TQ644
A
1003-7969(2017)10-0001-05
