木糖醇月桂酸单酯的酶法制备工艺研究
2017-12-11任娜娜赵晨伟唐年初江南大学食品学院江苏无锡214122
任娜娜,赵晨伟,唐年初(江南大学 食品学院,江苏 无锡214122)
木糖醇月桂酸单酯的酶法制备工艺研究
任娜娜,赵晨伟,唐年初
(江南大学 食品学院,江苏 无锡214122)
研究了以木糖醇和月桂酸为原料,在固定化脂肪酶Novozym 435的催化下合成木糖醇月桂酸单酯。考察了酸醇摩尔比、脂肪酶添加量、溶剂添加量、分子筛添加量、反应时间、反应温度对反应的影响。结果表明:最佳反应条件为反应溶剂为叔丁醇、酸醇摩尔比1∶2、溶剂添加量20 mL/mmol(以月桂酸物质的量计)、脂肪酶添加量10 g/L、分子筛添加量80 g/L、反应温度85 ℃、反应时间4 h,在此条件下月桂酸转化率为91.8%。通过红外光谱和质谱进行结构鉴定,产物为木糖醇月桂酸单酯。
木糖醇;月桂酸;木糖醇月桂酸单酯;脂肪酶;结构鉴定
糖醇酯分子中同时具有亲油和亲水基团,是一类典型的非离子型表面活性剂[1]。与离子型表面活性剂相比,糖醇酯除具有优良的表面活性外,还具有易生物降解性、良好的生物相容性、无刺激及无毒性等特点,且能用可再生的资源以清洁的方法制备,是一类对环境友好的表面活性剂[2]。此外,一些糖醇酯及其衍生物还具有抑菌、抗病毒及抗肿瘤等生物活性[3]。糖醇酯应用广泛,可作为乳化剂、增稠剂、稳定剂、分散剂、黏结剂、洗涤剂和增泡剂等应用于食品、化妆品、医药、洗涤剂和化工等行业中[4-6],在人类生活中发挥着越来越广泛的作用。随着糖醇酯新的理化性质及生物特性的发现,其应用前景愈发广阔。现在,商业化的糖醇酯多通过化学方法合成,通常存在反应条件剧烈、副反应多、产品难分离纯化、产品色泽较深、污染大、能耗高等弊端,增加了生产成本[7-8]。随着人们对天然、绿色添加剂的青睐,温和可控、选择性高的酶促合成方法已成为研究的热点[9]。
本文利用脂肪酶Novozym 435为催化剂合成木糖醇月桂酸单酯,并对影响反应的主要因素(酸醇摩尔比、脂肪酶添加量、溶剂添加量、分子筛添加量、反应时间、反应温度)进行考察,确定最佳的合成工艺,并利用红外光谱和质谱对反应产物进行结构鉴定,以期为木糖醇月桂酸单酯连续化生产提供理论依据。
1 材料与方法
1.1 实验材料
木糖醇、月桂酸、叔丁醇、正己烷、氯化钠,分析纯;甲醇,色谱纯;4 Å分子筛;脂肪酶 Novozym 435:诺维信中国生物技术有限公司。
ZKXF型真空干燥箱;TG18G台式高速离心机;Waters Platforn ZMD 4000质谱仪:美国 Waters 公司;Nicolet Nexus 470 FTIR傅里叶红外光谱仪:美国Thermo Electron公司。
1.2 实验方法
1.2.1 无水溶剂的制备
参照胡佳文[10]制备山梨醇脂肪酸酯的方法制备无水溶剂。将4 Å分子筛置于马弗炉中,250℃活化6 h,取出冷却,置于干燥器中待用。取适量的活化分子筛加到叔丁醇中,脱水48 h,以制备无水溶剂。
1.2.2 木糖醇月桂酸单酯的制备
称取一定量的木糖醇和月桂酸溶于叔丁醇无水溶剂中,置于50℃的恒温水浴中振荡(300 r/min)预热30 min,然后加入固定化脂肪酶和4 Å分子筛,于一定温度下反应一定时间[6]。反应结束后,停止加热,过滤除去脂肪酶、4 Å分子筛,饱和食盐水洗去未反应的木糖醇,旋转蒸发除去溶剂,通过正己烷离心除去产物中剩余的月桂酸,真空干燥得样品,备用。
1.2.3 定量分析及计算
参照彭冬梅等[11]及Adnani等[12]的方法,略有改动。以酚酞为指示剂,用0.1 mol/L的NaOH标准溶液滴定反应液,按下式以月桂酸的减少量计算月桂酸转化率。
100%
式中:m为月桂酸的质量,g;M月桂酸为月桂酸的摩尔质量,200 g/mol;CNaOH为NaOH溶液的浓度,mol/L;VNaOH为滴定反应中消耗的NaOH溶液的体积,mL。
1.2.4 定性分析
1.2.4.1 红外光谱分析(FTIR)
采用KBr压片法,对木糖醇月桂酸单酯进行FTIR分析,扫描次数64次,扫描范围为4 000~500 cm-1,分辨率为4 cm-1。
1.2.4.2 质谱分析(MS)
质谱条件:电喷雾离子化源,离子方式ES+,电喷雾电压3.50 kV,锥孔电压20 V,离子源温度120℃,碰撞能量20 eV,质量扫描范围(m/z)50~1 000,脱溶剂气流速500 L/h。
2 结果与讨论
2.1 酸醇摩尔比对反应的影响
在月桂酸添加量1.5 mmol、溶剂添加量16.7 mL/mmol(以月桂酸物质的量计,下同)、脂肪酶添加量8 g/L、分子筛添加量55 g/L、反应温度55℃、反应时间4 h的条件下,改变木糖醇的添加量,考察酸醇摩尔比对反应的影响,结果如图1所示。

图1 酸醇摩尔比对反应的影响
由图1可以看出,酸醇摩尔比对月桂酸转化率的影响很大,在酸醇摩尔比为1∶2时,月桂酸转化率达到最高,为64.9%。这可能是由于月桂酸过多导致传质产生阻力,使月桂酸转化率较低,且过量的月桂酸会使产物不断向二酯甚至多酯转化,不利于木糖醇月桂酸单酯的合成,因此应选择较高的酸醇摩尔比进行反应,但发现酸醇摩尔比大于1∶2后,月桂酸转化率略有下降。因此,选择酸醇摩尔比1∶2,即木糖醇添加量3 mmol进行反应。
2.2 脂肪酶添加量对反应的影响
在月桂酸添加量1.5 mmol、木糖醇添加量3 mmol、溶剂添加量16.7 mL/mmol、分子筛添加量55 g/L、反应温度55℃、反应时间4 h的条件下,考察脂肪酶添加量对反应的影响,结果如图 2所示。
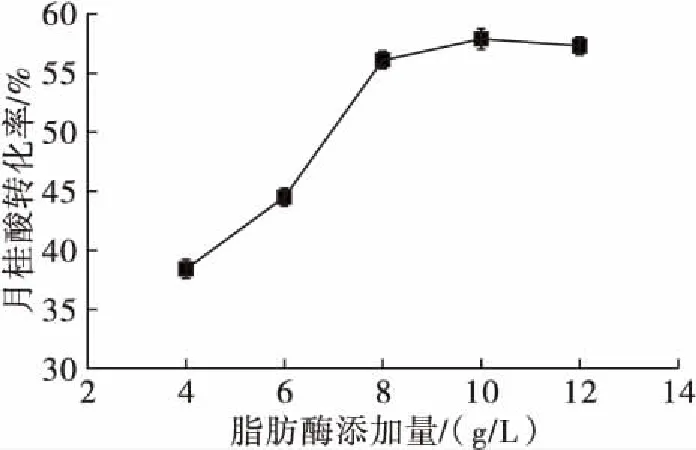
图2 脂肪酶添加量对反应的影响
由图2可以看出,脂肪酶添加量在4~10 g/L时,月桂酸转化率随脂肪酶添加量的增加而增大,但脂肪酶添加量增加到10 g/L后,转化率变化趋于平缓。当脂肪酶添加量为10 g/L时,催化效果最好,月桂酸转化率为59.7%。这是因为反应初始阶段,底物充足,脂肪酶浓度越高,反应速率越快,产物的生成速率越大,月桂酸转化率越高。但是当反应趋于平衡时,在相同条件下,增加脂肪酶的添加量,反应速率不会再增大,因此月桂酸转化率趋于平缓。
2.3 溶剂添加量对反应的影响
在月桂酸添加量1.5 mmol、木糖醇添加量3 mmol、脂肪酶添加量8 g/L、分子筛添加量55 g/L、反应温度55℃、反应时间4 h的条件下,考察溶剂添加量对反应的影响,结果如图 3所示。
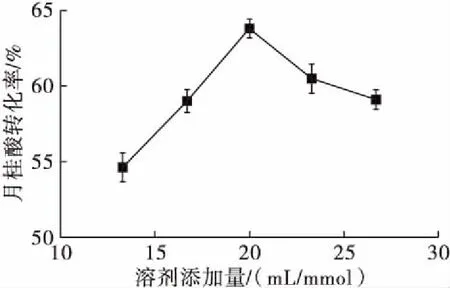
图3 溶剂添加量对反应的影响
由图3可以看出,随着溶剂添加量的增加,月桂酸转化率明显提高。当溶剂添加量为 20 mL/mmol时,月桂酸转化率达到最高,为63.8%。这是因为过少的溶剂量会使反应在比较黏稠的状态下进行,而且不利于脂肪酶的催化反应效果。而过量的溶剂会破坏脂肪酶的结构,使酶活性降低,从而使酶的催化效率降低。故在本实验中适宜的溶剂添加量为20 mL/mmol,此时反应混合物处于良好的流动状态及较高的酶催化效率,月桂酸转化率也较高。
2.4 分子筛添加量对反应的影响
在月桂酸添加量1.5 mmol、木糖醇添加量3 mmol、溶剂添加量16.7 mL/mmol、脂肪酶添加量8 g/L、反应温度55℃、反应时间4 h的条件下,考察分子筛添加量对反应的影响,结果如图 4所示。
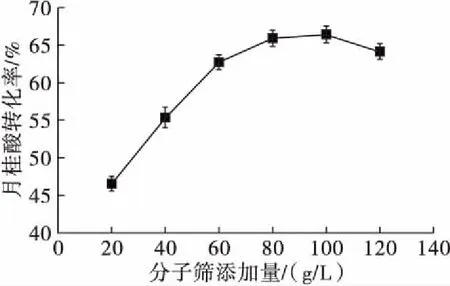
图4 分子筛添加量对反应的影响
由图4可以看出,分子筛添加量影响月桂酸转化率。分子筛添加量由20 g/L增加到100 g/L时,月桂酸转化率由47.8%快速增大到66.4%,分子筛添加量大于100 g/L时,月桂酸转化率降低。这是因为添加分子筛会快速吸附酯化反应所生成的水,使反应正向进行,转化率升高;但分子筛过量,会争夺酶催化合成所必需的水分,导致脂肪酶部分失活,因此高浓度的分子筛会使月桂酸转化率降低。该实验结果和Lozano等[13]的研究结果类似。同时发现,分子筛添加量为80 g/L时的月桂酸转化率与100 g/L的差不多,因此从成本等方面综合考虑,选择80 g/L作为最佳分子筛添加量。
2.5 反应时间对反应的影响
在月桂酸添加量1.5 mmol、木糖醇添加量3 mmol、溶剂添加量16.7 mL/mmol、脂肪酶添加量8 g/L、分子筛添加量55 g/L、反应温度55℃的条件下,考察反应时间对反应的影响,结果如图5所示。
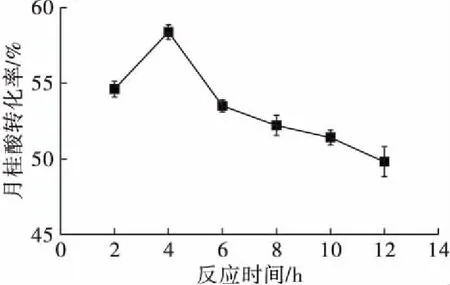
图5 反应时间对反应的影响
由图5可以看出,月桂酸转化率随反应时间的延长先增大后减小。反应时间在4 h时月桂酸转化率最高,为59.4%。这可能是由于在反应初始阶段,主要发生酯化反应,月桂酸转化率升高。随着反应进一步进行,酯化反应生成的副产物水增加到一定浓度,逆反应速率加快,造成转化率降低。
2.6 反应温度对反应的影响
在月桂酸添加量1.5 mmol、木糖醇添加量3 mmol、溶剂添加量20 mL/mmol、脂肪酶添加量10 g/L、分子筛添加量80 g/L、反应时间4 h的条件下,考察反应温度对反应的影响,结果如图6所示。
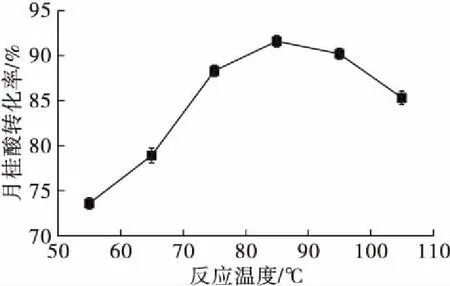
图6 反应温度对反应的影响
由图6可以看出,当反应温度从55℃逐渐升高到85℃时,月桂酸转化率显著提高,85℃时转化率达到最高,为91.8%,这是因为反应温度升高,酶活力增大,反应速率加快,转化率升高;随后随着反应温度的继续升高,月桂酸转化率开始下降。这是由于随反应温度的不断升高,部分脂肪酶变性失活导致转化率降低。故本实验选择85℃作为反应的最适温度。
2.7 定性分析

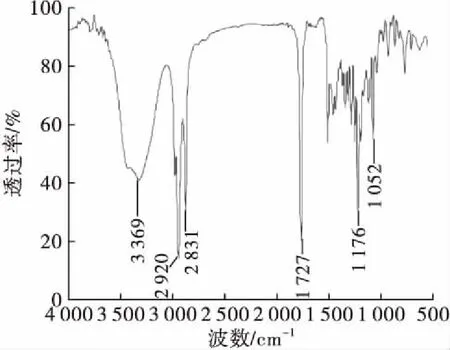
图7 木糖醇月桂酸单酯的FTIR图
木糖醇月桂酸单酯的质谱图如图8所示。由图8可以看出,产物离子峰m/z为357.0[M+Na]+和m/z为691.1[2M+Na]+,而木糖醇月桂酸单酯的相对分子质量为334,故判断质谱上的离子峰分别为1个木糖醇月桂酸单酯的离子结合1个Na+及2个木糖醇月桂酸单酯的离子结合1个Na+。即产物为木糖醇月桂酸单酯。这一结果与麦芽糖醇脂肪酸酯的酶催化合成[5]及甘露醇辛酸二酯的酶法合成[15]中的质谱结果类似。
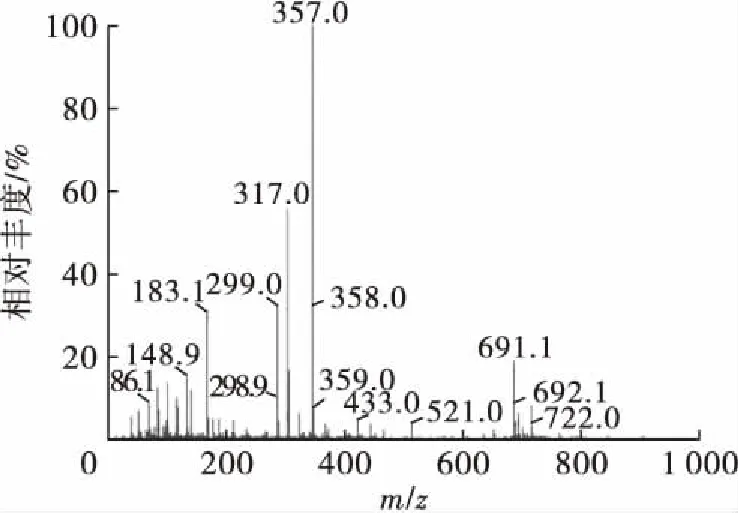
图8 木糖醇月桂酸单酯的质谱图
3 结 论
采用固定化脂肪酶Novozym 435催化木糖醇和月桂酸合成木糖醇月桂酸单酯的最佳条件为反应溶剂为叔丁醇、酸醇摩尔比1∶2、溶剂添加量20 mL/mmol、脂肪酶添加量10 g/L、分子筛添加量80 g/L、反应温度85℃、反应时间4 h,在此条件下月桂酸转化率为91.8%。通过傅里叶红外光谱与质谱分析表明,合成的产物为木糖醇月桂酸单酯。
[1] 张灏, 彭冬梅, 金冲, 等. 山梨醇月桂酸酯的酶法制备工艺研究[J]. 中国粮油学报, 2010, 25(11): 66-68.
[2] GANSKE F, BORNSCHEUER U T. Optimization of lipase-catalyzed glucose fatty acid ester synthesis in a two-phase system containing ionic liquids andt-BuOH[J]. J Mol Catal B Enzym, 2005(36): 40-42.
[3] FURUKAWA S, AKIYOSHI Y. Sugar fatty acid esters inhibit biofilm formation by food-borne pathogenic bacteria[J]. Int J Food Microbiol, 2010, 138(1/2): 176-180.
[4] ADNANI A, BASRI M, CHAIBAKHSH N, et al. Artificial neural network analysis of lipase-catalyzed synthesis of sugar alcohol ester[J]. Ind Crop Prod, 2011, 33(1): 42-48.
[5] 张灏, 王振虎, 彭冬梅. 麦芽糖醇脂肪酸酯的酶催化合成及表面张力测定[J]. 食品科学, 2010, 31(18):153-156.
[6] 段岢君, 张玉峰, 陈卫军, 等. 非水相中酶法合成月桂酸木糖酯[J]. 中国油脂, 2015, 40(3):79-82.
[7] MCGRANE P, BORDEN G W, WUESTHOFF M T, et al. Method for the direct esterification of sorbitol with fatty acids: US7151186[P]. 2006-12-19.
[8] 周世英, 苏本庆, 崔建国. 木糖醇亚油酸酯及其制备方法和应用: CN101386609[P]. 2009-03-18.
[9] 张桂菊, 徐宝财, 赵秋瑾, 等. 酶催化法合成食品乳化剂的研究进展[J]. 食品安全质量检测学报, 2014, 13(1): 115-122.
[10] 胡佳文. 酶法合成山梨醇脂肪酸酯的研究[D].北京:北京化工大学, 2012.
[11] 彭冬梅, 张灏, 王振虎. 麦芽糖醇棕榈酸酯的酶催化合成及其表面活性[J]. 食品工业科技, 2011(11): 358-360.
[12] ADNANI A, BASRI M, CHAIBAKHSH N, et al. Lipase-catalyzed synthesis of a sugar alcohol-based nonionic surfactant[J]. Asian J Chem, 2011, 23(1): 388-392.
[13] LOZANO P, DIEGO T D, CARRIÉ D, et al. Enzymatic ester synthesis in ionic liquids[J]. J Mol Catal B Enzym, 2003, 21(1/2):9-13.
[14] 付敏, 赵强忠, 仇超颖,等. 果糖月桂酸单酯的分离纯化及鉴定[J]. 食品工业科技, 2012, 33(22):276-279.
[15] 张晓慧. 甘露醇辛酸二酯的酶法合成及应用[D].江苏 无锡:江南大学, 2016.
Enzymaticpreparationofmonolauroylxylitol
REN Nana, ZHAO Chenwei, TANG Nianchu
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China)
The monolauroyl xylitol was synthesized from xylitol and lauric acid with Novozym 435 as catalyst. The effects of molar ratio of lauric acid to xylitol, dosage of lipase, dosage of solvent, dosage of molecular sieve, reaction time and reaction temperature on the reaction were investigated and the reaction conditions were optimized. The results showed that the optimal reaction conditions were obtained as follows: withtert-butyl alcohol as solvent, molar ratio of lauric acid to xylitol 1∶2, dosage of lipase 10 g/L, dosage of solvent 20 mL/mmol(based on amount of lauric acid), dosage of molecular sieve 80 g/L, reaction time 4 h and reaction temperature 85℃. Under these conditions, the conversion rate of lauric acid was 91.8%. The product was identified as monolauroyl xylitol by infrared spectroscopy and mass spectrometry.
xylitol; lauric acid; monolauroyl xylitol; lipase; structure identification
2017-01-10;
2017-06-17
任娜娜(1991),女,硕士研究生,主要从事油脂方面的研究工作(E-mail)15505296883@163.com。
唐年初,副教授,博士(E-mail)tangnc@126.com。
油脂化学
TS202.3;Q814.4
A
1003-7969(2017)10-0039-04
