视神经脊髓炎合并1型糖尿病并发低血糖昏迷一例并文献复习*
2017-12-06赵致慷寿纪菲刘洪波
赵致慷,寿纪菲,彭 静,王 芮,刘洪波
视神经脊髓炎合并1型糖尿病并发低血糖昏迷一例并文献复习*
赵致慷,寿纪菲,彭 静,王 芮,刘洪波#
视神经脊髓炎;1型糖尿病;低血糖;自身免疫性疾病
视神经脊髓炎(neuromyelitisoptica,NMO)是一种主要累及视神经和脊髓的自身免疫性中枢神经系统炎性脱髓鞘疾病[1-2]。1型糖尿病(type 1 diabetes mellitus,T1DM)也是一种自身免疫性疾病,异常的自身免疫介导选择性胰岛B细胞损伤,以致胰岛素分泌绝对不足和糖代谢紊乱[3-4]。T1DM治疗不当或不及时会出现严重的并发症,其中以酮症酸中毒和低血糖症最为多见[5]。现将2017年2月郑州大学第一附属医院神经内科收治的NMO合并T1DM且并发低血糖昏迷1例,报道如下。
1 临床资料
1.1病史摘要患者,女,22岁,以“视物模糊8月余,左上肢麻木4月余,加重1 d”为主诉入院。患者8个月前无明显诱因出现左眼视物模糊,未给予特殊治疗,4个月前逐渐出现左上肢麻木。就诊于当地市人民医院,给予“维生素B1片20 mg/次,3次/d,口服;甲钴胺分散片 0.5 mg,3次/d,口服;泼尼松片10 mg,3次/d,口服”,效果不佳。转入作者所在医院神经内科行脑MRI+颈椎MRI检查,诊断意见:颈髓及颈1~7椎体水平脊髓内异常信号,考虑炎症或缺血改变。按“NMO”治疗后症状好转出院,遗留左眼视力下降,仅有光感,左上肢和左侧面部痛觉减退,余无明显不适。4个月后因注射胰岛素过量出现低血糖昏迷,伴大小便失禁,意识恢复后自觉左下肢小腿发胀疼痛,伴双下肢无力行走不能,再次收入作者所在医院治疗。
患者有T1DM史12 a,目前使用30/70混合重组人胰岛素针15 U、10 U、14 U早中晚餐前30 min皮下注射,重组甘精胰岛素14 U睡前皮下注射,未系统监测血糖。
1.2神经系统查体神志清,精神可,高级智能活动正常。双侧瞳孔等大等圆,左眼视力仅有光感,余颅神经未见明显异常。四肢肌肉无萎缩,四肢肌张力正常,双上肢肌力5级,双下肢轻瘫试验阳性,双侧指鼻试验可,快复轮替试验正常,双侧跟膝胫试验可,Romberg征欠配合。无不自主运动,走“一”字欠配合。左侧面部和左上肢痛觉减退,左侧膝关节平面以下痛觉过敏,右侧病理征可疑阳性。
1.3实验室检查脑脊液水通道蛋白4(AQP-4)抗体10.534 U/mL;脑脊液电泳:脑脊液IgG 74.00 mg/L,脑脊液白蛋白442.50 mg/L,ALB商值10.71,24 h脑脊液IgG合成率10.17。糖化血红蛋白8.40%,血清葡萄糖 16.15 mmol/L,尿酮体,尿蛋白+,D-二聚体 19.060 g/mL,胰岛细胞抗体(ICA)(+),胰岛素自身抗体(IAA)(+)。
1.4其他辅助检查神经电生理检查EMG示:四肢被检肌及神经周围运动及末梢感觉传导功能未见异常;双胫神经H反射潜伏期未见异常。MEP示:左下肢椎体束传导功能未见异常;四肢脊髓刺激周围段传导未见异常。SEP示:左上肢深感觉传导路N20传导潜伏期延迟,波幅下降;右上肢深感觉传导路N20传导未见异常;双下肢深感觉传导路P40传导未见异常。BAEP示:双耳Ⅰ、Ⅲ、Ⅴ各波潜伏期及Ⅰ-Ⅲ、Ⅲ-Ⅴ、Ⅰ-Ⅴ波间值未见异常。VEP-P示:双眼潜伏期P100潜伏期延迟(左侧显著),波幅未见异常。
眼科视野检查:右眼视野大致正常,左眼颞侧及壁下侧视野缺损,眼底照相左眼视盘颞侧色淡;F-VEP检查:右眼P2波潜伏期、波幅正常,左眼P2波潜伏期正常,波幅下降;F-ERG检查:双眼明适应、30 Hz反应波幅轻度下降,余反应、波幅正常。影像学检查结果见图1。
1.5治疗及预后随访入院后给予甲泼尼松龙500 mg/d静脉滴注,连用3 d,患者症状有所好转,减半量继续使用3 d后改为泼尼松60 mg口服并逐步减量,患者共住院10 d,出院时除左眼视力遗留缺损外,四肢肌力、感觉均恢复正常,可正常行走。于院中行硫唑嘌呤药物敏感基因检测,结果显示对硫唑嘌呤药物敏感,嘱出院后继续接受硫唑嘌呤联用泼尼松药物治疗,严格控制血糖。1.5个月后电话随访,患者血糖控制良好,病情未见反复。
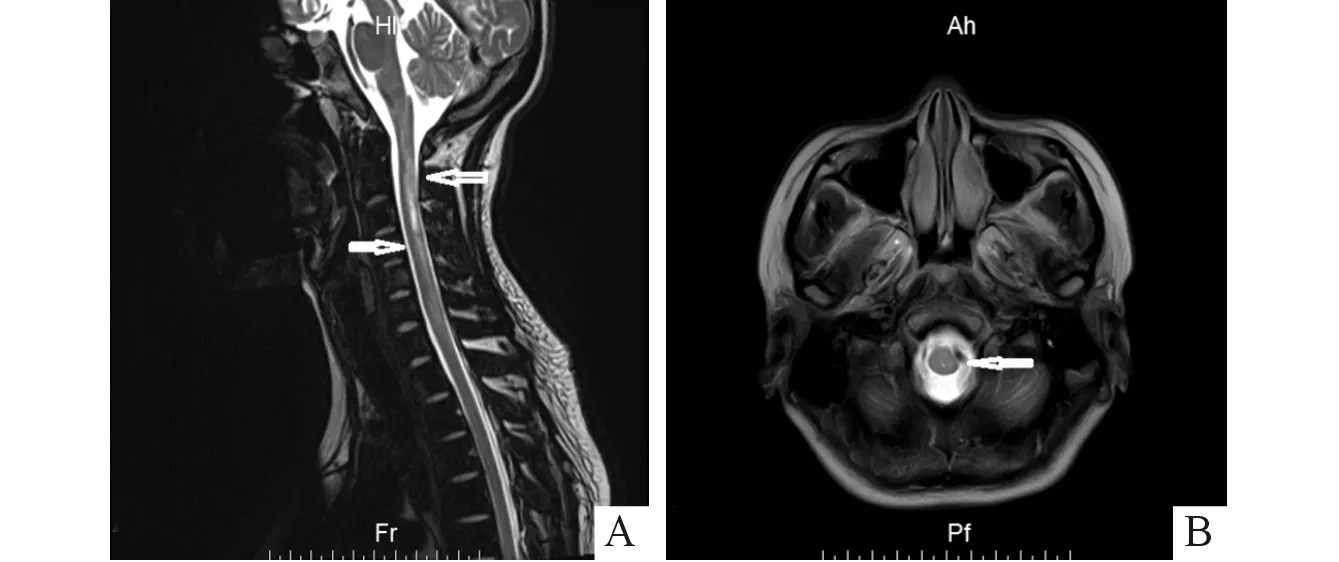
A:颈椎MRI,T2WI颈1-7椎体水平脊髓内可见条片状及斑片状异常信号;B:脑MRI,延髓可见小片状长T2信号。图1 影像学检查结果
2 讨论
此例患者根据新修订的NMO诊断标准可以明确诊断为NMO[1-2]。同时,该患者年轻起病,临床“三多一少”症状明显,血糖、尿糖、尿酮体、糖化血红蛋白均升高,胰岛自身抗体阳性,T1DM的诊断较明确[5]。NMO可伴有一些自身免疫性疾病,如自身免疫性甲状腺疾病、系统性红斑狼疮、重症肌无力等[6-8],而有关其合并T1DM的病例尚未见明确报道。
NMO的发病机制尚不完全清楚,其主要机制可能为抗体介导的异常免疫反应。AQP4抗体与星型胶质细胞AQP4结合,诱发抗体依赖的细胞毒性反应,同时激活补体,诱发补体依赖的细胞毒性,最终导致星型胶质细胞溶解,继发少突胶质细胞损害,脱髓鞘。T细胞介导的细胞免疫也常参与NMO的发病,NMO患者AQP4特异性T细胞显著增加。此外,体液及细胞免疫反应过程中可产生多种细胞因子,如白细胞介素-17等,导致炎性细胞在病灶聚集,释放干扰素、IL-6等,加重组织损伤[9]。与之相似,T1DM病因尚未阐明,自身免疫异常同样是其最主要的致病因素。CD4+辅助T细胞和CD8+细胞毒性T细胞作用于胰岛B细胞表面抗原,介导B细胞溶解破坏,最终使胰岛内绝大多数B细胞破坏缺如,导致胰岛素分泌缺乏。B 淋巴细胞为重要的抗原递呈细胞,既能产生自身抗体,又能将抗原递呈给抗原特异性T细胞,血液中的B细胞迁移到胰腺周围淋巴结,同时胰岛中的B细胞能促进CD8+T淋巴细胞向细胞毒性T细胞转化,加速了T1DM的进程。多种细胞因子如IL-17、干扰素、IL-6、肿瘤坏死因子α等也参与了T1DM的致病[10-11]。胰岛自身抗体的检测对于 T1DM 的预测和诊断同样具有很重要的意义,常见的抗体有ICA、IAA、谷氨酸脱羧酶65抗体等[12]。因此,细胞免疫、体液免疫及多种细胞因子均参与了NMO和T1DM的发病过程。
低血糖是T1DM最常见的并发症之一,其临床表现多种多样。轻者表现为心悸、手抖、出汗等交感-肾上腺素神经兴奋症状;重者以中枢神经症状及其他非特异性症状为表现,包括低血糖昏迷、行为障碍、偏瘫、抽搐等[13]。严重低血糖可造成中枢神经系统不同程度损害,其病理损伤多发生在脑部,甚至出现低血糖脑病[14],但有关其造成脊髓损伤的报道较少。感染、注射疫苗、妊娠等是NMO较为常见的诱因[15-16]。此例患者发生低血糖昏迷后,出现明显脊髓炎表现,与未患NMO前有明显区别,故严重的低血糖也可能是NMO发病或复发的潜在诱因之一。
总之,这一病例提示NMO和T1DM在一定程度上有着共同的致病机制,细胞免疫、体液免疫及多种细胞因子均参与了二者的致病,多种自身抗体也在二者的发病过程中发挥着关键作用。临床管理方面应密切关注降糖药物的使用,切实避免糖尿病患者低血糖昏迷症状的发生,尤其是在患者并发NMO等中枢神经系统疾病的情况下,以免加重患者原有的神经系统损伤。
[1] WINGERCHUK DM,BANWELL B,BENNETT JL,et al.International consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J].Neurology,2015,85(2):177
[2] 中国免疫学会神经免疫学分会,中华医学会神经病学分会神经免疫学组,中国医师协会神经内科分会神经免疫专业委员会.中国视神经脊髓炎谱系疾病诊断与治疗指南[J].中国神经免疫学和神经病学杂志,2016,23(3):155
[3] 中华医学会糖尿病学分会.中国1型糖尿病诊治指南:节选[J].糖尿病天地(临床),2013,7(3):108
[4] 邓武权,吴惠玲,陈兵.胰岛细胞的发育、再生与置换[J].解放军医学杂志,2011,36(11):1240
[5] MALIK FS,TAPLIN CE.Insulin therapy in children and adolescents with type 1 diabetes[J].Paediatr Drugs,2014,16(2):141
[6] FREITAS E,GUIMARES J.Neuromyelitis optica spectrum disorders associated with other autoimmune diseases[J].Rheumatol Int,2015,35(2):243
[7] 张遥,费允云,牛婧雯,等.合并结缔组织病的视神经脊髓炎谱系疾病回顾性研究[J].中华医学杂志,2014,94(39):3056
[8] 岳孟龙,刘沛东,刘洪波,等.系统性红斑狼疮合并视神经脊髓炎2例及文献复习[J].郑州大学学报(医学版),2014,49(3):422
[9] PEREIRA WL,REICHE EM,KALLAUR AP,et al.Epidemiological, clinical, and immunological characteristics of neuromyelitis optica:a review[J].J Neurol Sci,2015,355(1/2):7
[10]SZABLEWSKI L.Role of immune system in type 1 diabetes mellitus pathogenesis[J].Int Immunopharmacol,2014,22(1):182
[11]李桂梅.1型糖尿病与自身免疫性多腺体综合征[J].中华实用儿科临床杂志,2015,30(20):1531
[12]许建萍,肖新华.1型糖尿病的免疫学研究进展[J].中华糖尿病杂志,2013,5(2):114
[13]舒刚明,孟晓落,蔡笑,等.糖尿病继发低血糖58例临床表现分析[J].中国现代医学杂志,2003,13(2):69
[14]连立飞,李杜娟,黄丽娜,等.低血糖脑病的临床和神经影像学特点[J].临床神经病学杂志,2010,23(1):21
[15]王金涛,周广喜,郭筱菲.复发性视神经脊髓炎临床特征及预后分析[J].中国现代神经疾病杂志,2010,10(2):267
[16]HUANG Y,WANG Y,ZHOU Y,et al.Pregnancy in neuromyelitis optica spectrum disorder:a multicenter study from South China[J].J Neurol Sci,2017,372:152
(2017-02-16收稿 责任编辑徐春燕)
10.13705/j.issn.1671-6825.2017.06.029
*河南省科技攻关项目 142102310057
郑州大学第一附属医院神经内科 郑州 450052
#通信作者,男,1965年10月生,博士,教授,主任医师,研究方向:神经免疫性疾病的基础与临床,E-mail:liuhongbo6279@126.com
