20(S)-原人参二醇通过调控miRNA-19b诱导乳腺癌MCF-7细胞凋亡的观察*
2017-12-06杨晓艳覃熙媛罗志勇
杨晓艳,覃熙媛,李 楠, 罗志勇,杨 芳#
20(S)-原人参二醇通过调控miRNA-19b诱导乳腺癌MCF-7细胞凋亡的观察*
杨晓艳1,2),覃熙媛3),李 楠1), 罗志勇3),杨 芳1)#
MCF-7细胞;20(S)-原人参二醇;miRNA-19b;TNFα;凋亡
目的:研究20(S)-原人参二醇[20(S)-PPD]通过调控miRNA-19b的表达诱导乳腺癌MCF-7细胞凋亡以及相关作用的机制。方法采用MTT比色法检测30、40、50、60、70、80 μmol/L 20(S)-PPD处理48 h对MCF-7细胞存活率的影响;real-time PCR检测30、50、80 μmol/L 20(S)-PPD处理MCF-7细胞48 h后miRNA-19b相对表达量的变化;DNA甲基化转移酶(DNMT)活性检测试剂盒检测30、50、80 μmol/L 20(S)-PPD处理MCF-7细胞48 h对DNMT活性的影响。将MCF-7细胞分成瞬时转染miRNA阴性对照模拟物+空白培养液组、瞬时转染miRNA-19b模拟物+20(S)-PPD组、瞬时转染miRNA-19b模拟物+空白培养液组、瞬时转染miRNA阴性对照模拟物+20(S)-PPD组,real-time PCR检测4组细胞miRNA-19b表达量的变化,Western blot检测4组细胞中TNFα蛋白表达量的变化,流式细胞术检测4组细胞的凋亡率。结果20(S)-PPD可剂量依赖性地降低MCF-7细胞的存活率。随着20(S)-PPD剂量的升高,miRNA-19b的表达量降低(P<0.05)。80 μmol/L的20(S)-PPD可增强DNMT活性(P<0.05)。转染miRNA-19b模拟物后,miRNA-19b的表达量上升,TNFα蛋白的表达受到抑制,细胞凋亡率降低; 而加入65 μmol/L 20(S)-PPD后,miRNA-19b的表达下调,TNFα蛋白的表达上调,细胞凋亡率升高(P<0.05)。结论20(S)-PPD可能通过甲基化作用抑制miRNA-19b的表达,进而促进TNFα的表达,诱导MCF-7细胞凋亡。
乳腺癌是发生在乳腺上皮组织的恶性肿瘤[1],恶性程度不一,严重危害妇女身心健康。随着乳腺癌综合治疗的开展,乳腺癌病死率呈下降趋势。20(S)-原人参二醇[20(S)-protopanaxadiol, 20(S)-PPD]属于异戊二烯单元三帖醇皂苷类中的二醇型皂元,是二醇型皂苷经微生物降解后的终产物[2-3],对人类乳腺癌[4-5]、卵巢癌[6]、前列腺癌[7]等多种肿瘤细胞有抑制作用。现在,DNA启动子异常甲基化是哺乳动物基因组改变导致肿瘤发生的最常见的一种表观遗传学事件[8]。DNA甲基化是指在DNA甲基化转移酶(DNA methyltransferase,DNMT)的催化下,CpG二核苷酸的胞嘧啶在5’碳原子位置上被选择性地添加甲基,形成5-甲基胞嘧啶。DNA异常甲基化可直接引起抑癌基因失活、癌基因激活,也可导致基因组的不稳定并间接诱导基因突变[9]。miRNA是一类非编码单链小分子RNA,10~25个核苷酸,主要通过与靶标mRNA中的碱基互补配对,抑制或降解mRNA的翻译,从而调控转录后的表达[10]。Iorio等[11]认为miRNA表达失误可导致恶性肿瘤的发生。miRNA-17-92在恶性肿瘤的调控过程中发挥了重要的作用,而miRNA-19b可能是miRNA-17-92中的关键致癌因子[12]。为此,该研究探讨了20(S)-PPD通过调控miRNA-19b这一中间信号通路对MCF-7细胞凋亡的影响,为20(S)-PPD广泛应用于乳腺癌的临床治疗提供依据。
1 材料与方法
1.1仪器与试剂乳腺癌MCF-7细胞系(中南大学生物化学与分子生物学实验室保存);DMEM高糖培养基、胎牛血清购自美国Hyclone公司;20(S)-PPD购自吉林大学化学系;MTT、二甲基亚砜(DMSO)购自美国BD公司;TNFα兔抗人多抗购自美国Bioworld公司;山羊抗兔IgG(二抗)购自北京鼎国公司;riboFECTTMCP转染试剂、miRNA-19b 模拟物以及阴性对照购自广州锐博公司;Trizol试剂、RNA逆转录试剂盒购自美国Invitrogen公司。
1.2细胞培养乳腺癌MCF-7细胞在含有青、链霉素各100 U/mL以及体积分数10%胎牛血清的DMEM完全培养液中培养,置于37 ℃、体积分数5% CO2恒温培养箱中,2~3 d传代1次,取状态良好的对数生长期细胞进行实验。
1.3MTT法检测细胞存活率取对数生长期的MCF-7细胞,每孔1 000个接种于96孔板,待细胞贴壁后弃去培养液,分别用30、40、50、60、70、80 μmol/L的20(S)-PPD 培养液100 μL培养细胞48 h,每组设5个复孔,阴性对照组加入等体积的DMSO培养液,并设立调零孔。实验终止前4 h每孔加入MTT 20 μL,继续孵育4 h,随后小心弃掉上清液,每孔加100 μL DMSO,在低速振荡器上振荡10 min,最后用酶标仪测定MCF-7细胞在490 nm处的吸光度(OD)值。细胞存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%。
1.4real-timePCR法检测miRNA-19b的表达分别取miRNA-RT 引物和 U6 RT 引物各1 μL和0、30、50、80 μmol/L 20(S)-PPD处理48 h后提取的总RNA 1 μg,加DEPC水至12 μL,混匀,65 ℃反应5 min后迅速置于冰上。向反应液中加入4 μL 5×反应缓冲液、2 μL 10×脱氧核苷酸碱基、1 μL RNA酶抑制剂、1 μL RT酶。反应条件: 42 ℃ 1 h,70 ℃ 5 min,-20 ℃保存。以cDNA为模板进行PCR扩增。 PCR反应条件:95 ℃预变性15 min;95 ℃ 10 s,60 ℃ 20 s,70 ℃ 10 s,共40个循环。miRNA-19b的相对表达量采用2-ΔΔCt法计算。实验重复3次。
1.5DNMT活性检测0、30、50、80 μmol/L 20(S)-PPD处理MCF-7细胞48 h后提取核蛋白,将核蛋白中的DNMT结合到基质膜上,与特异性的DNMT抗体结合,通过类酶联免疫吸附反应后测定450 nm处的OD值。 实验重复3次。
1.6细胞转染依据riboFECTTMCP转染试剂说明书,取对数生长期的MCF-7细胞以 105个/孔接种于6孔板中,培养至细胞达30%~50%融合时进行处理。采用析因设计方法,将MCF-7细胞分4组:A组(瞬时转染miRNA阴性对照模拟物+空白培养液)、B组[瞬时转染miRNA-19b 模拟物+20(S)-PPD 65 μmol/L]、C组(瞬时转染miRNA-19b模拟物+空白培养液)、D组[瞬时转染miRNA阴性对照模拟物+20(S)-PPD 65 μmol/L]。4组细胞均培养24 h后用于后续实验。
1.7miRNA-19b模拟物转染效率检测Cy3标记的miRNA阴性对照模拟物转染24 h后,荧光显微镜下检测转染效率。瞬时转染处理的MCF-7细胞培养48 h后,分别收集细胞,Trizol提取总RNA,real-time PCR定量检测转染后MCF-7细胞中miRNA-19b的表达水平,结果计算采用2-ΔΔCt法。实验重复3次。
1.8TNFα蛋白印迹分析从A、B、C、D 4组经转染处理后的MCF-7细胞中提取总蛋白。取30 μg蛋白溶液与2×蛋白上样缓冲液等体积混合,沸水加热10 min后上样进行电泳;电泳分离的蛋白转至PVDF膜,然后放入封闭液中,置于摇床室温缓速振荡1 h后,以TNFα兔抗人多抗作为一抗,4 ℃孵育过夜;磷酸盐缓冲液洗涤PVDF膜后加入二抗;应用化学发光剂反应1 min,采用Image-Pro Plus 5.1软件进行凝胶图像分析。实验重复3次。
1.9流式细胞术检测细胞凋亡取对数生长期的MCF-7细胞,以105个/孔接种于6 孔板内,按照1.6实验分组处理48 h后,胰蛋白酶消化为单细胞悬液,离心后弃掉上层液体,加入Binding Buffer重悬细胞。取100 μL悬浮液,分别加入5 μL的AnnexinV-APC和10 μL的PI,常温下避光孵育10 min,流式细胞仪检测细胞的凋亡情况。实验重复3次。
1.10统计学处理采用SPSS 21.0进行统计分析。各组细胞miRNA-19b相对表达量、DNMT活性的比较采用单因素方差分析,两两比较采用LSD-t检验;转染后各组细胞miRNA-19b、TNFα蛋白相对表达量及细胞凋亡率的比较采用2×2析因设计的方差分析。检验水准α=0.05。
2 结果
2.1各组MCF-7细胞存活率结果见图1。20(S)-PPD的IC50为65 μmol/L。因此选用了低、中、高(30、50、80 μmol/L)3个浓度以及IC5065 μmol/L进行实验。
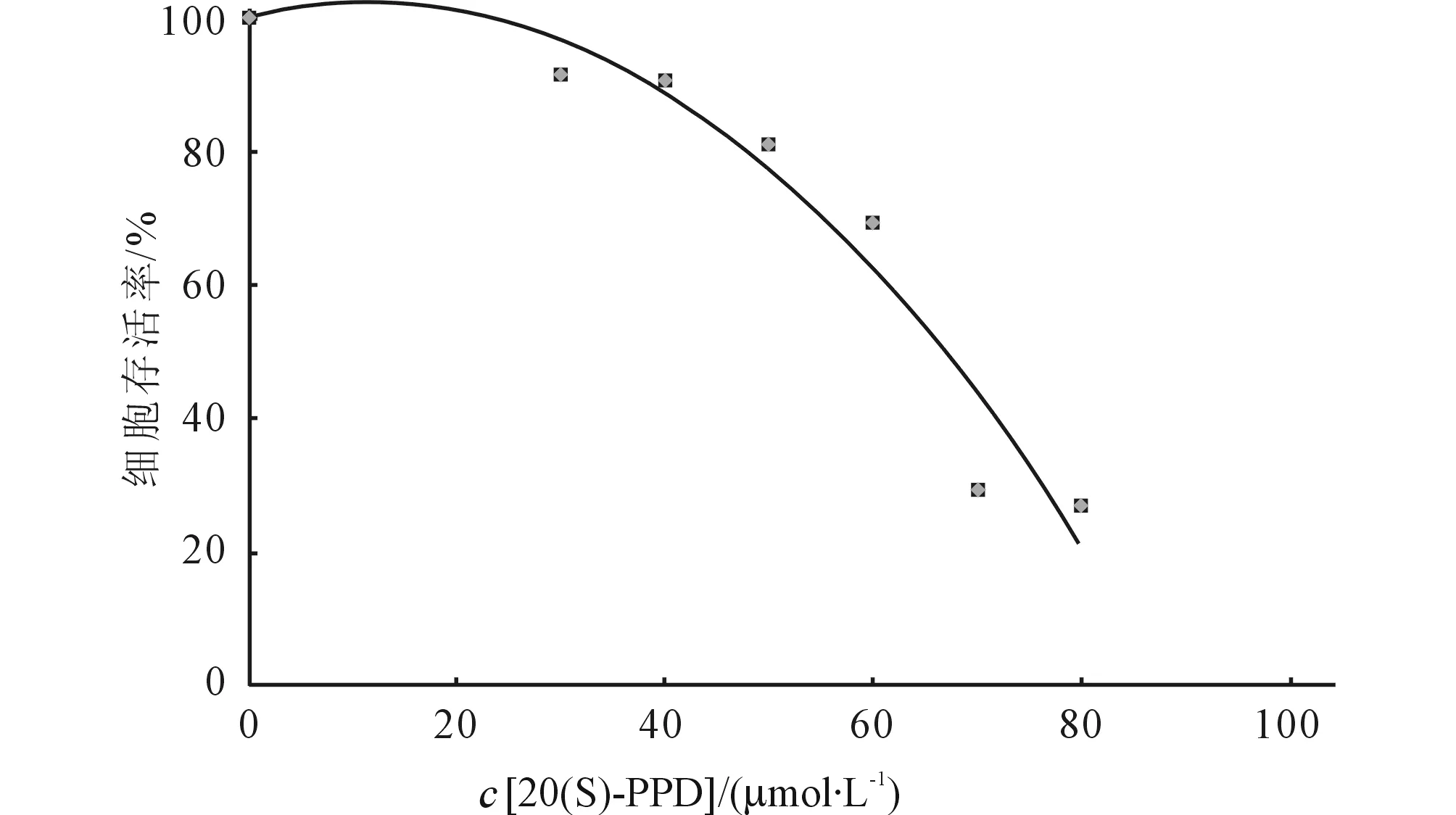
图1 MCF-7细胞存活率
2.2各组细胞miRNA-19b的表达情况结果见表1。20(S)-PPD作用后MCF-7细胞miRNA-19b表达水平降低。

表1 各组细胞miRNA-19b相对表达量的比较(n=3)
F=12.062,P=0.002;*:与阴性对照组比较,P<0.05。
2.3各组细胞DNMT活性检测结果见表2。

表2 各组细胞DNMT活性比较(n=3)
F=12.333,P=0.017;*:与阴性对照组比较,P<0.05。
2.4miRNA-19模拟物转染效率结果见图2。Cy3标记的miRNA-19b模拟物成功转染至MCF-7细胞,转染效率>90%。
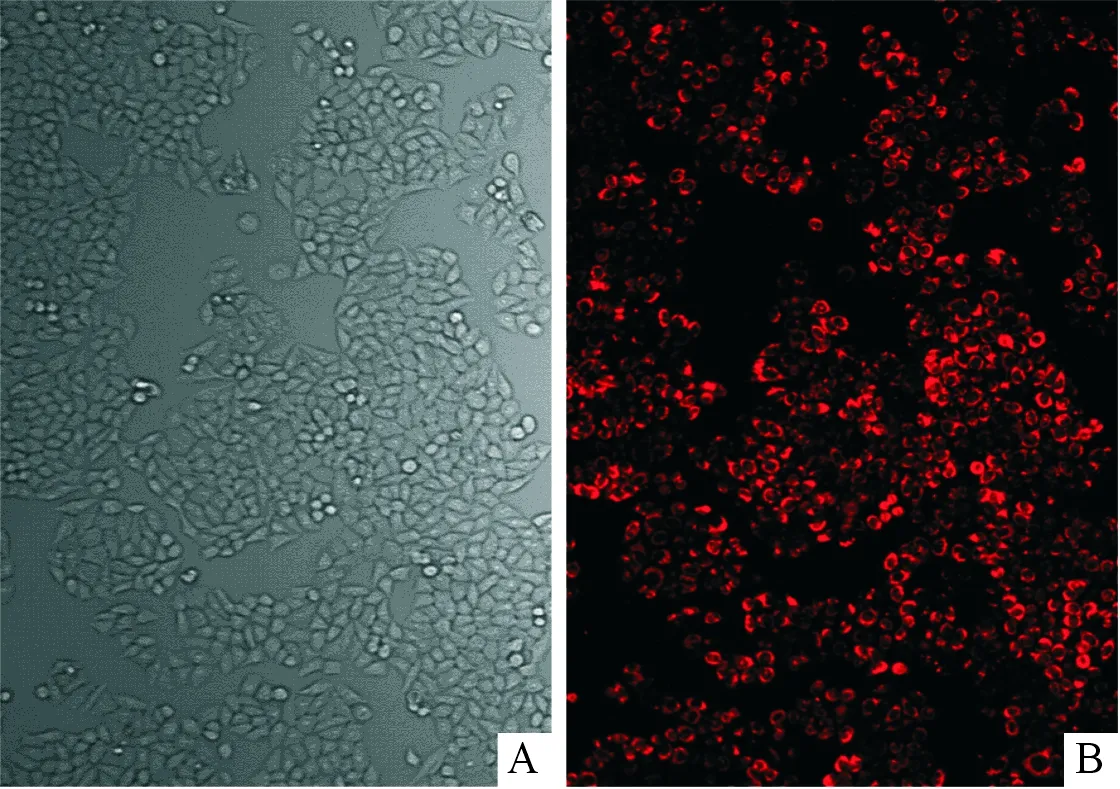
A:普通光源;B:荧光光源。图2 Cy3标记的转染后的MCF-7细胞(×200)
2.5转染后各组细胞miRNA-19b的表达情况结果见表3。

表3 转染后各组细胞miRNA-19b的表达(n=3)
F药物组间=48.465,F转染组间=103.198,F交互=47.437,P均<0.001。
2.6转染后各组细胞TNFα蛋白的表达情况结果见图3和表4。

图3 转染后各组细胞TNFα蛋白的表达

药物转染miRNA阴性对照模拟物转染miRNA⁃19b模拟物空白培养液0.236±0.0210.109±0.00665μmol/L20(S)⁃PPD0.786±0.0700.437±0.013
F药物组间=276.956,F转染组间=79.711,F交互=11.545,P均<0.05。
2.7转染后各组细胞凋亡率的比较结果见表5。

表5 转染后各组细胞凋亡率的比较(n=3)
F药物组间=232.625,F转染组间=68.432,F交互=66.269,P均<0.001。
3 讨论
20(S)-PPD在二醇组人参皂苷中药理活性最强[13],研究[14]表明20(S)-PPD可调控miRNA而影响肿瘤细胞的增殖和生物学特性。miRNA表达异常会诱发恶性肿瘤的发生[15]。该研究发现miRNA-19b在乳腺癌细胞中发挥了原癌基因的作用,20(S)-PPD可下调miRNA-19b的表达,诱导乳腺癌细胞凋亡。因此miRNA-19b有望成为原癌基因的分子调控点。
通过生物信息学分析查询靶基因预测软件,miRNA-19b预测的靶基因之一为TNFα。TNFα是一种细胞因子,可以与Fas跨膜蛋白等结合,激活外源性凋亡通路,进而引发Caspase级联反应,最终诱导肿瘤细胞凋亡[16]。该研究从蛋白质水平验证了miRNA-19b的过表达可以负向调控TNFα的表达,加入20(S)-PPD后,TNFα表达明显回升,因而证实TNFα是miRNA-19b新的靶标。但是20(S)-PPD下调miRNA-19b的作用是如何实现的?该研究发现20(S)-PPD可能通过增强miRNA-19b启动子区域DNMT的活性,引起上游miRNA-19b启动子区CpG岛过度甲基化,从而导致miRNA-19b表达沉默。有研究[17]也发现,由于DNA 去甲基化导致miRNA-375过表达,从而使MCF-7细胞异常增殖。
综上所述,20(S)-PPD对MCF-7细胞具有明显的增殖抑制作用,20(S)-PPD通过增强DNMT的活性下调miRNA-19b的表达,进而诱导TNFα的表达和细胞凋亡。miRNA-19b有望成为20(S)-PPD治疗乳腺癌的靶点,为20(S)-PPD广泛应用于乳腺癌的临床治疗提供了理论依据。
[1] 贾莉婷,张玉超,李静,等.miR-200c对三阴性乳腺癌细胞系上皮间质转化的影响[J].郑州大学学报(医学版),2016,51(3):325
[2] 杨金祥,章建芳,郑波,等.人参皂苷Rh2抗肿瘤作用研究进展[J].中国药师,2007,10(3):236
[3] SHINKAI K,AKEDO H,MUKAI M,et al.Inhibition ofinvitrotumor cell invasion by ginsenoside Rg3[J].Jpn J Cancer Res,1996,87(4):357
[4] ZHANG H,XU HL,FU WW,et al.20(S)-protopanaxadiol induces human breast cancer MCF-7 apoptosis through a caspase-mediated pathway[J].Asian Pac J Cancer Prev,2014,15(18):7919
[5] HA YW,AHN KS,LEE JC,et al.Validated quantification for selective cellular uptake of ginsenosides on MCF-7 human breast cancer cells by liquid chromatography-mass spectrometry[J].Anal Bioanal Chem,2010,396(8):3017
[6] PARK B,LEE YM,KIM JS,et al.Neutral sphingomyelinase 2 modulates cytotoxic effects of protopanaxadiol on different human cancer cells[J].BMC Complement Altern Med,2013,13:194
[7] CAO B,QI Y,YANG Y,et al.20(S)-protopanaxadiol inhibition of progression and growth of castration-resistant prostate cancer[J].PLoS One,2014,9(11):e111201
[8] GODFREY KM,SHEPPARD A,GLUCKMAN PD,et al.Epigenetic gene promoter methylation at birth is associated with child's later adiposity[J].Diabetes,2011,60(5):1528
[9] DANIEL FI,ALVES SR,VIEIRA DS,et al.Immunohistochemical expression of DNA methyltransferases 1, 3a, and 3b in actinic cheilitis and lip squamous cell carcinomas[J].J Oral Pathol Med,2016,45(10):774
[10]张军,陈兆峰,刘晓光,等.微小RNA-215在胃癌中的表达及其临床意义[J].兰州大学学报(医学版),2013,39(4):13
[11]IORIO MV,FERRACIN M,LIU CG,et al.MicroRNA gene expression deregulation in human breast cancer[J].Cancer Res,2005,65(16):7065
[12]OLIVE V,JIANG I,HE L.mir-17-92, a cluster of miRNAs in the midst of the cancer network[J].Int J Biochem Cell Biol,2010,42(8):1348
[13]毛晶晶,张彤,王冰,等.20(S)-原人参二醇的药理作用研究进展[J].中国实验方剂学杂志,2011,17(24):274
[14]LEE OK,CHA HJ,LEE MJ,et al.Implication of microRNA regulation in para-phenylenediamine-induced cell death and senescence in normal human hair dermal papilla cells[J].Mol Med Rep,2015,12(1):921
[15]CHO WC.OncomiRs: the discovery and progress of microRNAs in cancers[J].Mol Cancer,2007,6:60
[16]MOON DO,KIM MO,KANG SH,et al.Sulforaphane suppresses TNF-alpha-mediated activation of NF-kappaB and induces apoptosis through activation of reactive oxygen species-dependent caspase-3[J].Cancer Lett,2009,274(1):132
[17]ZHOU D,WAN Y,XIE D,et al.DNMT1 mediates chemosensitivity by reducing methylation of miRNA-20a promoter in glioma cells[J].Exp Mol Med,2015,47:e182
(2016-12-28收稿 责任编辑姜春霞)
Observation of 20(S)-protopanaxadiol-induced apoptosis of breast cancer MCF-7 cellsviaregulating miRNA-19b
YANGXiaoyan1,2),QINXiyuan3),LINan1),LUOZhiyong3),YANGFang1)
1)DepartmentofEpidemiologyandHealthStatistics,CollegeofXiangyaPublicHealth,CentralSouthUniversity,Changsha410078 2)DepartmentofPhysicalExaminationCenter,NorthDistrictofSuzhouMunicipalHospital,Suzhou,Jiangsu215008 3)DepartmentofBiochemistryandMolecularBiology,CollegeofLifeSciences,CentralSouthUniversity,Changsha410004
MCF-7 cell;20(S)-protopanaxadiol;miRNA-19b;TNFα;apoptosis
Aim: To investigate the possible mechanism of 20(S)-protopanaxadiol[20(S)-PPD] which could induce apoptosis of breast cancer MCF-7 cellsviaregulating miRNA-19b.MethodsMCF-7 cells were treated with 30,40,50,60,70,80 μmol/L 20(S)-PPD for 48 h and the cell viability was detected by MTT method.MCF-7 cells were treated with 30,50,80 μmol/L 20(S)-PPD for 48 h, the expression level of miRNA-19b was detected by real-time PCR, and DNMT activity assay kit was used to detect the DNMT activity. MCF-7 cells were divided into four groups: miRNA mimics plus blank medium group, miRNA-19b mimics plus 20(S)-PPD group, miRNA-19b mimics plus blank medium group, and miRNA mimics plus 20(S)-PPD group.The expression of miRNA-19b in the four groups was detected by real-time PCR. The protein expression level of TNFα in the four groups was detected by Western blot. The cell apoptosis in the four groups was tested by flow cytometry.Results20(S)-PPD could suppress the viability of MCF-7 cells concentration-dependently. 20(S)-PPD could significantly decrease the expression of miRNA-19b with the increase of the concentration(P<0.05).80 μmol/L 20(S)-PPD significantly enhanced the activity of DNMT(P<0.05). After transfecting miRNA-19b mimics, the expression of miRNA-19b upregulated,the expression of TNFα was repressed, and the apoptosis rate reduced(P<0.05).After joining 65 μmol/L 20(S)-PPD, the expression of miRNA-19b decreased,the expression of TNFα increased, and the apoptosis rate increased(P<0.05).ConclusionIn MCF-7 cells, 20(S)-PPD may inhibit the expression of miRNA-19b, increase the expression of TNFα, and induce apoptosis through its methylation role.
10.13705/j.issn.1671-6825.2017.06.011
*国家自然科学基金资助项目 81101655;湖南省自然科学基金资助项目 12JJ3099
1)中南大学湘雅公共卫生学院流行病与卫生统计学系 长沙 410078 2)苏州市立医院北区体检中心 江苏苏州 215008 3)中南大学生命科学学院生物化学与分子生物学系 长沙 410004
#通信作者,女,1981年8月生,博士,副教授,研究方向:复杂疾病的遗传流行病学、复杂疾病多组数据挖掘与统计分析方法,E-mail:yangfang2010@csu.edu.cn
R737.9
