骨化三醇对糖尿病大鼠股骨力学结构的影响研究
2017-11-22郑娅张峰曹建业董利薇高文双张静
郑娅 张峰 曹建业 董利薇 高文双 张静
骨化三醇对糖尿病大鼠股骨力学结构的影响研究
郑娅 张峰 曹建业 董利薇 高文双 张静
目的 探讨骨化三醇对糖尿病大鼠股骨力学结构的影响。方法 链脲佐菌素诱导建立糖尿病大鼠模型,随机分为糖尿病组 ( DM ) 和骨化三醇灌胃组 ( VD ),健康同龄大鼠作为正常对照组 ( NC )。骨化三醇灌胃后 6 周、9 周,取右侧股骨做生物力学检测;取左侧股骨制备脱钙骨切片,进行骨形态学观察和计量学测定。结果 与同期 NC 组相比,各 DM 组大鼠股骨的生物力学参数均明显下降 ( Ρ<0.05 ),组织形态计量学参数显示骨小梁数量、骨小梁厚度和骨小梁面积百分比均明显下降 ( Ρ<0.05 ),而骨小梁分离度明显增加( Ρ<0.05 )。骨化三醇灌胃后 6 周,与同期 DM 组相比,大鼠股骨的生物力学参数显示最大载荷 ( 132.47±11.00 ) 和断裂载荷 ( 115.37±7.64 ) 均明显增加 ( Ρ<0.05 ),形态学参数显示骨小梁数量 ( 3.562±0.374 )、骨小梁面积百分比 ( 26.531±3.388 ) % 均明显增加 ( Ρ<0.05 ),而骨小梁分离度明显降低 ( Ρ<0.05 )。灌胃后 9 周,大鼠股骨的弹性载荷、刚性系数等生物力学参数均明显增加,骨小梁厚度、骨小梁数量等形态学参数也均出现明显变化,差异有统计学意义 ( Ρ<0.05 )。结论 骨化三醇能够改善糖尿病大鼠股骨显微结构的退化及生物力学性能的降低,增加力学结构的稳定性,治疗骨质疏松。
糖尿病;大鼠;骨质疏松;骨化三醇;生物力学
糖尿病性骨质疏松作为糖尿病骨病之一[1],是糖尿病在骨骼系统的重要并发症,发病原因主要为胰岛素功能缺乏、高血糖毒性、钙磷代谢障碍、糖尿病慢性并发症等,但具体机制尚不清楚[2-3]。研究发现,糖尿病大鼠维生素 D3显著降低,导致钙磷代谢异常,这可能是糖尿病骨质疏松的重要发病机制之一[4]。
骨化三醇,即 1,25-( OH )2D3,是维生素 D3的重要活性代谢产物之一,机体从外界获取的维生素 D需在肝脏和肾脏经过 2 次羟化后转化而成。研究发现,骨化三醇可提高骨髓 1,25(OH)2D3浓度,直接作用于骨组织中的成骨细胞和破骨细胞,治疗骨质疏松症[5]。本实验拟通过骨组织形态计量学、骨生物力学等方法探讨骨化三醇对糖尿病大鼠股骨力学结构的影响,为骨化三醇的临床应用提供实验依据。
材料与方法
一、材料
1. 动物:50 只 3 个月龄健康雄性清洁级 SD 大鼠。体重 180~200 g。购自河北医科大学实验动物中心,许可证编号:SCXK ( 冀 ) 2013-1-003。
2. 试剂:链脲佐菌素 ( STZ,美国 Cayman 公司 );骨化三醇 ( 美国 Cayman 公司 );柠檬酸缓冲液( 北京索莱宝公司 )。
二、方法
1. 动物模型的建立和分组:雄性 SD 大鼠50 只,适应性喂养 1 周。随机选取 34 只大鼠建立糖尿病模型,16 只健康同龄大鼠作为正常对照组( NC )。造模方法:禁食过夜,次日按 30 mg / kg 的剂量给予 STZ 柠檬酸溶液一次性腹腔注射。正常对照组给予等量柠檬酸缓冲液。注射 STZ 后 72 h,测定大鼠尾尖空腹血糖≥11.1 mmol / L,视为造模成功。将成模大鼠 32 只随机分为 4 组,每组 8 只:糖尿病 I、II 组 ( DM I、II 组 ),骨化三醇灌胃 I、II 组( VD I、II 组 )。VD 组每天给予 1 μg / kg 的骨化三醇( 1 μg / ml 花生油 ) 灌胃,NC 组及 DM 组给予等量花生油灌胃。各组大鼠均自由饮水和进食普通饲料,在喂养后 6 周 ( I 组 )、9 周 ( II 组 ),取左侧股骨远端 1 / 3,10% 中性甲醛溶液固定,常规石蜡包埋、切片,HE 染色。右侧股骨冻存于 -80 ℃ 冰箱中备用。
2. 股骨生物力学测定:股骨常温解冻,生理盐水复湿,放在 858 Mini Bionix 型材料试验机上进行三点弯曲实验,选用精度为 0.01 N 的负载单元,加载速度为 2 mm / min,跨距为 17 mm。记录载荷-变形曲线,从曲线上直接获取或依公式计算出相应的力学指标:最大载荷、断裂载荷、弹性载荷、刚性系数、弯曲能量[6]。
3. 骨组织形态学观察及计量学分析:取左侧股骨远端石蜡包埋,切片,HE 染色,观察骨组织形态学变化。并利用 OLYMPUS BX61 全自动显微照相系统行骨组织形态计量学定量分析。测定静态参数:骨小梁面积百分数 ( %Tb. Ar )、骨小梁数量 ( Tb. N )、骨小梁分离度 ( Tb. Sp )、骨小梁厚度 ( Tb. Th )。
三、统计学处理
采用 SPSS 21.0 统计软件进行数据分析。计量资料用表示,各组间比较采用单因素方差分析( ANOVA ),Ρ<0.05 为差异有统计学意义。
结 果
一、糖尿病大鼠模型的建立
单次大剂量注射链脲佐菌素后 24 h,大鼠出现多饮、多食、多尿等典型糖尿病症状,成模率 94%( 32 / 34 )。实验观察期间,正常大鼠体重稳步增长,糖尿病大鼠体重增长缓慢且显著低于正常大鼠,差异有统计学意义 ( Ρ<0.05 ),而同期 DM 组、VD 组大鼠体重差异无统计学意义 ( Ρ>0.05 )。与同期 NC 组相比,DM 组空腹血糖显著升高,差异有统计学意义 ( Ρ<0.05 );而与 DM 组相比,VD 组空腹血糖差异无统计学意义 ( Ρ>0.05 )。结果提示,骨化三醇对糖尿病大鼠的体重和血糖影响不大。具体结果见表 1。
二、生物力学实验结果
与同期 NC 组相比,各 DM 组大鼠的生物力学参数均显著降低 ( Ρ<0.05 )。骨化三醇灌胃 6 周,VD I 组大鼠股骨的最大载荷和断裂载荷分别为132.47±11.00、115.37±7.64,明显高于同期 DM 组( Ρ<0.05 ),而弹性载荷、弯曲能量和刚性系数差异无统计学意义 ( Ρ>0.05 )。灌胃 9 周,VD II 组大鼠的各项生物力学参数均明显增加,与同期 DM 组相比,差异有统计学意义 ( Ρ<0.05 ),结果详见表 2。
三、骨组织形态学观察
HE 染色观察发现,NC 组骨小梁致密,粗大,走向一致,粗细均匀,结构紧密,连续性良好。同NC 组相比,DM 组股骨远端松质骨骨小梁数量较少,骨小梁稀疏、变细、排列紊乱,出现大片无骨小梁骨髓区,随着时间推移,骨小梁连续性变好。VD 组骨小梁稀疏、稍变细,程度较 DM 组轻,总体结构清楚,偶见断裂 ( 图 1 )。

表 1 各组大鼠体重和空腹血糖的变化 ( x- ± s,n = 8 )Tab.1 Changes of weight and fasting blood glucose level in rats in different groups ( x- ± s, n = 8)
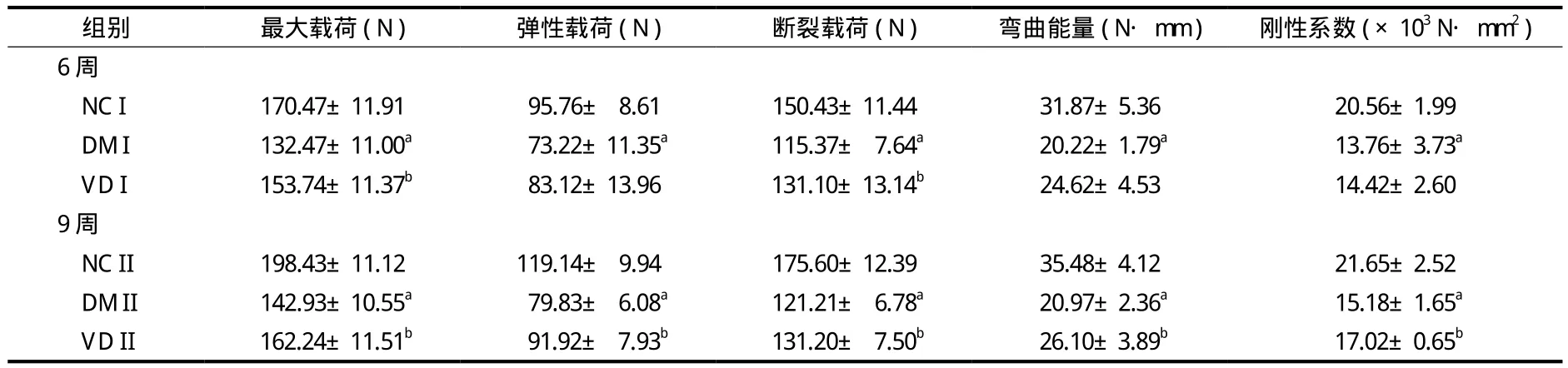
表 2 各组大鼠股骨生物力学参数的变化 ( x- ± s,n = 8 )Tab.2 Changes of biomechanical properties of the femur in rats in different groups ( x- ± s,n = 8 )

图 1 各组大鼠股骨远端 HE 染色 ( ×100 ) a:NC I;b:DM I;c:VD I;d:NC II;e:DM II;f:VD IIFig.1 Hematoxylin-eosin ( HE ) staining of the distal femur in rats ( ×100 ) a: NC I; b: DM I; c: VD I; d: NC II; e:DM II; f:VD II
四、骨形态计量学结果
与同期 NC 组相比,各 DM 组大鼠股骨 Tb. N,Tb. Th,%Tb. Ar 均明显下降,而 Tb. Sp 明显增加,差异有统计学意义 ( Ρ<0.05 ) 。
骨化三醇灌胃 6 周,VD I 组大鼠股骨 Tb. N 和%Tb. Ar 分别为 3.562±0.374、26.531±3.388,较同期 DM 组均明显增加,而 Tb. Sp 明显下降,差异有统计学意义 ( Ρ<0.05 ),而 Tb. Th 差异无统计学意义 ( Ρ>0.05 )。灌胃 9 周,VD II 组大鼠股骨 Tb. N、Tb. Th 和 %Tb. Ar 分别为 4.257±0.573、0.157±0.011、( 32.595±4.574 ) %,较同期 DM 组均明显增加,而 Tb. Sp 明显下降,差异均有统计学意义 ( Ρ<0.05 ),结果详见表 3。

表 3 各组大鼠股骨远端静态参数的变化 ( x- ± s,n = 8 )Tab.3 Changes of static parameters of the distal femur in rats in different groups ( x- ± s,n = 8 )
讨 论
骨质疏松是糖尿病慢性并发症之一,是以骨量减少、骨脆性增加和骨组织结构破坏为特征的代谢性骨病[7]。以往研究发现,高血糖毒性、胰岛素抵抗、炎症反应、IGF-1 功能或受体缺陷、细胞和免疫功能缺陷以及其它内分泌激素代谢异常等都参与了骨质疏松的病理生理改变[8-16]。本研究结果显示,实验 6 周时,糖尿病大鼠股骨松质骨出现了骨量明显丢失,骨小梁稀疏、变窄、间距增大,骨小梁连接结构破坏等一系列显微结构退化的改变。生物力学结果显示,糖尿病大鼠的骨结构力学 ( 最大载荷、弹性载荷、断裂载荷和弯曲能量 ) 和材料力学 ( 刚性系数 ) 性能均有不同程度的下降,表明糖尿病状态下,骨的力学结构受到破坏,骨组织脆性增加、易变形和断裂,出现骨质疏松的表现。结果提示,糖尿病大鼠股骨无论是微观结构还是宏观力学均呈现出骨质疏松的特点,这与以往的一些研究结果基本一致[17]。9 周时,糖尿病大鼠骨形态学计量学结果较正常大鼠呈现明显显微结构退化的改变,生物力学性能仍明显下降,但比 6 周时有一定改善,这可能与大鼠正处于快速生长期骨骼硬度增加、脆性下降有关。
骨化三醇是维生素 D 生物活性的最高形式,其作用机制主要是通过与靶器官表面的维生素 D 受体 ( vitamin D receptor,VDR ) 结合,增加肠道对钙的吸收及肾小管的重吸收,抑制甲状旁腺激素的合成与分泌,从而维持钙、磷代谢平衡,调节骨的正常代谢与矿化。近年来,骨化三醇对骨代谢的作用逐渐得到认识,一方面增加骨钙素和骨碱性磷酸酶的表达、抑制骨涎蛋白的产生、增强 I 型胶原的表达,促进成骨;另一方面主要通过与成骨细胞、骨细胞和软骨细胞的 VDR 结合后, 直接或间接调节RANKL 的表达,促进破骨细胞的发育,从而在骨的吸收和形成代谢过程中起着双向调节作用[18-22]。
本研究采用 1 μg / kg 骨化三醇灌胃后 6 周、9 周,观察骨化三醇治疗对糖尿病大鼠骨质疏松的影响。结果发现,灌胃后 6 周,大鼠股骨 Tb. N、%Tb. Ar 明显增加,而 Tb. Sp 明显下降且股骨最大载荷和断裂载荷显著高于糖尿病组。灌胃后 9 周,大鼠股骨 Tb. Th 等形态计量学结果及弹性载荷、刚性系数等各项骨生物动力学参数均发生明显变化。骨生物力学主要研究骨在外界作用下的力学性能和受力后所产生的生物学效应,是骨结构、骨质量和骨强度的集中体现[23]。刚性系数是反映骨材料力学特性和内在特性的指标,而最大载荷、弹性载荷、断裂载荷和弯曲能量则是反映骨结构力学特性和外在特性的指标。骨组织形态计量学参数反映该药物的作用机制与作用环节[24],对于研究药物在体内抗骨质疏松效应具有重要的意义。经骨化三醇治疗后,骨小梁数量、厚度和面积百分比增加,骨小梁间隙变窄,断点变少,连续性变好,表明骨化三醇能增加松质骨的骨量,增强骨骼的支撑强度,从而改善糖尿病对骨小梁微结构的进一步退化,增加力学结构的稳定性,降低骨质疏松的骨折风险。
综上所述,骨化三醇对大鼠糖尿病所致的骨质疏松有良好的治疗效果,能够提高大鼠股骨生物力学性能、改善骨小梁微结构,增加骨力学结构的稳定性,从而降低骨质疏松骨折的发生率,但骨化三醇具体的分子机制及最佳剂量等都有待进一步研究和探讨。
[1] Wu YY, Yu T, Zhang XH, et al. 1,25(OH)2D3 inhibits the deleterious effects induced by high glucose on osteoblasts through undercarboxylated osteocalcin and insulin signaling[J].J Steroid Biochem Mol Biol, 2012, 132(1-2):112-119.
[2] 李晓宇, 冯正平. 糖尿病性骨质疏松发病机制的研究进展[J].中国骨质疏松杂志, 2012, 18(3):281-285.
[3] Khan TS, Fraser LA. Type 1 diabetes and osteoporosis: from molecular pathways to bone phenotype[J]. J Osteoporos, 2015,2015:174186.
[4] 徐一甄, 沈稚舟, 方京冲, 等. 糖尿病大鼠一氧化氮与骨代谢变化的研究[J]. 中华内分泌代谢杂志, 2002, 18(3):228-230.
[5] Yoshida T, Stern PH. How vitamin D works on bone[J].Endocrinol Metab Clin North Am, 2012, 41(3):557-569.
[6] 陈孟诗, 赖胜祥, 李良, 等. 大鼠的骨生物力学指标选取及测试[J]. 生物医学工程学杂志, 2001, 18(4):547-551.
[7] Leidig-Bruckner G, Grobholz S, Bruckner T, et al. Prevalence and determinants of osteoporosis in patients with type 1 and type 2 diabetes mellitus[J]. BMC Endocr Disord, 2014, 14:33.
[8] Wang W, Zhang X, Zheng J, et al. High glucose stimulates adipogenic and inhibits osteogenic differentiation in MG-63 cells through cAMP / protein kinase A / extracellular signal-regulated kinase pathway[J]. Mol Cell Biochem, 2010,338(1-2):115-122.
[9] Gonzalez Y, Herrera MT, Soldevila G, et al. High glucose concentrations induce TNF-α production through the downregulation of CD33 in primary human monocytes[J]. BMC Immunol, 2012, 13:19.
[10] Xia J, Zhong Y, Huang G, et al. The relationship between insulin resistance and osteoporosis in elderly male type2 diabetes mellitus and diabetic nephropathy[J]. Annales Dendocrinologie, 2012, 73(6):546-551.
[11] Kakoki M, Sullivan KA, Backus C, et al. Lack of both bradykinin B1 and B2 receptors enhances nephropathy,neuropathy, and bone mineral loss in Akita diabetic mice[J].Proc Natl Acad Sci USA, 2010, 107(22):10190-10195.
[12] Fowlkes JL, Nyman JS, Bunn RC, et al. Osteo-promoting effects of insulin-like growth factor I (IGF-I) in a mouse model of type 1 diabetes[J]. Bone, 2013, 57(1):36-40.
[13] Ni Y, Li H, Zhang Y, et al. Association of IL-6 G-174C polymorphism with bone mineral density[J]. J Bone Miner Metab, 2014, 32(2):167-173.
[14] Danks L, Takayanagi H. Immunology and bone[J]. J Biochem,2013, 154(1):29-39.
[15] Gaudio A, Privitera F, Battaglia K, et al. Sclerostin levels associated with inhibition of the Wnt / β-catenin signaling and reduced bone turnover in type 2 diabetes mellitus[J]. J Clin Endocrinol Metab, 2012, 97(10):3744-3750.
[16] Westermark GT, Westermark P. Islet amyloid polypeptide and diabetes[J]. Curr Protein Pept Sci, 2013, 14(4):330-337.
[17] 李健, 刘亚平, 郭洪敏, 等. RAGE 对糖尿病大鼠骨代谢紊乱的影响[J]. 实用骨科杂志, 2015, (7):618-621.
[18] Chen J, Dosier CR, Park JH, et al. Mineralization of threedimensional osteoblast cultures is enhanced by the interaction of 1alpha,25-dihydroxyvitamin D3 and BMP2 via two specific vitamin D receptors[J]. J Tissue Eng Regen Med, 2016,10(1):40-51.
[19] Ryan JW, Reinke D, Kogawa M, et al. Novel targets of vitamin D activity in bone: action of the vitamin D receptor in osteoblasts, osteocytes and osteoclasts[J]. Curr Drug Targets,2013, 14(14):1683-1688.
[20] Masuyama R, Stockmans I, Torrekens S, et al. Vitamin D receptor in chondrocytes promotes osteoclastogenesis and regulates FGF23 production in osteoblasts[J]. J Clin Invest,2006, 116(12):3150-3159.
[21] Takahashi N, Udagawa N, Suda T. Vitamin D endocrine system and osteoclasts[J]. Bonekey Rep, 2013, 3:495.
[22] Woeckel VJ, Alves RD, Swagemakers SM, et al. 1α,25-(OH)2D3 acts in the early phase of osteoblast differentiation to enhance mineralization via accelerated production of mature matrix vesicles[J]. J Cell Physiol, 2010, 225(2):593-600.
[23] 秦岭, 梁国穗. 骨生物力学在防止骨质疏松药物开发中的应用基础(一)[J]. 中国骨质疏松杂志, 2000, 6(1):23.
[24] Parfitt AM, Drezner MK, Glorieux FH, et al. Bone histomorphometry: standardization of nomenclature,symbols, and units. Report of the ASBMR Histomorphometry Nomenclature Committee[J]. J Bone Miner Res, 1987,2(6):595-610.
. 作者须知 Instruction for authors .
关于作者姓名、单位在论文中的脚注方法
1. 个人作者署名:在论文首页下方进行脚注。“作者单位:”后面列出邮政编码、城市和作者单位 ( 具体到科室 )。个人作者超过一位时,可请作者自行指定一位通讯作者 ( corresponding author ),亦即对选题、科研设计起主要作用者,参与论文撰写并能解答编辑部、读者疑问,对论文负全部责任者;在按原格式列出各位作者单位后,另起一行在“通讯作者:”字样后列出通讯作者姓名、邮政编码、单位名称、Email 地址。
2. 集体署名作者:凡集体署名的论文,于文末写出“ ( ××× ××× ×××整理 ) ”的同时,一律在论文首页下方脚注通讯作者有关信息。通讯作者由投稿者自行决定。( 1 ) 署名单位只有一个时,脚注中只列出通讯作者的姓名、邮政编码、Email 地址。署名单位超过一个时,脚注中还应加列通讯作者的工作单位。( 2 ) 协作组署名时,需在文末参考文献前列出整理者姓名 ( 方法同前 ) 及协作组成员。在“协作组成员:”字后列出协作组各单位名称,单位名称后括号内列出参加者姓名。同时脚注:“通讯作者:姓名,单位,邮政编码、Email 地址”。
为支持多中心协作研究项目,可以在论文首页下方脚注“各协作单位第一作者均为本文的第一作者”。
Effects of calcitriol on bone mechanical structure in diabetic rats
ZHENG Ya, ZHANG Feng, CAO Jian-ye, DONG Li-wei, GAO Wen-shuang, ZHANG Jing. Department of Rehabilitation, the third Hospital of Hebei Medical University,Shijiazhuang, Hebei, 050051, China
ZHANG Jing, Email: jizhang2008@sina.com
Objective To investigate the effects of calcitriol on bone mechanical structure in diabetic rats.Methods Diabetic rat model was established from streptozotoein. The diabetic rats were randomly divided into the diabetic group ( DM ) and the vitamin D treated group ( VD ), while the healthy SD rats were used as the normal control group ( NC ). The rats in the VD group were continuously fed with 1,25-dihydroxyvitaminD3for 6 weeks and 9 weeks. Right femurs were harvested for biomechanical analysis, while the left for bone histomorphometry data.Results Compared with the NC group in the same period, biomechanical properties were significantly lower in the DM group, as well as the static parameters ( percent trabecular area, trabecular thickness, trabecular number ) ( Ρ < 0.05 ),while the trabecular separation was significantly increased ( Ρ < 0.05 ). With administration for 6 weeks, the rats in the VD group showed a significant increase in maximum load ( 132.47 ± 11.00 ), break load ( 115.37 ± 7.64 ), trabecular number ( 3.562 ± 0.374 ) and percent trabecular area ( 26.531 ± 3.388 ) %, while trabecular thickness was significantly decreased compared with the DM group ( Ρ < 0.05 ). After treated for 9 weeks, the VD group also displayed significant changes in biomechanical properties ( elastic load and rigid coefficient ) and static parameters compared to the DM group ( Ρ < 0.05 ). Conclusions Calcitriol can improve the degradation of the microstructure and increase the femur stability of the mechanical structure in diabetic osteoporosis rats, playing a therapeutic role in the osteoporosis.
Diabetes mellitus; Rats; Osteoporosis; Calcitriol; Biomechanics
10.3969/j.issn.2095-252X.2017.11.005
R587.1
050051 石家庄,河北医科大学第三医院康复科
张静,Email: jizhang2008@sina.com
2017-02-07 )
( 本文编辑:李慧文 )
因毕业、工作调动或进修结束等情况单位变动时,论文署名单位应为原单位,介绍信也应由原单位加盖公章批准。刊出时可另行注明第一作者现在工作单位及相应的科室、邮编。
