人参皂苷 Rb2 在体外调控破骨细胞的作用
2017-11-22苏柯邱榆程王春梅袁志
苏柯 邱榆程 王春梅 袁志
人参皂苷 Rb2 在体外调控破骨细胞的作用
苏柯 邱榆程 王春梅 袁志
目的 探究人参皂苷 Rb2 在体外对破骨细胞的作用及机制。方法 通过培养 RAW264.7 破骨前体细胞,加入不同浓度 Rb2 溶液 ( 0.1 μM,1 μM,10 μM ),采用 CCK-8 检测 Rb2 药物毒性,利用 TRAP 染色观察破骨细胞形态并计数,使用 RT-PCR 方法检测 TRAP、NFATc1 破骨活动特异性基因 mRNA 的表达,通过 Western blot 技术检测破骨细胞中 LC3 I、LC3 II、mTOR 的蛋白表达水平。结果 TRAP 阳性计数,与空白对照组相比 ( 168.2±22.6 ),0.1 μM 组 ( 131.0±16.3 ),P=0.018;1 μM 组 ( 98.8±17.9 ),P<0.01; 10 μM 组( 85.8±17.3 ),P<0.01,破骨细胞数量明显减少。对照组 TRAP、NFATc1 破骨分化特异性基因 mRNA 表达明显下降,与对照组相比各组 P<0.01。LC3 II / LC3 I 的比值显著增高,mTOR 量下降,与对照组相比各组 P<0.01。结论 Rb2 可能通过自噬途径影响破骨基因的表达,从而减少破骨细胞的形成,mTOR 通路在此过程中起重要作用。
人参皂甙类;破骨细胞;自噬;骨质疏松
骨质疏松症是常见的老年病之一,同时也是一个世界性的、主要的、不断增长的骨骼健康问题。它主要表现为骨量减少、骨微结构损害,导致骨脆性增加、易发骨折[1]。
目前许多治疗骨质疏松的西药,如双磷酸盐类药物,有很多副作用,包括骨坏死、股骨非典型性骨质和肾功能障碍等[2-3]。与之相比,有些天然的中药单体副作用少、生物活性高,并且能够长期服用,也许会是一个更好地预防和治疗骨质疏松症的选择。
本课题组前期研究发现,人参皂苷 Rb2 呈剂量依赖性地抑制高剂量地塞米松诱导的小鼠骨髓间充质干细胞的细胞凋亡[4]。还发现绝经后骨质疏松小鼠模型中,Rb2 能明显改善骨质疏松骨的骨微结构,提高了骨矿物质密度并且促进了 MC3T3-E1 成骨前体细胞的细胞增殖[5]。
本实验通过以 RAW264.7 破骨前体细胞为研究对象,观察 Rb2 在体外对破骨细胞的作用,及其对相关破骨基因表达的影响,探讨 Rb2 对破骨细胞形成的作用及其作用机制,完善 Rb2 防治骨质疏松的实验基础。
资料与方法
一、细胞
小鼠 RAW264.7 破骨前体细胞系来源于中国典型培养物保藏中心。
二、药物与试剂
人参皂苷 Rb2 购买自上海同田生物技术股份有限公司;α-MEM 培养基、胎牛血清、青链霉素 ( 美国 Gibco 公司 );细胞因子 RANKL ( 美国 Peprotech 公司 );抗酒石酸酸性磷酸酶 ( TRAP ) 染色试剂盒 ( 美国 Sigma 公司 );CCK-8 试剂盒 ( 日本同仁 Dojindo 公司 );RNA 提取试剂盒 ( 美国 Omega 公司 );RNA 逆转录及扩增试剂盒 ( 日本 Takara 公司 );基因引物( 日本 Takara 公司 );LC3、mTOR 抗体 ( 英国 Abcam公司 )。
三、RAW264.7 细胞的破骨分化诱导
采用成分为 10% 胎牛血清、100 U / ml 青链霉素的 α-MEM 培养基,在 37 ℃、5% CO2培养箱中孵育 RAW264.7 细胞。分散细胞,按照 2×104/ml 的浓度将细胞接种在 48 孔板及 6 孔板中,培养6 h 后,弃掉培养液,换成加入细胞因子 RANKL( 100 ng / ml ) 的培养基,同时实验组分别加入0.1 μM,1 μM,10 μM 浓度的 Rb2 溶液。3 天后换液,共培养 5~6 天。
四、CCK-8 法检测 Rb2 对 RAW264.7 细胞的毒性作用
将 RAW264.7 细胞分散后,按 5000 个 / 孔接种于 96 孔板中,共分 4 组 ( 空白对照组,0.1 μM 组,1 μM 组,10 μM 组 ),每组 6 孔,分别培养 24、48及 72 h。换成含 10% CCK-8 溶液的 α-MEM 培养基,在 37 ℃ 下避光孵育 1 h,测定各孔 450 nm 波长的吸光度值。
五、TRAP 染色及定量检测
破骨细胞诱导成功后,取出 48 孔板,倒掉培养基,用 PBS 轻轻冲洗 2 遍,加入 4% 多聚甲醛固定20 min,倒掉固定液,去离子水冲洗 2 遍,加入配制好的 TRAP 染色液,37 ℃ 避光孵育 30 min。倒出染色液,去离子水冲洗,自然风干。显微镜下观察,以 3 个及 3 个以上核的破骨细胞为准,计数 TRAP染色阳性的破骨细胞。
六、RT-PCR 法测定破骨分化特异性基因( TRAP、NFATc1 ) mRNA 的表达
按上述方法诱导细胞后,取出 6 孔板,弃掉培养基,PBS 冲洗 2 遍,用 Omega E.Z.N.A.Total RNA Kit I 试剂盒提取细胞内的 RNA。按 Takara Prime ScriptTMRT Master Mix 及 SYBR®Premix Ex TaqTMII 试剂盒说明书,进行逆转录盒扩增。
七、Western blot 法检测 LC3 及 mTOR 蛋白表达
按上述方法诱导细胞后,取出 6 孔板,弃掉培养基,PBS 冲洗 2 遍,每孔加入 RIPA 裂解液80 μl,晃动摇匀,冰上裂解 30 min,离心 ( 10000×g ) 2 min 后取上清液,测定蛋白浓度。采用 Western blot 法检测 LC3 及 mTOR 蛋白表达。
八、统计学处理
结 果
一、Rb2 对 RAW264.7 细胞的毒性作用检测
与对照组相比,不同浓度 Rb2 单独作用于 RAW 264.7 细胞,分别在 24 h、48 h 及 72 h 用 CCK-8 检测细胞活性,差异无统计学意义,P>0.05 ( 图 1 )。
二、Rb2 对破骨细胞分化的影响
与空白对照组相比,通过 TRAP 阳性计数,( 168.2±22.6 ),0.1 μM 组 ( 131.0±16.3 )、1 μM 组( 98.8±17.9 )、10 μM 组 ( 85.8±17.3 ),Rb2 可以明显地减少破骨细胞的数量并抑制破骨分化,差异有统计学意义,P<0.05 ( 图 2 )。
三、Rb2 对破骨分化基因表达的影响
通过 RT-PCR 检测 Rb2 对破骨基因 mRNA 表达的影响 ( TRAP 和 NFATc1 ),与对照组相比,Rb2 干预组破骨分化特异性基因的表达量明显降低,差异有统计学意义,P<0.05 ( 图 3 )。
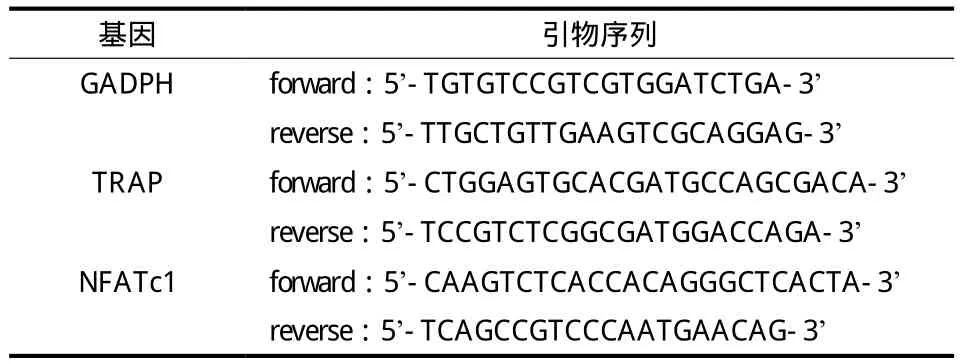
表 1 RT-PCR 引物的碱基序列表Tab.1 List of base sequences of RT-PCR primers
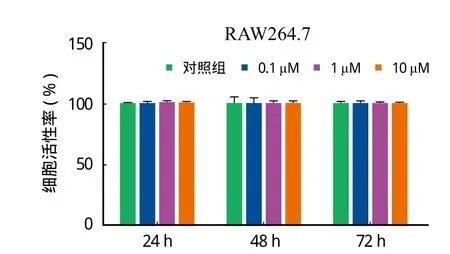
图 1 Rb2 对于 RAW264.7 细胞的毒性作用观测Fig.1 Toxic effects of Rb2 on RAW264.7 cells
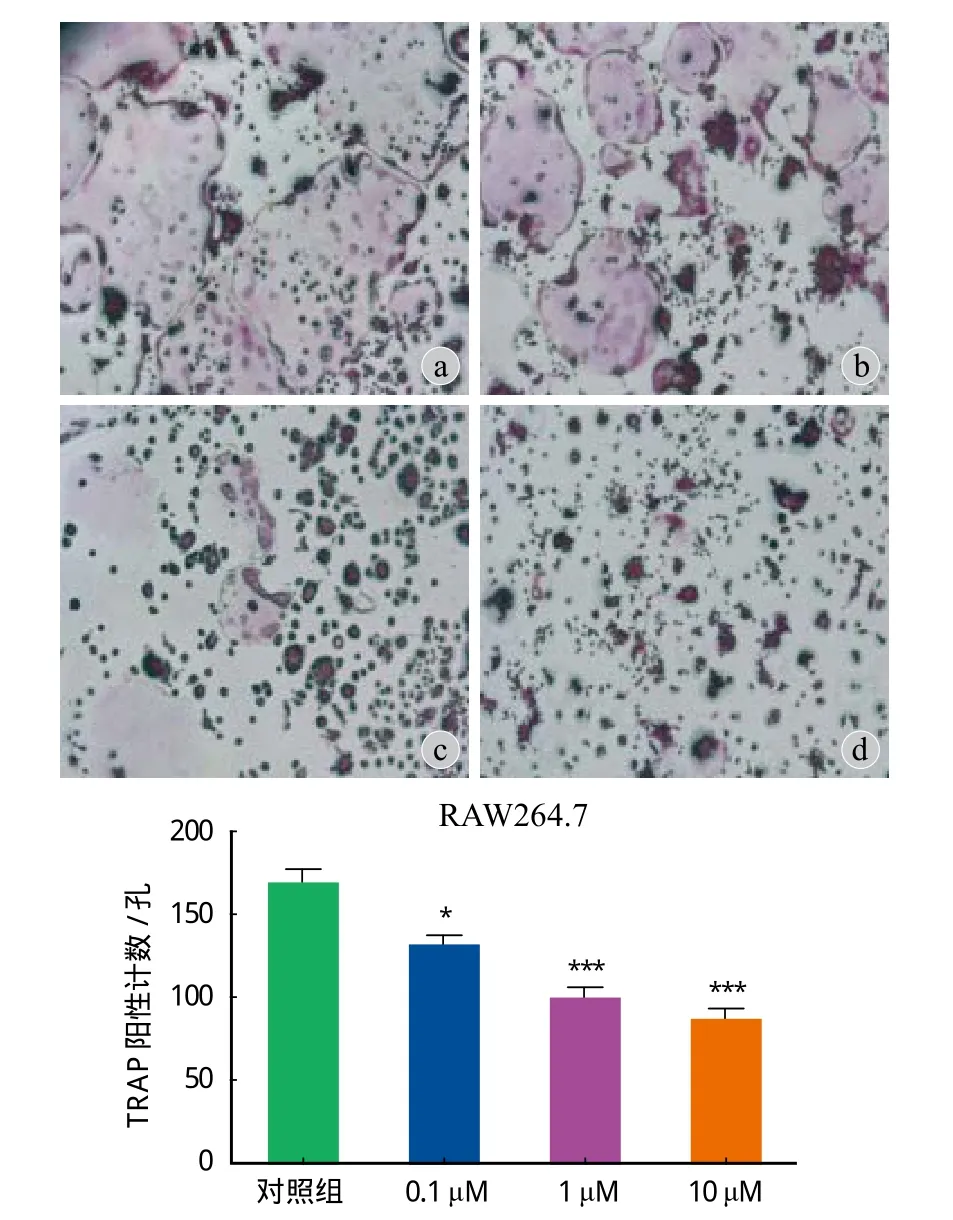
图 2 TRAP 染色阳性计数,a 为空白对照组,b 为 0.1 μM Rb2组,c 为 1 μM Rb2 组,d 为 10 μM Rb2 组 ( 图片放大倍数 50 倍 )Fig.2 TRAP positive staining count, a: blank control group. b:0.1 μM Rb2. c: 1 μM Rb2. d: 10 μM Rb2. ( × 50 )
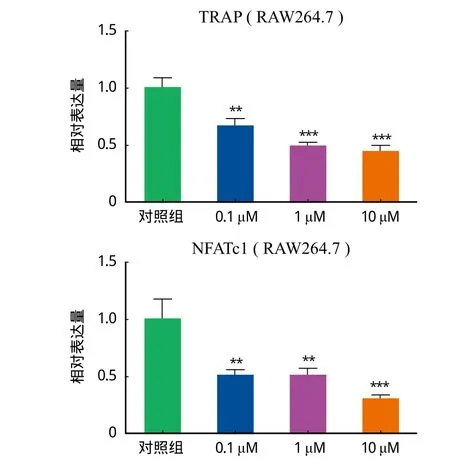
图 3 破骨基因 TRAP 和 NFATc1 的表达情况Fig.3 Expressions of osteoclast genes TRAP and NFATc1
四、自噬相关蛋白 LC3 及信号通路 mTOR 蛋白表达情况
与对照组相比,随着 Rb2 浓度增加,LC3 II /LC3 I 比值明显增大,差异有统计学意义 ( P<0.05 )。如图 6,以 β-actin 为实验标准化内参,随着 Rb2 浓度增加,信号通路 mTOR 蛋白逐渐减少,差异有统计学意义,P<0.05 ( 图 4、5 )。

图 4 不同浓度 Rb2 组 LC3 的 Western-blot 结果Fig.4 LC3 western-blot results of different concentrations of Rb2 groups
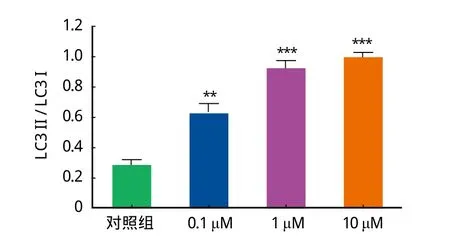
图 5 不同浓度 Rb2 组 LC3 II / LC3 I 比值Fig.5 LC3 II / LC3 I ratio in different concentrations of Rb2 groups

图 6 不同浓度 Rb2 组 mTOR 的 Western-blot 结果Fig.6 mTOR western-blot results of different concentrations of Rb2 groups
讨 论
正常人体骨质中,成骨细胞与破骨细胞活动处于一种动态平衡状态,而几乎在所有情况下,骨质疏松患者存在着骨吸收和骨形成的失衡,通常表现为骨形成减弱或者正常,而破骨细胞介导的骨吸收明显增强[6]。因此破骨细胞的功能活动在骨转化的过程中起着至关重要的作用,抑制破骨细胞的活动成为预防和治疗骨质疏松的一个重点[7-8]。
刘晓青等[9]学者曾发现人参水煎剂有增加骨量的趋势,增加骨形成,并对子宫无刺激作用,有预防去卵巢大鼠骨量丢失的作用。吕祥等[10]人研究表明,人参皂苷可以改善骨代谢生化指标及骨生物力学性能,拮抗糖皮质激素性骨质疏松大鼠的骨丢失。但无论人参水煎剂还是人参皂苷,均是混合物,具体何种单体发挥作用及其机制并不明了。我们课题组通过使用人参中最大量的有效成分人参皂苷 Rb2,通过体外和小鼠体内试验,发现 Rb2 能改善骨质疏松骨的骨微结构,提高骨矿物质密度,增强了矿化和成骨特异性基因的表达。本试验研究发现,人参皂苷 Rb2,可以减少破骨细胞形成并抑制破骨细胞的分化。同时,自噬相关蛋白 LC3 II /LC3 I 比值随着 Rb2 浓度增加而增高。当自噬激活时,LC3 I 被激活转化为 LC3 II,它正是自噬泡膜的重要组成部分,LC3 II / LC3 I 比值在很大程度上反映了自噬的活化程度。很多研究表明,自噬能调节破骨细胞、成骨细胞核骨细胞的功能,这表明自噬对于骨量的平衡至关重要[11-12]。因此 Rb2 很可能是通过自噬途径调节破骨细胞的功能。有研究表明自噬的激活是 mTOR 信号通路依赖的[13]。自噬在破骨细胞的增殖与分化过程中本身起着重要的作用,破骨细胞表达 S1PR ( 1-磷酸鞘氨醇受体 ),S1P 通过调节 mTOR 的活力,与自噬过程相互作用,促进了破骨细胞凋亡,通过凋亡作用,可以调控破骨细胞的分化[14]。笔者试验发现信号通路 mTOR 蛋白随着Rb2 浓度增加逐渐减少,表明 Rb2 可以抑制 mTOR通路蛋白活性,从而激活自噬。
综上所述,人参皂苷 Rb2 可能通过激活自噬途径抑制破骨细胞生成,调节破骨细胞功能,而mTOR 通路在此过程中起到重要作用。但 mTOR 通路是否为其主要的有效途径,仍需后续试验验证,并且其它信号通路在此过程中有何影响也有待进一步研究。
[1] Arslan A, Orkun S, Aydin GL, et al. Effects of ovariectomy and ascorbic acid supplement on oxidative stress parameters and bone mineral density in rats[J]. Libyan J Med. 2011, 6(1):438.
[2] Soda T, Fukumoto R, Hayashi T, et al. A case of prostate cancer associated with bisphosphonate-related osteonecrosis of the jaw followed by retropharyngeal abscess[J]. Hinyokika Kiyo, 2013,59(9):587-591.
[3] Boonen S, Reginster JY, Kaufman JM, et al. Fracture risk and zoledronic acid in men with osteoporosis[J]. N Engl J Med,2012, 367(18):1714-1723.
[4] Gao B, Huang Q, Jie Q, et al. Ginsenoside-Rb2 inhibits dexamethasone-induced apoptosis through promotion of GPR120 induction in bone marrow-derived mesenchymal stem cells[J]. Stem Cells Dev, 2015, 24(6):781-790.
[5] Huang Q, Gao B, Jie Q, et al. Ginsenoside-Rb2 displays antiosteoporosis effects through reducing oxidative damage and bone-resorbing cytokines during osteogenesis[J]. Bone, 2014,66:306-314.
[6] Akesson K. New approaches to pharmacological treatment of osteoporosis[J]. Bull World Health Organ, 2003, 81(9):657-664.
[7] 侯建明, 蓝旭华, 吴晖南, 等. 近 5 年国内外骨质疏松症诊疗指南比较[J]. 中华关节外科杂志 (电子版), 2012, 6(3):84-88.
[8] Sims NA, Martin TJ. Coupling the activities of bone formation and resorption: amultitude of signals within the basic multicellular unit[J]. Bonekey Rep, 2014, 3:481.
[9] 刘晓青, 崔燎, 吴铁, 等. 人参水煎剂防治去卵巢大鼠骨量丢失的骨形态计量学观察[J]. 中国骨质疏松杂志, 2003, 9(4):304-307.
[10] 吕祥, 杜娟, 程彬彬. 人参皂苷抗糖皮质激素诱发骨质疏松的效应及机制研究[J]. 世界中医药, 2012, 7(2):166-168.
[11] Darcy A, Meltzer M, Miller J, et al. Anovel library screen identifies immunosuppressors that promote osteoblast differentiation[J]. Bone, 2012, 50(6):1294-1303.
[12] Onal M, Piemontese M, Xiong J, et al. Suppression of autophagy in osteocytes mimics skeletal aging[J]. J Biol Chem,2013, 288(24):17432-17440.
[13] 赵明明, 赵永博, 罗鹏. PI3K / Akt 信号通路对神经元机械性损伤诱导的自噬调节作用[J]. 中华神经外科疾病研究杂志,2012, 11(6):491-494.
[14] Ishii M, Kikuta J. Sphingosine-1-phosphate signaling controlling osteoclasts and bone homeostasis[J]. Biochim Biophys Acta, 2013, 1831(1):223-227.
Effects of ginsenoside Rb2 on osteoclast regulation in vitro
SU Ke, QIU Yu-cheng, WANG Chun-mei, YUAN Zhi.Department of Orthopedics, Xijing Hospital, the fourth Military Medical University, Xi’an, Shaanxi, 710032, China
YUAN Zhi, Email: 605991889@qq.com
Objective To investigate effects and mechanism of ginsenoside Rb2 on osteoclasts in vitro.Methods The mouse osteoclast precursor cells RAW 264.7 were cultivated to induce osteoclasts. Rb2 ( 0.1 μM,1 μM, 10 μM ) was respectively added in the culture solution. CCK-8 was used for the detection of drug toxicity.The morphology and count of osteoclasts were observed by TRAP staining. The expression of osteoclast specific gene mRNA, such as TRAP and NFATc1, was detected by RT-PCR. Western blot technique was used to detect the expression levels of LC3 I, LC3 II and mTOR proteins. Results Compared with the control group ( 168.2 ± 22.6 ), the number of osteoclasts decreased significantly: group 0.1 μM ( 131.0 ± 16.3 ), P = 0.018; group 1 μM ( 98.8 ± 17.9 ),P < 0.01; group 10 μM ( 85.8 ± 17.3 ), P < 0.01. The expression of TRAP and NFATc1 osteoclast specific gene mRNA decreased significantly, the ratio of LC3, II / LC3 and I increased significantly, and the amount of mTOR decreased,P < 0.01. Conclusions Rb2 may affects the expression of osteoclast genes by autophagy pathway to reduce the osteoclast formation. mTOR pathway plays an important role in this process.
Ginsenosides; Osteoclasts; Autophagy; Osteoporosis
10.3969/j.issn.2095-252X.2017.11.016
R915
国家自然科学基金 ( 81570801 )
710032 西安,第四军医大学西京医院骨科
袁志,Email: 605991889@qq.com
2017-06-20 )
( 本文编辑:裴艳宏 )
