经直肠腔内超声造影在直肠肿瘤鉴别诊断中的应用
——以1例病例报告为例
2017-11-20张丽,管玲,陆云
张 丽,管 玲,陆 云
(甘肃省肿瘤医院,甘肃 兰州 730050)
经直肠腔内超声造影在直肠肿瘤鉴别诊断中的应用
——以1例病例报告为例
张 丽,管 玲*,陆 云
(甘肃省肿瘤医院,甘肃 兰州 730050)
超声造影;直肠肿瘤;腔内超声;鉴别诊断
1 病例相关情况
患者,女性,52岁,肛门不适数月,偶有便血;直肠指诊发现:距肛门6厘米10点至1点处可触及一5×3 cm肿物,质硬,触血阴性;外院肠镜提示:直肠息肉。经直肠腔内双平面超声检查显示(见图1):距肛门6~7 cm直肠肛管9点至12点方向处自黏膜层至浆膜层见一不规则低回声区,范围5.0×2.7 cm,边界欠清晰,黏膜面凹凸不平,局部区域形成一基底0.7 cm、深1.4 cm的凹陷区,内附着耦合剂回声;瘤体区肠壁层次消失,局部区域向浆膜层凸出至周围脂肪层。彩色多普勒血流显示:瘤体内部见丰富穿入的血流信号。超声提示:直肠肛管自黏膜至浆膜层实性占位性病变,局部区域突破至脂肪层,局部区域溃疡形成,直肠恶性肿瘤不排外,T3期。
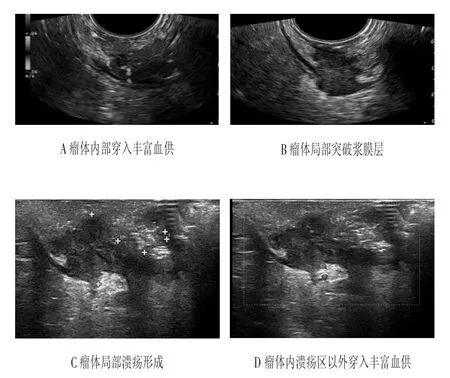
图1 经直肠腔内双平面超声
行静脉超声造影显示(见图2):正常直肠壁或非肿瘤部位的直肠壁超声造影呈点状缓慢均匀低增强,瘤体区造影剂16秒开始增强,增强早期呈不均匀团状高增强,增强晚期大部分区域造影剂消退,呈不均匀低增强,呈快进快退增强模式,局部区域突破浆膜层至周围脂肪层,溃疡区域似耦合剂回声区域从增强早期至增强晚期始终未见造影剂进入。超声造影提示:直肠肛管肿瘤造影剂呈快进快退表现,局部区域突破浆膜层至周围脂肪层,局部区域溃疡形成,多考虑直肠恶性肿瘤伴溃疡形成,肿瘤分期:T3期。

图2 直肠静脉超声造影
我院肠镜提示:距肛门8~12 cm直肠左侧壁至后壁可见火山口样新生物,占据1/3直肠壁,在肠镜下取少量直肠肿物并送活检。盆部MRI检查提示:直肠壁局限性不均匀增厚,形成凸向腔内的软组织肿块,直肠周围脂肪组织间隙受侵,直肠周围脂肪组织间隙内见肿大淋巴结。
在全麻下行腹腔镜下直肠肿瘤切除术并送活检,病理学检查回报:见20×8×4 cm的直肠肿物切除标本,距一侧切缘1.5 cm、另一侧4 cm处见4×3.5 cm溃疡型肿物,切面灰白、质中(见图3);病理诊断:直肠癌根治标本:溃疡型-中分化腺癌(见图4),癌组织广泛浸润间质达肠壁下脂肪组织,伴多灶状凝固性坏死,间质纤维化,炎细胞反应(++)。免疫组化切片CD31、D2-40及S-100,脉管内未见明显癌栓,神经见侵犯;上、下切缘(-),环周切缘(-)。检出:肠系膜淋巴结见癌转移10/13,另送肠系膜下级根部淋巴结未见癌转移0/2,合计转移:10/15。免疫组化结果:肿瘤细胞 MLH1(+)、MSH2(+)、PMS2(+)、MSH6(+)。
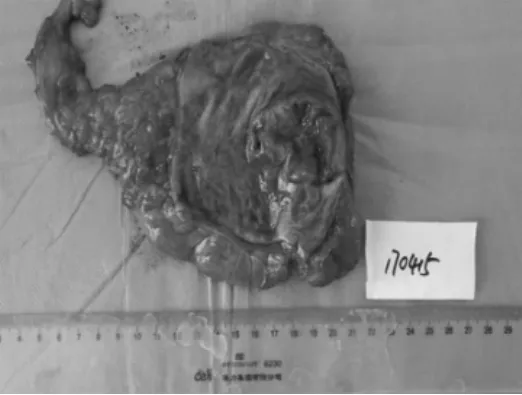
图3 直肠肿物
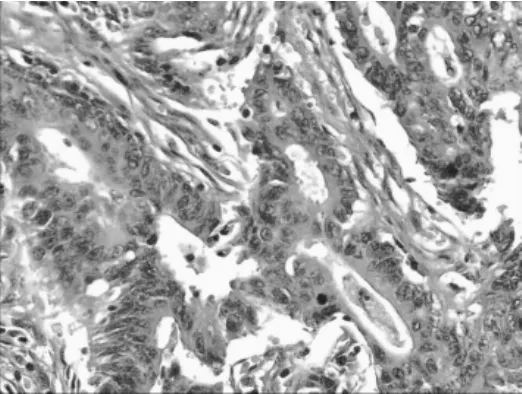
图4 直肠肿物标本切片镜下观
2 讨论
2.1 经直肠腔内超声造影在直肠肿瘤中的鉴别诊断
直肠癌应与一些凸入肠腔的良性及炎性病变相鉴别。首先,直肠炎性病变如脓肿,直肠良性病变如直肠腺瘤、平滑肌瘤以及孤立性直肠溃疡等虽有肿物凸入肠腔且肠壁明显增厚,特别是固有肌层明显增厚,但直肠腔内超声造影可清晰探及且辨别肠壁层次无明显破坏,而直肠癌则会出现不同层次的肠壁破坏及异常的血供特征。其次,直肠良性病变的超声造影特征是与周围正常肠壁同步增强、同步消退,达到峰值时呈等增强,增强方式的表现较为均匀一致;直肠脓肿的超声造影特征为快进慢退或快进不退,达到峰值时呈高增强,脓肿急性期造影剂消退早于慢性期,且慢性期伴有造影剂不增强的坏死区域,可呈蜂窝状,增强方式的表现不均匀一致;直肠癌的造影特征为明显的快进快退,达到峰值时呈团状高增强,与周围肠壁形成明显对比[1]。直肠癌有肠壁明显破坏、血供异常丰富以及快进快退的特征性造影模式,借此可与其他病变相鉴别。
2.2 直肠癌分期的重要性
直肠癌是常见的消化道恶性肿瘤,占消化道癌的第二位,发病年龄多在40岁以上,男性多于女性,发病率和死亡率近年来呈上升趋势,发病率占恶性肿瘤的10%,在全球恶性肿瘤的发病率中排名第三;占肿瘤所致死亡的8%,排名第四[1]。有研究报道,我国直肠癌多发于50~55岁人群[2],主要为男性,因早期直肠癌无特异性症状,起病隐匿,易与其他直肠肛管良性病变混淆,且患者常常不够重视等因素,多数患者临床确诊时已为中晚期。T3、T4期患者术后5年生存率分别不到40%、12%,而早期直肠癌(T1、T2期)术后5年生存率可达80%~90%[3]。直肠癌治疗首选外科手术,T1期及部分T2期直肠癌可行局部切除,T2、T3期直肠癌的鉴别相对重要,若无淋巴结转移者,可经肠镜或肛门局部切除,术后恢复及预后效果良好,T3、T4期患者或存在淋巴结转移者,临床先行辅助化疗和/或放疗,使瘤体缩小,降低分期,增加瘤体切除的可能性,减少局部复发。直肠癌早期明确诊断并准确分期直接影响直肠癌患者治疗方案的制订和手术方式的选择[4]。直肠癌指南中指出,直肠癌术前分期直接关系到治疗方案的制订,术前分期越准确,越有利于患者术前行辅助化疗,促使恶性肿瘤分期降低,在降低直肠癌术后复发率、改善其预后康复疗效上有重要作用[5]。Ⅰ期直肠癌单纯手术切除患者5年生存率接近90%,而不能切除的Ⅳ期直肠癌患者采用强化化疗,中位生存期仅为24个月[6]。
2.3 直肠肿瘤影像学诊断方法
直肠肿瘤诊断的影像学方法主要有超声、肠镜、CT、MRI,CT、肠镜对于发现远处病灶有较高的准确性,可清晰显示病灶与周围组织的关系以及淋巴结是否转移,但无法清晰显示肠壁各层结构,难以判断肿瘤浸润深度,对于诊断T分期的准确性较低;MRI和PET-CT对直肠癌的术前分期虽有较高的准确性,但价格相对昂贵;经直肠腔内超声可观察肿瘤的形态、大小、厚度、方位,肿瘤下缘距肛缘距离,肿瘤最外缘距肛门外括约肌或肛提肌距离,内部回声,肠壁结构及浸润层次,肠周淋巴结的形态、回声、大小、个数、有无血流信号,邻近脏器有无受累等情况[7],起到了定位及初步定性的作用;而经直肠腔内超声联合了超声造影(CEUS)技术以后,可在二维超声常规显示病变的基础上,显示肿瘤新生血管的走形及微血管的变化,了解肿瘤的动态增强特点,将造影的整个增强过程分为增强早期和增强晚期[8],增强水平以肠壁回声强度作为对照,从而更精准地确定病变部位侵及肠壁的层次范围和有无周围组织的浸润,其对于早期肿瘤,尤其是T1、T2期肿瘤的诊断有较高的准确性,能更客观地对肿瘤进行分型及UT分期。研究显示,超声造影诊断UT分期的总准确率为91%左右,较常规腔内超声诊断UT分期的总准确率有所提高[9]。
2.4 经直肠腔内超声造影(CEUS)的技术优点
超声造影价格便宜、简便易行、重复性强,无腹壁衰减和胃肠道气体的干扰,能清晰显示肠壁结构、病灶的局部浸润、组织器官侵犯以及是否有肠周淋巴结转移,对于早期肿瘤,尤其是T1、T2期肿瘤的诊断有较高的准确性。直肠腔内超声造影能为临床提供直肠癌术前UT分期,从而指导临床选择治疗方法,是经内镜或经肛门切除肿瘤,还是术前先行化疗和/或放疗;还可用于直肠癌术后监测,超声造影可以通过评价肿瘤微循环的变化情况来反映肿瘤治疗后期的效果、有无局部复发,鉴别术后手术区实性占位的性质,区分术后瘢痕与局部复发。有文献报道,造影后肿瘤内部造影剂消退速度似与其恶性程度存在正相关关系(P<0.05)[10],今后可通过大样本进一步分析。
[1]Sadahiro S,Morita S,Sasaki K,et al.Treatment rationale and study design for clinical trial on the efficacy of UFT/LV for stage II colorectal cancer with risk factors for recurrence(JFMC46-1201)[J].Clinical colorectal cancer,2015,14(4):277-280.
[2]代珍,郑荣寿,邹小农,等.中国结直肠癌发病趋势分析和预测[J].中华预防医学杂志,2012,46(7):598-603.
[3]钟锐,崔春艳,郑小丽,等.磁共振弥散加权成像在直肠癌诊断及预后中的应用研究[J].中国 CT 和 MRI杂志,2013,11(5):69-71.
[4]Geng F,Wang Z,Yin H,et al.Molecular targeted drugs and treatment of colorectal cancer:recent progress and future perspectives[J].Cancer Biother Radiopharm,2017,32(5):149-160.
[5]王昊,陈平.经直肠超声、磁共振和多层螺旋CT在直肠癌术前分期的应用[J].中国现代普通外科进展,2012,15(5):380-384.
[6]Wang C,Li P,Xuan J,et al.Cholesterol enhances colorectal cancer progression via ROS elevation and MAPK signaling pathway activation[J].Cell Physiol Biochem,2017,42(2):729-742.
[7]Tian YF,Hsieh PL,Lin CY,et al.High expression of aldolase B confers a poor prognosis for rectal cancer patients receiving neoadjuvant chemoradiotherapy[J].J Cancer,2017(7):1197-1204.
[8]Chiu HM,Chen SL,Yen AM,et al.Effectiveness of fecal immunochemical testing in reducing colorectal cancer mortality from the One Million Taiwanese Screening Program[J].Cancer,2015(18):3221-3229.
[9]Navarro M,Nicolas A,Ferrandez A,et al.Colorectal cancer population screening programs worldwide in 2016:An update[J].World J Gastroenterol,2017,23(20):3632-3642.
[10]蔡艳,谢虹桥,谢冲稳,等.经直肠超声造影诊断直肠癌的价值[J].临床超声医学杂志,2012,14(8):530-533.
R73
B
1671-1246(2017)22-0145-03
(*
管玲)
