分泌性乳腺癌2例
2017-11-20林雪梅王小林
林雪梅,袁 聪,王小林
分泌性乳腺癌2例
林雪梅1,袁 聪2,王小林1
乳腺肿瘤;分泌性乳腺癌;临床病理;免疫组织化学;ETV6-NTRK3;病例报道
例1,患者女性,69岁,3年前无意发现左侧乳腺包块,位于外上象限,单个,近期发现包块进行性长大,伴疼痛、压痛入院。彩色多普勒血流显像(CDFI):内部可见短棒状血流信号,BI-RADS分级为5级。DR检查:左侧乳腺中央区可见一不规则肿块影,其内见多形性钙化影,边缘不清,可见毛刺影。专科检查:左侧乳头内陷,无溢液性;左侧乳腺外上象限可扪及肿块,大小4 cm×4 cm,边界不清,形态不规则,活动度欠佳,有压痛;与皮肤无粘连,与胸壁无侵犯。右侧乳房未扪及明显异常,腋窝淋巴结肿大,直径约1 cm。完善检查后行肿块穿刺术并送检。穿刺病理结果示左乳浸润性癌,行乳腺改良根治术。例2,患者女性,58岁,发现右乳包块1个月入院。CDFI:结节周边可见少许血流信号,BI-RADS分级为5级。DR检查:右侧乳腺外上象限见一团块样密度增高影,形态欠规则,呈浅分叶改变,边缘欠光整,可见毛刺征,BI-RADS分级为5级。专科检查:右乳头无内陷,无溢液性;右侧乳腺外上象限可扪及肿块,大小2 cm×2 cm;边界不清,形态不规则,活动度欠佳,无压痛,与皮肤无粘连,与胸壁无侵犯。左侧乳房未扪及明显异常,区域淋巴结未扪及明显肿大。完善检查后行肿块扩大切除+同侧腋窝淋巴结清扫。
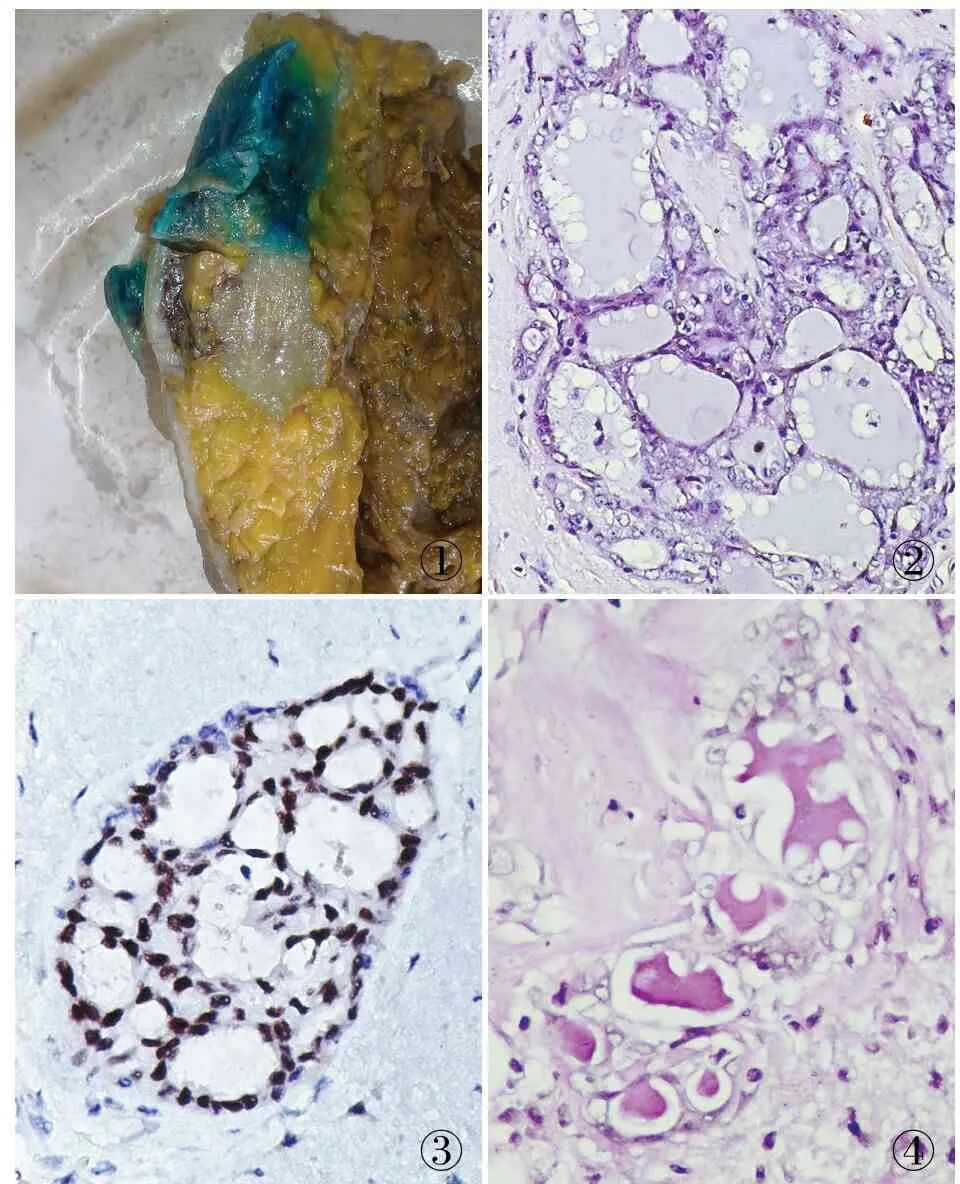
病理检查眼观:例1,送检左侧乳腺改良根治标本一个,大小24 cm×13 cm×4 cm,皮瓣面积13.5 cm×10 cm,乳头内陷,距乳头3.5 cm处外上象限见一穿刺点,穿刺点下方1 cm处见一大小3 cm×2.5 cm×1 cm肿块(图1),肿块切面灰白色,质实、质硬,与周围组织分界欠清,同侧腋窝脂肪组织内扪及淋巴结12枚。例2,带皮组织一块,大小7.7 cm×6 cm×2.5 cm,皮瓣面积6 cm×2 cm,切面见大小1.9 cm×1.5 cm×1.4 cm肿块,肿块切面灰白、灰黄色,质实、质硬,灶性出血,与周围组织分界欠清。另送检腋窝淋巴结10枚及前哨淋巴结3枚。镜检:2例肿瘤细胞均呈巢、团状分布,瘤细胞排列成管泡状、囊状或实性结构(图2),且呈现两类形态:胞质内含嗜酸性颗粒的分泌细胞(A型细胞)和胞质呈透明空泡样的分泌细胞(B型细胞)。两种细胞胞膜均较清楚,胞质丰富;核圆形或椭圆形,大小较一致,位于细胞中央或基底部,染色质聚集于核膜下,致使核膜增厚深染;可见1~2个偏位小核仁,甚至少数细胞可见核沟,未见核分裂象。肿瘤间质纤维组织玻璃样变性。免疫表型和特染染色:例1,E-cadherin、p120、S-100均阳性;ER(阳性,约90%)(图3);HER-2不表达,p63、GCDFP-15、PR均阴性,Ki-67增殖指数约10%。例2,E-cadherin、p120、S-100均阳性;ER(阳性,约20%),HER-2不表达,p63、GCDFP-15、PR均阴性;Ki-67增殖指数约20%。2例PAS染色均阳性(图4)。
①②③④
图1肿块大体灰白、实性、与周围组织分界欠清图2肿瘤细胞排列成囊样,囊腔内见大量红染均质的似乳汁样物质及吸收空泡图3肿瘤细胞ER呈阳性,SP法图4囊腔内的物质染色呈阳性,PAS染色
病理诊断:例1左侧乳腺为分泌性癌,同侧腋窝淋巴结1/12枚见癌转移。例2右侧乳腺为分泌性癌,送检腋窝淋巴结10枚和前哨淋巴结3枚均未见癌转移。
讨论分泌性乳腺癌作为浸润性乳腺癌的亚型,最初由McDivitt和Stewart[1]报道。近年人们逐渐认识到其特殊的流行病学、组织学形态和低发病率(约0.03%)[2-3]等特点,WHO(2012)乳腺肿瘤病理学及遗传学分类中,将分泌性乳腺癌列为独立类型归入特殊类型的乳腺癌中[2]。
分泌性乳腺癌的发病年龄3~87岁,且国内报道的中位年龄34~62岁,高于国外的25~40岁[4~6]。其次,患者临床通常表现为乳腺内的无痛性、边界清楚、活动度良好的肿块,类似于乳腺纤维腺瘤,呈惰性生长,肿块直径平均3 cm(0.5~12 cm)[7],且肿块的肉眼观察与其他类型乳腺癌并无明显区别,其诊断主要依据肿块的镜下组织学特点:(1)肿瘤细胞排列成3种结构:微囊状、小管状、实性片状,3种结构通常以不同比例同时存在。(2)肿瘤细胞形态分为2类:胞质内含嗜酸性颗粒的分泌细胞(A型细胞)和胞质呈透明空泡样的分泌细胞(B型细胞)。(3)细胞内外分泌物PAS呈阳性。
本组2例患者均表现为乳腺内肿块(最大径分别为3 cm和1.9 cm),切面灰白色,实性、质硬,边界不清,与其他类型乳腺癌并无区别;2例肿块镜下均可见瘤细胞排列成管状、囊状和实性片状结构,且可见典型的A、B两类细胞,细胞异型性小,未见核分裂象,且管腔内和细胞内分泌物PAS染色阳性,支持分泌性乳腺癌的诊断。
免疫表型:本组2例分泌性乳腺癌肿瘤细胞ER均有不同程度的表达(分别为90%、20%),PR和HER-2均阴性。虽然Yorozuya等[8]认为分泌性乳腺癌典型的基因组特征是肿瘤细胞ER、PR、HER-2均阴性,属于三阴型乳腺癌,但国外也有文献报道肿瘤细胞ER、PR、HER-2均可出现不同程度表达[9-11]。此外,本组2例分泌性乳腺癌肿瘤细胞S-100均阳性,p63、GCDFP-15均阴性,与文献报道相符。
遗传学特点:国外分子遗传学研究[12]显示分泌性乳腺癌存在染色体t(12;15)(p13;q25)平衡易位,ETS变异基因6(ETV6)和神经酪氨酸激酶受体3(NTRK3)基因发生重排,产生只能在小儿恶性间叶性肿瘤中(先天性纤维肉瘤和先天性中胚叶肾瘤)检测到的ETV6-NTRK3基因融合,进而活化MAPK和PI3K/Akt1信号通路,促进癌细胞增殖和存活。这种基因融合只能在分泌性乳腺癌中能检测出来,在其他类型乳腺癌中均未检测到该基因[13]。
分泌性乳腺癌需与以下病变鉴别。(1)分泌期乳腺及泌乳腺瘤:主要发生于妊娠期或哺乳期,镜下小叶结构完整、紧密聚集,肌上皮和基膜完整;而分泌性乳腺癌具有浸润破坏性,镜下缺乏小叶结构或小叶结构不完整,肌上皮缺失或不完整。免疫组化标记p63、Calponin、CK5/6等肌上皮标记可资鉴别。(2)富于脂质癌:两者肿瘤细胞胞质均可呈透明空泡样外观,但富于脂质癌胞质PAS染色阴性,而脂肪染色阳性;分泌性乳腺癌胞质PAS染色阳性,而脂肪染色阴性。(3)黏液腺癌:肉眼观察肿瘤切面呈果冻样,有纤细的间隔,镜下瘤细胞分泌的黏液几乎全部位于细胞外并形成黏液湖,瘤细胞漂浮于黏液湖中;与分泌性乳腺癌肿瘤细胞的组织学特点截然不同。(4)大汗腺癌:细胞异型性大,核分裂易见,形成的腺腔腔缘见球样顶浆分泌小突起,细胞内可有PAS染色强阳性的颗粒,但细胞外无PAS染色阳性的分泌物。
总之,分泌性乳腺癌患者年龄小、肿块直径<2 cm、有明显边界者预后较好[14],患者为男性、有乳腺癌家族史、Ki-67增殖指数高者提示预后不良[15]。本组2例肿块最大径分别为3 cm和1.9 cm,其中最大径为3 cm者伴同侧腋窝淋巴结1/12枚癌转移,提示该患者预后相对不良。本组2例患者均未获得随访。
目前,肿瘤治疗以外科手术为主。针对不同年龄患者,手术切除范围不同。Costa等[16]认为儿童患者宜采取肿块局部切除+前哨淋巴结活检/完整腋窝淋巴结清扫;成人患者则根据肿瘤大小及淋巴结转移情况,选择肿块局部切除或乳腺改良根治。此外,由于分泌性乳腺癌发生全身性转移的情况较少,Lombardi等[10]认为分泌性乳腺癌患者并不适宜增加任何的辅助治疗,且分泌性乳腺癌细胞对多种化疗方案并不敏感。因此,不推荐患者行任何的辅助治疗。由于Lax等[17]报道肿瘤切除20年后再复发的病例,因此该病患者需终生随访。
[1] McDivitt R W, Stewart F W. Breast carcinoma in children[J]. JAMA, 1966,195(5):388-390.
[2] 齐晓伟,姜 军. 2012年《WHO乳腺肿瘤组织学分类》介绍[J]. 中华乳腺病杂志, 2012,6(5):586-591.
[3] De B E, Askoxylakis J, Giannikaki E,etal. Secretory carcinoma of the male breast[J]. Ann Surg Oncol, 2002,9(7):663-667.
[4] 李大力,杨文涛,肖秀英,等. 乳腺分泌性癌临床病理及免疫表型的研究[C]. 北京:中华医学会杂志社, 2011:93-97.
[5] Cadoo K A, McArdle O, O′Shea A M,etal. Management of unusual histological types of breast cancer[J]. Oncologist, 2012,17(9):1135-1145.
[6] 王春艳,祁晓莉,张铁华,刘洪波. 乳腺分泌性癌9例临床病理及预后分析[J]. 临床与实验病理学杂志, 2013,29(9):1013-1015.
[7] 付 丽,刘彤华,傅西林. 乳腺疾病病理彩色图谱[M]. 北京:人民卫生出版社, 2013:221-224.
[8] Yorozuya K, Takahashi E, Kousaka J,etal. A case of estrogen receptor positive secretory carcinoma in a 9-year-old girl with ETV6-NTRK3 fusion gene[J]. Jpn J Clin Oncol, 2012,42(3):208-211.
[9] Gabal S, Talaat S. Secretory carcinoma of male breast: case report and review of the literature[J]. Int J Breast Cancer, 2011,2011:704657.
[10] Lombardi A, Maggi S, Bersigotti L,etal. Secretory breast cancer. Case report[J]. G Chir Vol, 2013,34(4):125-127.
[11] Diallo R, Scharfer K L, Bankfalvi A,etal. Secretory carcinoma of the breast: a distinct variant of invasive ductal carcinoma assessed by comparative genomic hybridization and immunohistochemistry[J]. Hum Pathol, 2003,34(12):1299-1305.
[12] Tognon C, Knezevich S R, Huntsman D,etal. Expression of the ETV6-NTRK3 gene fusion as a primary event in human secretory breast carcinoma[J]. Cancer Cell, 2002, 2(5):367-376.
[13] Makretsov N, He M, Hayes M,etal. A fluorescence in situ hybridization study of ETV6-NTRK3 fusion gene in secretory breast carcinoma[J]. Genes Chronosomes Cancer, 2004,40(2):152-157.
[14] Tixier H, Picard A, Guiu S,etal. Long-term recurrence of secretory breast carcinoma with metastatic sentinel lymph nodes[J]. Arch Gynecol Obster, 2011,238(Suppl 1):77-78.
[15] 徐 艳,石群立,周晓军,等. 男性乳腺分泌性癌一例[J]. 中华病理学杂志, 2009,38(10):707-708.
[16] Costa N M, Rodrigues H, Pereira H,etal. Secretory breast carcinoma-case report and review of the medical literature[J]. Breast, 2004,13(4):353-355.
[17] Lax S F, Pizer E S, Ronnett B M,etal. Clear cell carcinoma of the endometrium is characterized by a distinctive profile of p53, Ki-67, estrogen, and progesterone receptor expression[J]. Hum Pathol, 1980,29(6):551-558.
时间:2017-9-18 6:23 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170918.0623.032.html
R 737.9
B
1001-7399(2017)09-1057-03
10.13315/j.cnki.cjcep.2017.09.032
接受日期:2017-06-28
1川北医学院病理教研室,南充 637000
2川北医学院附属医院消化内科,南充 637000
林雪梅,女,硕士,讲师。E-mail: linxuemei7@126.com
