氧化苦参碱对阿尔茨海默病认知功能障碍的作用研究*
2017-11-20丁未尧徐华容李彩蓉
丁未尧,周 凯,谢 航,徐华容,李彩蓉,蔡 飞**
(1.湖北科技学院糖尿病心脑血管病变湖北省重点实验室,湖北 咸宁 437100;2.湖北科技学院药学院药理学教研室)
氧化苦参碱对阿尔茨海默病认知功能障碍的作用研究*
丁未尧1,2,周 凯1,谢 航1,2,徐华容1,2,李彩蓉1,蔡 飞1,2**
(1.湖北科技学院糖尿病心脑血管病变湖北省重点实验室,湖北 咸宁 437100;2.湖北科技学院药学院药理学教研室)
目的研究氧化苦参碱(OMT)对阿尔茨海默病(AD)大鼠认知功能障碍的作用及机制。方法取32只雄性SD大鼠分为四组,正常对照组给予生理盐水灌胃;STZ组给于大鼠侧脑室注射链脲佐菌素(STZ)制作AD学习记忆障碍模型后给于生理盐水灌胃;STZ+OMT组在建立AD模型后给予OMT灌胃;OMT组给予OMT灌胃。每组各8只,连续给药2周。通过Morris水迷宫检测大鼠的学习记忆情况;Elisa法测定海马组织炎症因子的变化。结果大鼠Morris水迷宫行为学实验发现STZ组大鼠记住原有平台所在位置的能力较差,经过OMT治疗后,大鼠在目标象限停留的时间有明显的增加(P<0.05)。STZ组大鼠海马组织细胞因子TNF-α和IL-6的含量明显升高(P<0.01),经过OMT给药后,TNF-α和IL-6的含量明显的下降(P<0.01)。结论OMT可改善STZ侧脑室注射所致大鼠学习记忆损害,该作用与抑制脑组织炎性反应有关。
氧化苦参碱;链脲佐菌素;阿尔茨海默病;学习记忆
阿尔茨海默病(Alzheimer's disease,AD)是一种与年龄密切相关的中枢神经系统退行性病变,主要表现为学习、记忆等认知功能障碍。AD是导致痴呆症的主要原因之一,随着人口老龄化的增加,AD的发病率也呈现逐年升高的趋势,给患者、家庭以及社会带来巨大的经济负担。大量的研究表明[1],氧化应激以及炎症反应是AD神经元损伤的早特特征,寻找抑制氧化应激及炎症反应的药物,有助于防治AD神经元损伤及其认知功能障碍。
氧化苦参碱(Oxymatrine,OMT)是从豆科属植物苦参或平科植物广豆根中分离出来的生物碱,具有广泛的药理活性,在肝纤维化、病毒性肝炎、皮肤病、自身免疫性疾病的治疗中起到重要作用[2]。最近研究发现OMT可改善糖尿病所致的认知功能障碍,并且可通过Toll样受体抑制炎症反应防治脑组织损伤作用[2],但其是否对AD样认知功能障碍有作用,尚未见报道。本研究通过大鼠侧脑室注射链脲佐菌素(Streptozotocin,STZ)制作AD样学习记忆障碍动物模型,并给予OMT进行干预,从而研究OMT对STZ所致的AD学习记忆损害的防治作用及其可能机制。
1 材料与方法
1.1 实验动物和分组
32只雄性SPF级SD大鼠[购自武汉大学实验动物中心,许可证号:SCXK(鄂)2014],体重230~250g。实验共分为四组,每组各8只。正常对照组:灌胃1mL/100g生理盐水,连续2周;STZ组:侧脑室注射STZ建立AD模型,手术结束后给予灌胃1mL/100g生理盐水,连续2周;STZ+OMT组:侧脑室注射STZ建立AD模型,手术结束后灌胃OMT 50mg/(kg·d),连续2周;OMT组:灌胃OMT 50mg/(kg·d),连续2周。
1.2 AD样学习记忆障碍模型制备
采用10%水合氯醛腹腔注射麻醉大鼠并固定在立体定位仪上。去除大鼠颈部的毛,在前囟向后1.0mm,右侧旁开1.5mm处用微钻头钻开颅骨,用微量注射器将10μL的STZ溶液(1.5mg/kg)注射到右侧侧脑室(垂直进针3.6mm)。给药完成后用牙科粉对钻孔位置进行填补,常规饲养48h后在大鼠另一侧的侧脑室也同样进行注射。具体操作参考我们以前的方法进行[3]。
1.3 Morris水迷宫行为学实验
将大鼠放置Morris水迷宫的第Ⅰ象限中,将平台放置第III象限,让大鼠自由寻找平台,适应平台的位置,连续进行5d。在第6d,进行定位航行实验,记录大鼠从象限Ⅰ到达平台所需的时间,称为逃逸潜伏期。实验结束后撤除水下平台,进行空间探索实验,选取象限I作为入水点,记录90s内大鼠在平台原来所在象限Ⅲ内停留的时间,从而检测大鼠空间学习记忆能力。具体操作参考我们以前的实验方法进行[4]。
1.4 炎症因子检测
细胞因子TNF-α和IL-6检测采用ELISA法进行,用TNF-α和IL-6抗体包被微孔板形成固相抗体,往包被单抗的微孔中依次加入处理好的海马组织样本,再与辣根过氧化物酶标记的TNF-α和IL-6抗体结合,形成抗体-抗原-酶标抗体复合物,加底物3,3',5,5'-四甲基联苯胺显色。用酶标仪在450 nm波长下测定OD值,通过标准曲线计算样品中TNF-α和IL-6的浓度。具体按照试剂盒说明书进行操作。
1.5 统计学方法
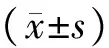
2 结 果
2.1 大鼠AD样学习记忆障碍分析
采用Morris水迷宫观察OMT对大鼠空间学习能力的影响。在定位巡航实验中发现,STZ组与正常对照组相比大鼠逃逸潜伏期明显延长,表现出较差的学习能力。STZ+OMT组、OMT组与STZ组相比显著提高了AD样学习记忆障碍大鼠的空间学习能力,表现为在水迷宫中找到目标平台所需要的时间显著缩短(P<0.01)。在空间探索实验中发现,STZ组大鼠记住原有平台所在位置的能力较差,表现为在目标象限停留的时间明显减少,经过OMT治疗后,大鼠在目标象限停留的时间有明显的增加(P<0.05)。Morris水迷宫实验结果表明OMT显著改善大鼠AD样学习记忆障碍。见表1。

表1 大鼠Morris水迷宫行为学实验
与正常对照组相比,*P<0.01;与STZ组相比,#P<0.05、##P<0.01
2.2 大鼠海马组织炎症因子检测
炎症反应是导致脑组织损伤的重要因素,我们检测了海马组织炎症因子含量的变化,结果发现STZ组大鼠海马组织细胞因子TNF-α和IL-6的含量较正常对照组明显升高(P<0.01),经过OMT给药后,TNF-α和IL-6的含量明显的下降(P<0.01)。研究还发现OMT对正常海马组织中的TNF-α及IL-6没有明显的影响(P>0.01)。以上研究结果表明,OMT可通过脑组织炎性细胞因子的水平,从而改善AD样学习记忆障碍。见表2。

表2 大鼠海马组织炎症因子检测结果
与正常对照组相比,*P<0.01;与STZ组相比,#P<0.01;与STZ+OMT组相比,△P<0.01
3 讨 论
AD是老年性痴呆症最为常见的形式之一,葡萄糖糖利用减少,能量代谢障碍以及炎症反应可能是AD认知功能障碍产生的重要原因[5]。大量研究发现AD的脑部病理特性和2型糖尿病脑部病变之间关系密切[6]。STZ是一种腹腔内注射可导致胰岛坏死的药物,常常用来制作糖尿病动物模型。侧脑室注射少量的STZ可引起大鼠的大脑皮质和海马区葡萄糖代谢降低、氧化应激损伤、炎性反应,其病理生理学改变与AD样学习记忆障碍模型的损伤非常相似,大鼠表现为学习、记忆和认知行为的损害,因此STZ侧脑室注射是制作AD痴呆动物模型的重要方法之一[7]。
在本研究中,我们首先使用Morris水迷宫来观察大鼠的空间学习记忆情况,结果发现侧脑室注射STZ的大鼠需要较长时间才能找到目标平台,并且在目标象限停留的时间也明显减少,反映出SZT侧脑室注射可导致大鼠空间学习障碍。通过给予OMT进行治疗后发现大鼠逃避潜伏期变短,并增加其在目标象限停留的时间,提示OMT具有防治AD样痴呆的作用。我们通过对海马组织TNF-α和IL-6水平的检测,证实了OMT可抑制炎性细胞因子的产生。
综上所述,OMT可改善STZ侧脑室注射所致大鼠学习记忆损害,该作用可能与抑制脑组织炎性反应有关。
[1]JEVTIC S,SENGAR A S,SALTER M W,et al.The role of the immune system in Alzheimer disease:etiology and treatment[J].Ageing Res Rev,2017,21(1):84
[2]ZHANG Y Y,YI M,HUANG Y P.Oxymatrine ameliorates doxorubicin-induced cardiotoxicity in rats[J].Cell Physiol Biochem,2017,43(2):626
[3]CAI F,LIU J,LI C,et al. Critical Role of endoplasmic reticulum stress in cognitive impairment induced by Microcystin-LR[J].Int J Mol Sci,2015,16(12):28077
[4]WANG J H,CHENG J,LI C R,et al.Modulation of Ca2+signals by epigallocatechin-3-gallate (EGCG) in cultured rat hippocampal neurons[J].Int J Mol Sci,2011,12(1):742
[5]RIVERA E J,GOLDIN A,FULMER N,et al.Insulin and insulin-like growth factor expression and function deteriorate with progression of Alzheimer's disease:link to brain reductions in acetylcholine[J].J Alzheimers Dis,2005,8(3):247
[6]LI L,HÖLSCHER C.Common pathological processes in Alzheimer disease and type 2 diabetes: a review[J].Brain Res Rev,2007,56(2):384
[7]SHARMA M,GUPTA Y K.Effect of chronic treatment of melatonin on learning,memory and oxidative deficiencies induced by intracerebroventricular streptozotocin in rats[J].Pharmacol Biochem Behav,2001,70(2-3):325
TheEffectsofOxymatrineonLearningandMemoryDeficitsofAlzheimer'sDisease
DING Wei-yao,ZHOU Kai,CAI Fei,et al
(HubeiProvincialKeyLaboratoryofDiabeticCardiovascularDisease,HubeiUniversityofScienceandTechnology,XianningHubei437100,China)
ObjectiveTo explore the effect and mechanism of oxymatrine on cognitive dysfunction in rats with Alzheimer's disease.Methods32 male SD rats were divided into four groups. The control group was given normal saline.The model of AD like learning and memory impairment was made by intracerebroventricular injection of streptozotocin (STZ). The STZ+OMT group was given orally with OMT after intracerebroventricular injection of STZ. The OMT group was given intragastric administration of OMT. Each group had 8 rats,and they were given 2 weeks of continuous administration. The learning and memory ability of rats was detected by Morris water maze and the changes of inflammatory reaction in hippocampus were determined by Elisa test.ResultsThe Morris Morris water maze test showed that the ability of STZ treated rats to remember the location of the original platform was poor. After OMT treatment,the time of the rats staying in the target quadrant was significantly increased(P<0.05).The levels of TNF-α and IL-6 in hippocampus of STZ group were significantly increased (P<0.01),and the contents of TNF-α and IL-6 were significantly decreased after OMT administration,(P<0.01).ConclusionOxymatrine can improve the learning and memory impairment induced by intracerebroventricular injection of STZ in rats which may be related to the inhibition of inflammatory response in brain tissue.
Oxymatrine;Streptozotocin;Alzheimer's disease;Learning and memory
大学生创新创业项目(201410927001,201510927010),湖北省自然科学基金项目(2017CFB410)
**通讯作者,E-mail:xncf@163.com
R-332
A
2095-4646(2017)05-0372-03
10.16751/j.cnki.2095-4646.2017.05.0372
2017-06-03)
