临床常见曲霉形态学鉴定
2017-11-17徐和平黄江山
徐和平,黄江山
(厦门大学附属第一医院检验科,福建厦门 361003)
临床常见曲霉形态学鉴定
徐和平,黄江山
(厦门大学附属第一医院检验科,福建厦门 361003)
曲霉感染发生率居系统性真菌感染的第二位,快速准确检测和鉴别曲霉具有重要的临床意义。目前曲霉鉴定方法包括传统的形态学鉴定、质谱、DNA序列分析等技术。对于广大的临床微生物实验室而言,曲霉的形态学鉴别还是目前主要的鉴定手段。该文介绍当前曲霉的分类进展,用图文结合的方式详细描述标本中曲霉的菌丝形态、培养条件、各属形态学特点,对临床微生物学实验室鉴定曲霉有参考和指导价值。
曲霉;分类;培养;形态学
曲霉(Aspergillus)在自然界广泛存在,种类众多(约180多种)。其中少数为机会致病菌,可引起人类的曲霉病,导致肺部(侵袭性曲霉病、肺曲霉球、超敏反应等)、外耳道、皮肤、指甲、骨骼等部位感染。少数的菌株还可产生曲霉毒素(黄曲霉毒素等),引起中毒、肿瘤发生。由曲霉导致的感染发生率在系统性真菌感染中居第二位,仅次于念珠菌,且发病隐匿,进展迅速,临床症状和影像学不够典型和特异,缺乏安全有效的抗真菌治疗手段,病死亡率高,故早期、快速、正确地鉴定出曲霉感染,对目标治疗具有重要的临床意义。目前曲霉鉴定除传统的形态学鉴定外,已经开始应用质谱、DNA序列分析等技术。但质谱、DNA序列分析目前存在仪器价格昂贵,标本的培养与制备未标准化、参考数据菌库的建立还需要完善,以及外送检验时效性差等诸多因素限制了其在广大基层医院的应用。对于广大的临床微生物实验室而言,曲霉的形态学鉴别还是目前主要的鉴定手段。本文将从曲霉的形态特点、培养条件等方面进行阐述,以期对临床微生物学实验室鉴定曲霉有参考和指导价值。
1 曲霉的分类
曲霉隶属于真菌界(Fungi)、子囊菌门(Ascomycota)、子囊菌亚门(Pezizomycotina)、散囊菌纲(Eurotiomycetes)、散囊菌目(Eurotiales)、发菌科(Trichocomaceae)、曲霉属(Aspergillus)。最近,通过多基因法的系统发育学分析,对核糖体基因转录间隔区(ITS)、β-微管蛋白(β-tubulin)、钙调节蛋白(calmodulin)、肌动蛋白(ACT)、RNA聚合酶Ⅱ(RPB2)等基因位点分型,把曲霉分为5个亚属(subgenera):曲霉亚属(Aspergillus)、烟曲亚属(Fumigati)、环绕亚属(Circumdati)、巢状亚属(Nidulantes)和华丽亚属(Ornati),这5个亚属又分为16个组(section):烟色组(Fumigati)、棒状组(Clavati)、局限组(Restricti)、曲霉组(Aspergillus)、亮白组(Candidi)、黑色组(Nigri)、环绕组(Circumdati)、黄色组(Falvi)、黄柄组(Flavipedes)、土生组(Terrei)、焦色组(Usti)、杂色组(Versicolores)、构巢组(Nidulantes)、鹿皮色组(Cervini)、稀疏组(Sparsi)、Cremei组(Cremei)[1]。过去使用的复合群(complex)的分类逐渐被更为准确的组和分支(clade)所替代。
2 标本直接镜检
组织标本、痰、气管抽吸物、肺泡灌洗液、耳道分泌物以及其他样本,可以采用革兰染色、KOH、荧光白染色、六胺银染色(GMS)、HE染色、PAS染色等方法检测曲霉菌丝,但直接镜检阳性率比较低。对于高度怀疑曲霉感染患者,可以使用10% KOH消化后离心浓缩镜检以提高阳性率。使用GMS、HE、PAS染色等病理染色技术时,注意避免标本研磨,因为活体的菌丝通常呈嗜碱性或双染色性,而死亡或损害的菌丝因细胞壁损坏常为嗜酸性[2]。曲霉在组织中主要以菌丝形态表现,菌丝通常为透明、分隔、45°锐角分枝;在病理组织标本中呈平行或放射状扩散于整个组织中,在肺曲霉球患者可见菌丝成团;在与空气直接接触的耳道、气道标本中有时可见曲霉头。见图1。
3 曲霉培养
大部分曲霉生长要求不高,在血平板、巧克力平板、中国蓝平板、沙氏培养基(SDA)、马铃薯葡萄糖培养基(PDA)均可以生长,而大部分曲霉科玛嘉显色培养生长十分局限。不同培养基上曲霉生长成熟的速度相差较大,以SDA和PDA生长成熟最快。因此临床上为准确快速分离鉴定出曲霉,建议镜检阳性标本常规接种SDA和PDA,而不应使用科玛嘉显色培养基作为丝状真菌初代培养基。曲霉在25~37 ℃ 均可生长,但同样存在生长速度的快慢不一,因此建议同时放置25 ℃ 和35 ℃ 两个温度培养,见图2、图3。湿度对曲霉的生长影响较小,但为防止培养基长期培养干枯开裂而影响曲霉生长,故保持一定的湿度环境还是有必要。
部分曲霉需要提供高渗培养条件才能促进其生长和产孢(如局限曲霉),可以把SDA和PDA的含糖量(葡萄糖或蔗糖)从20 g/L提高到200 g/L,将明显加快该类曲霉的生长速度。部分曲霉耐受高温,可以相应提高生长温度(45 ℃),以达到鉴别诊断目的。
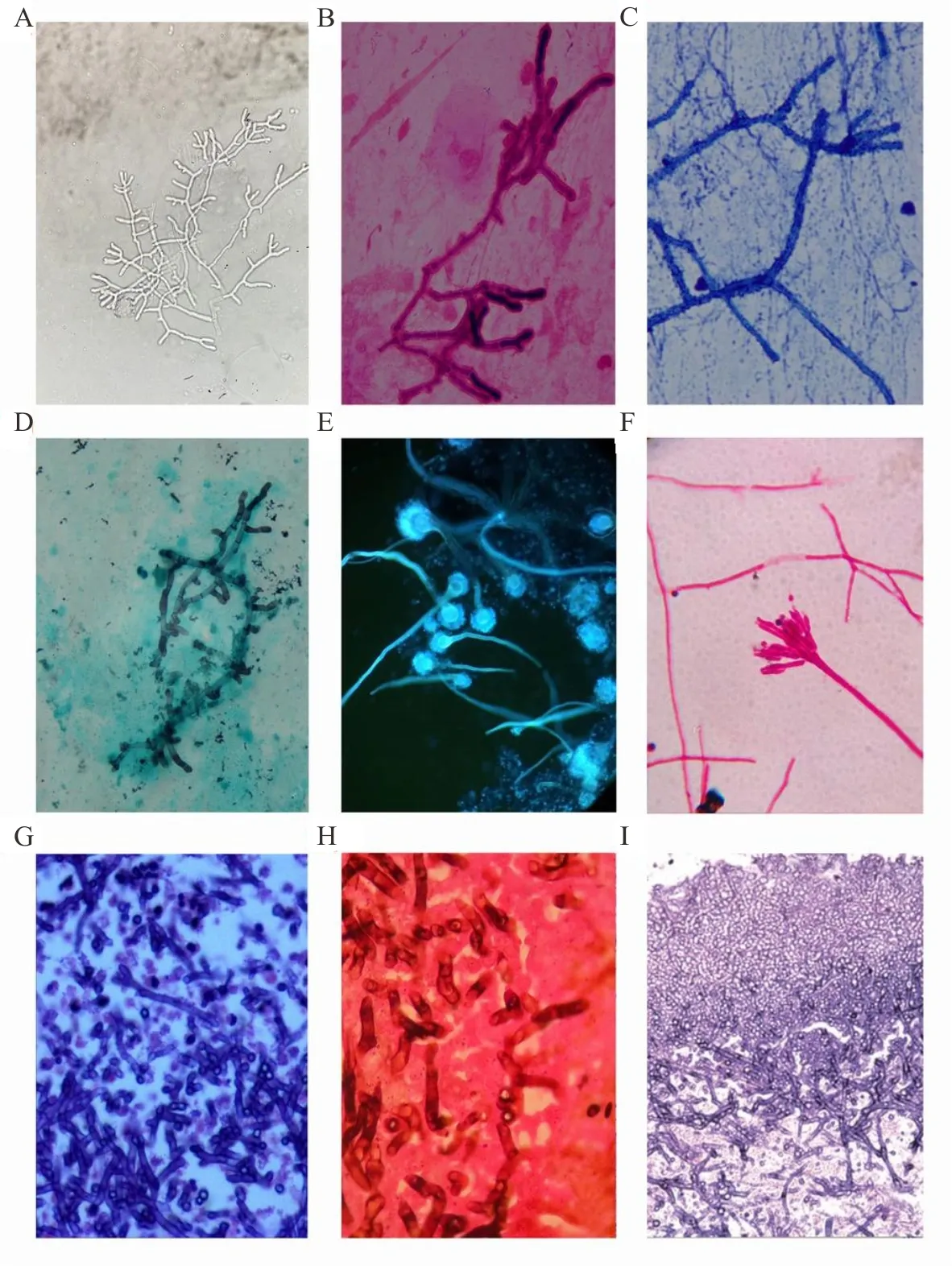
注:A,痰标本,KOH,×400;B,肺泡灌洗液,革兰染色,×1 000;C,肺泡灌洗液,抗酸染色,×1 000;D,肺泡灌洗液,六胺银染色,×1 000;E,耳道标本,荧光白染色,×400;F,耳道标本,革兰染色,×400;G,肺组织,六胺银染色,×400;H,肺组织,HE染色,×400;I,肺组织,PAS染色,×400。
图1 组织及体液标本中曲霉直接镜检
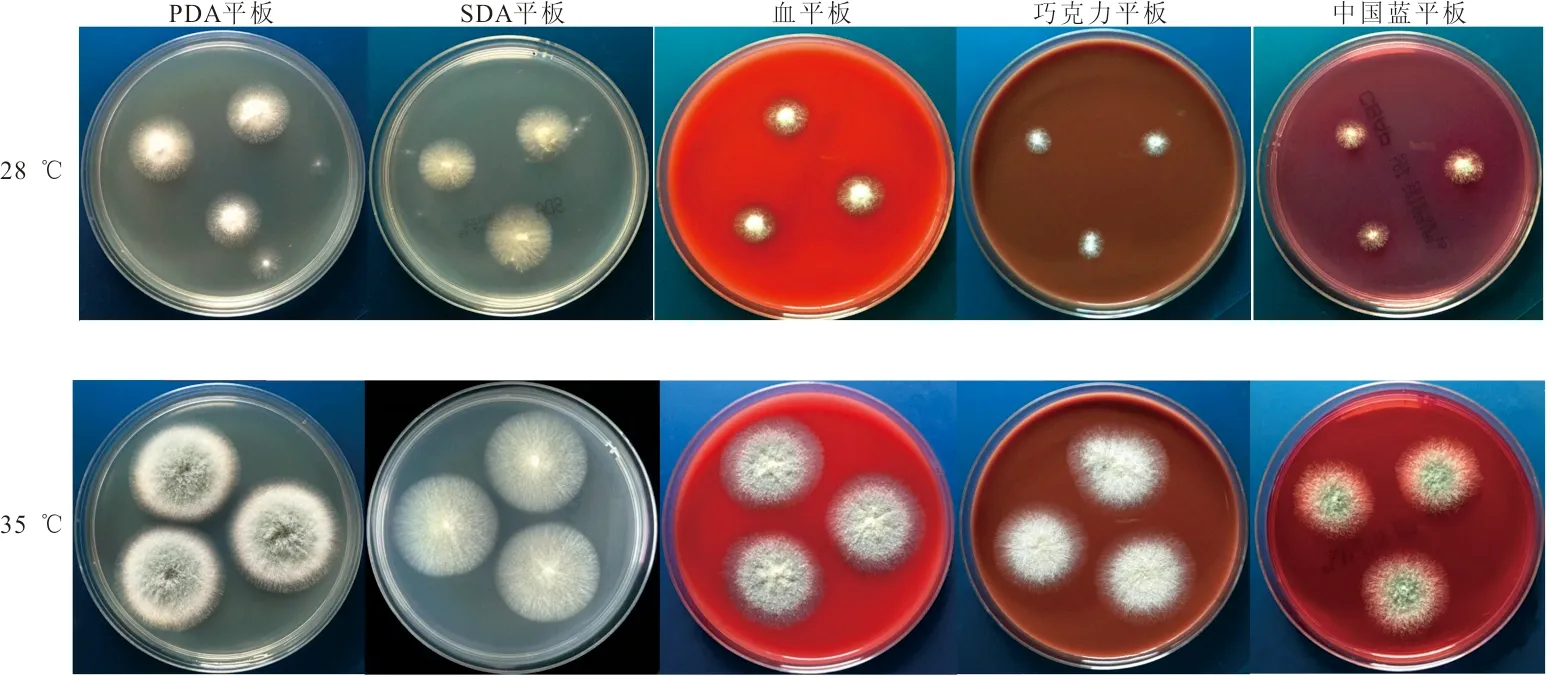
图2 烟曲霉在不同培养基和温度培养48 h生长对比
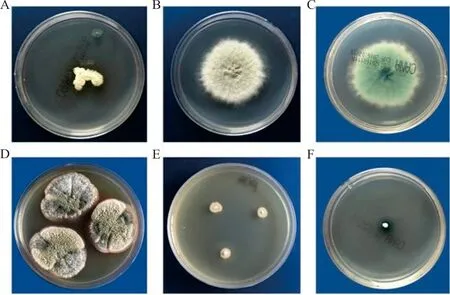
注:A,土曲霉科玛嘉显色培养基,35 ℃ 培养6 d;B,烟曲霉科玛嘉显色培养基,35 ℃ 培养6 d;C,烟曲霉科玛嘉显色培养基背面,35 ℃ 培养6 d;D,杂色曲霉,PDA,28 ℃ 培养6 d;E,杂色曲霉,PDA,35 ℃ 培养6 d;F,杂色曲霉, 科玛嘉显色培养基,35 ℃ 培养6 d。
图3 不同培养条件下曲霉生长情况
4 曲霉的形态鉴定
曲霉可以从菌落和镜下形态特征来鉴定。菌落可从生长速度、质地、沟纹、高度、边缘形态、正反面颜色、色素和渗出液等方面观察。曲霉的生长速度较快,一般72 h内成熟,但亦有部分菌株生长比较缓慢。菌落初期通常为白色,之后,因不同的菌种变成绿色、黄色、黑色或棕褐色,质地粉状,背面通常为白色或褐色。镜下形态主要从菌丝形态、足细胞、分生孢子头、分生孢子、壳细胞、菌核、闭囊壳等方面进行辨别。曲霉菌丝有隔、无色透明或呈明亮的颜色,但不呈暗色。分生孢子梗茎以大体垂直的方向从足细胞生出,不分支,梗茎光滑或粗糙。其顶端膨大形成不同形状的顶囊,从其表面形成产孢细胞。产孢细胞有单层和双层之分,单层是自顶囊表面生出一层安瓿状瓶梗(小梗),再在其上形成分生孢子;双层是自顶囊表面先生出一层上大下小的柱形细胞,成为梗基,由梗基上产生瓶梗,瓶梗上再形成分生孢子。分生孢子为单细胞,具有不同形状和各种颜色,光滑或粗糙有棘,连接成不分支的链状。由顶囊到分生孢子链构成不同形状的分生孢子头,呈现不同颜色。有的种可形成厚壁的壳细胞,形状因种而异;有的种则可以形成菌核或类菌核结构;还有的种产生有性阶段,形成闭囊壳。闭囊壳是一个体积较大、圆形、封闭的多细胞结构的子实体,表面为紧密交织菌丝包裹,其内含子囊和子囊孢子,子囊孢子大多透明或具有不同颜色、形状和纹饰[3]。菌核是由菌丝紧密连接交织而成的休眠体,内层是疏松组织,外层是拟薄壁组织,形成壁厚、色深、较坚硬菌丝体颗粒。菌核的功能主要是抵御不良环境,可耐高温,低温及干燥保存。当环境适宜时,菌核能萌发产生新的营养菌丝或从上面形成新的繁殖体。临床常见曲霉形态学特点[4-18]见表1,示意图见图4-13。

表1 常见曲霉鉴定索引表
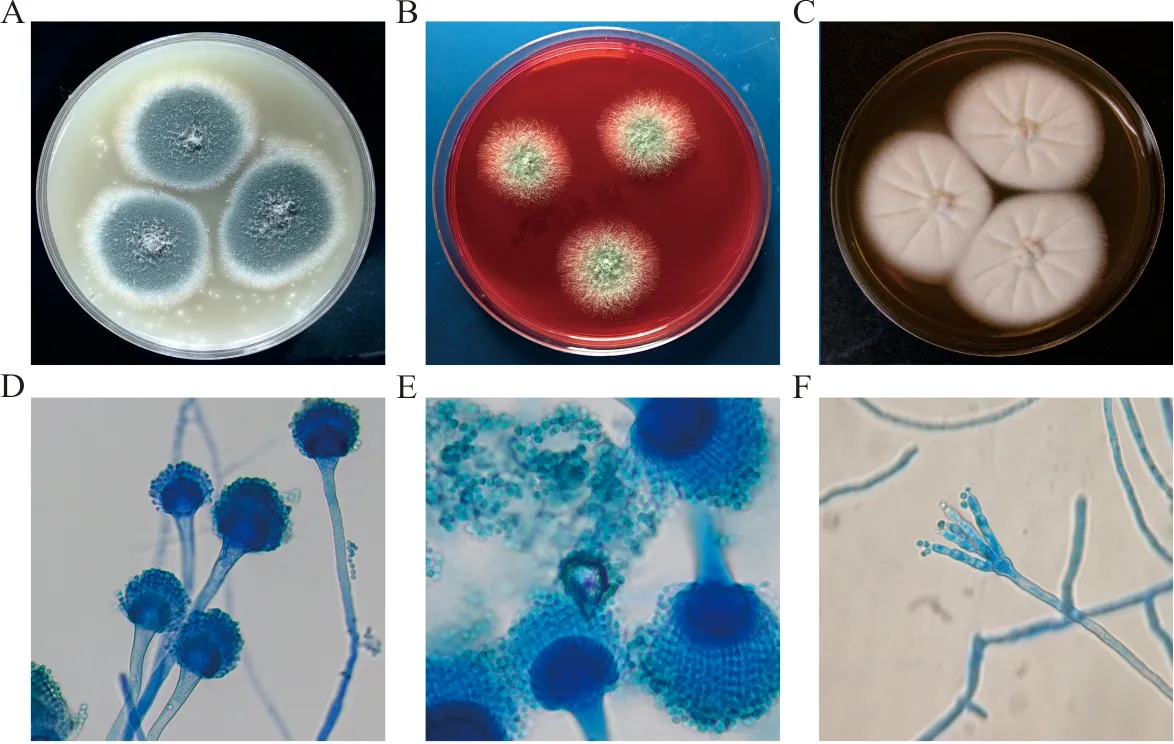
注:A,PDA,28 ℃ 2 d;B,中国蓝平板,28 ℃ 2 d;C,白色烟曲霉,PDA,28 ℃ 10 d;D、E,分生孢子头,乳酸酚棉蓝染色,×400;F,分生孢子头,乳酸酚棉蓝染色,×1 000。
图4 烟曲霉
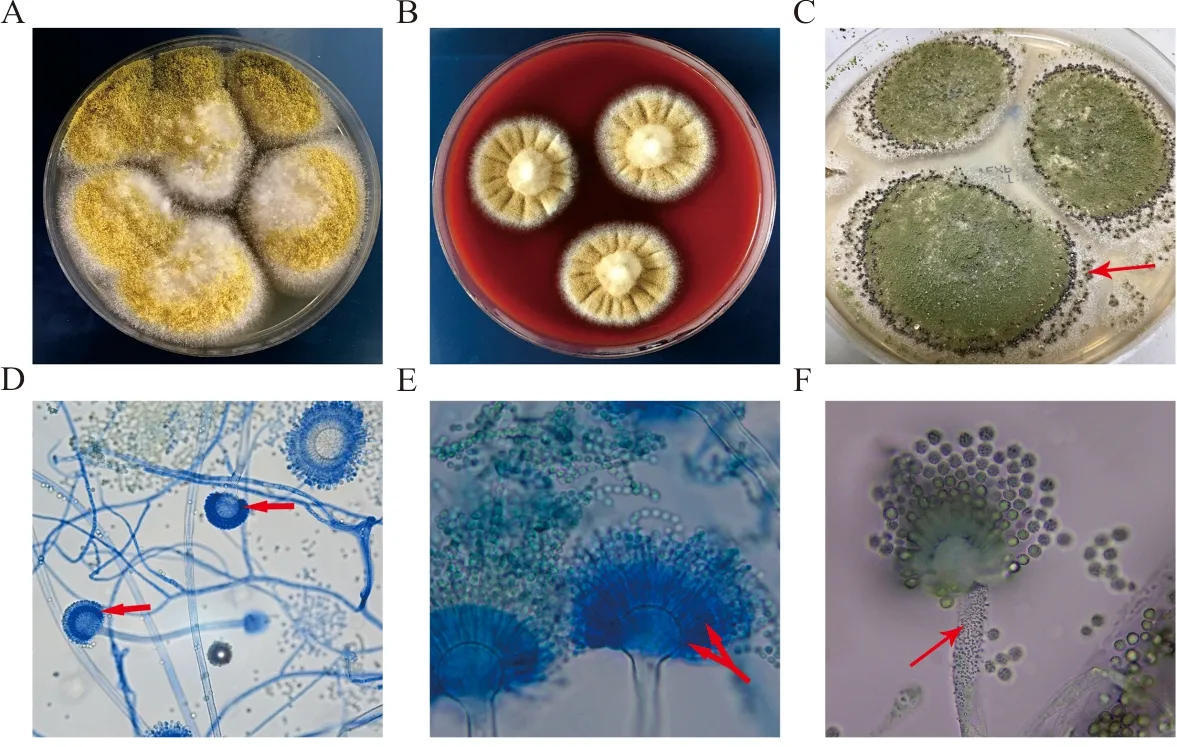
注:A,PDA, 28 ℃ 7 d; B,血平板,28 ℃ 5 d; C,菌核(箭头所示黑色颗粒),SDA,28 ℃ 21 d; D,分生孢子头,单层小梗(箭头所示),乳酸酚棉蓝染色,×100; E,分生孢子头,双层小梗(箭头所示),乳酸酚棉蓝染色,×1 000;F,分生孢子头,生理盐水镜检,×1 000,箭头所示为粗糙有刺的分生孢子梗茎。
图5 黄曲霉
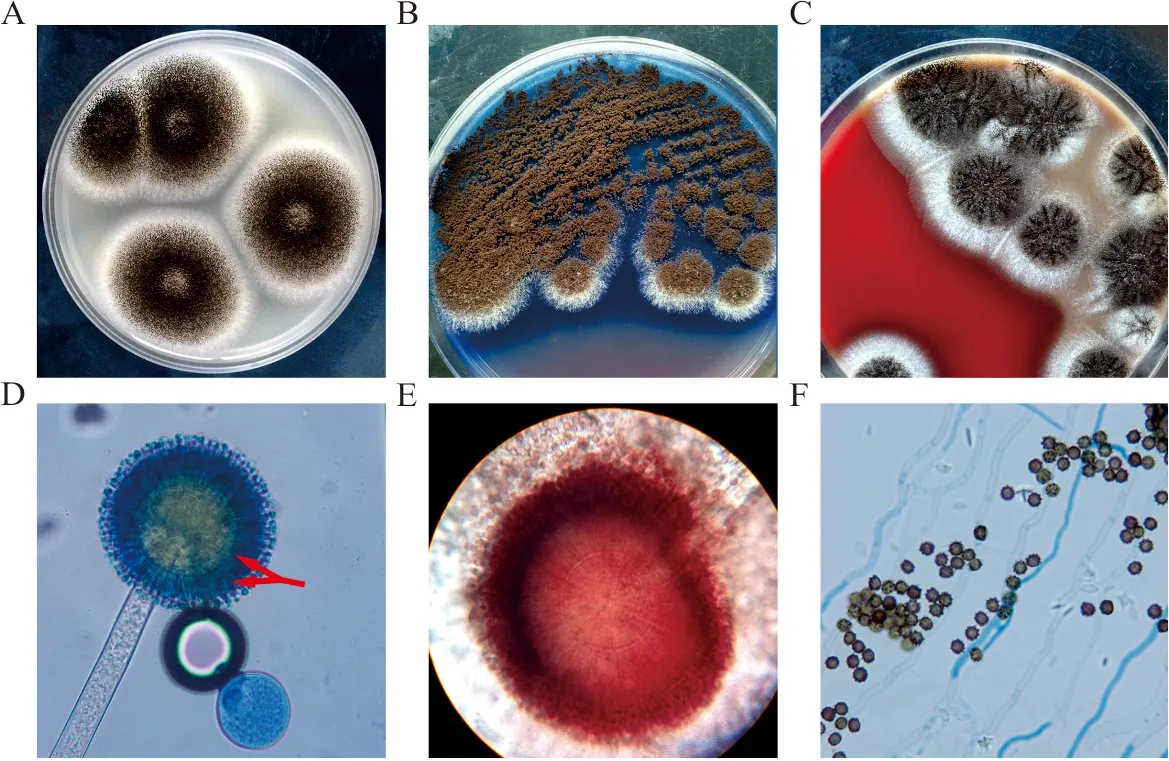
注:A,PDA,28 ℃ 4 d;B,中国蓝平板,28 ℃ 4 d;C,血平板,28 ℃ 4 d;D,分生孢子头,双层小梗(箭头所示),乳酸酚棉蓝染色,×400;E,曲霉头,生理盐水镜检,×1 000;F,分生孢子,乳酸酚棉蓝染色,×1 000。
图6 黑曲霉
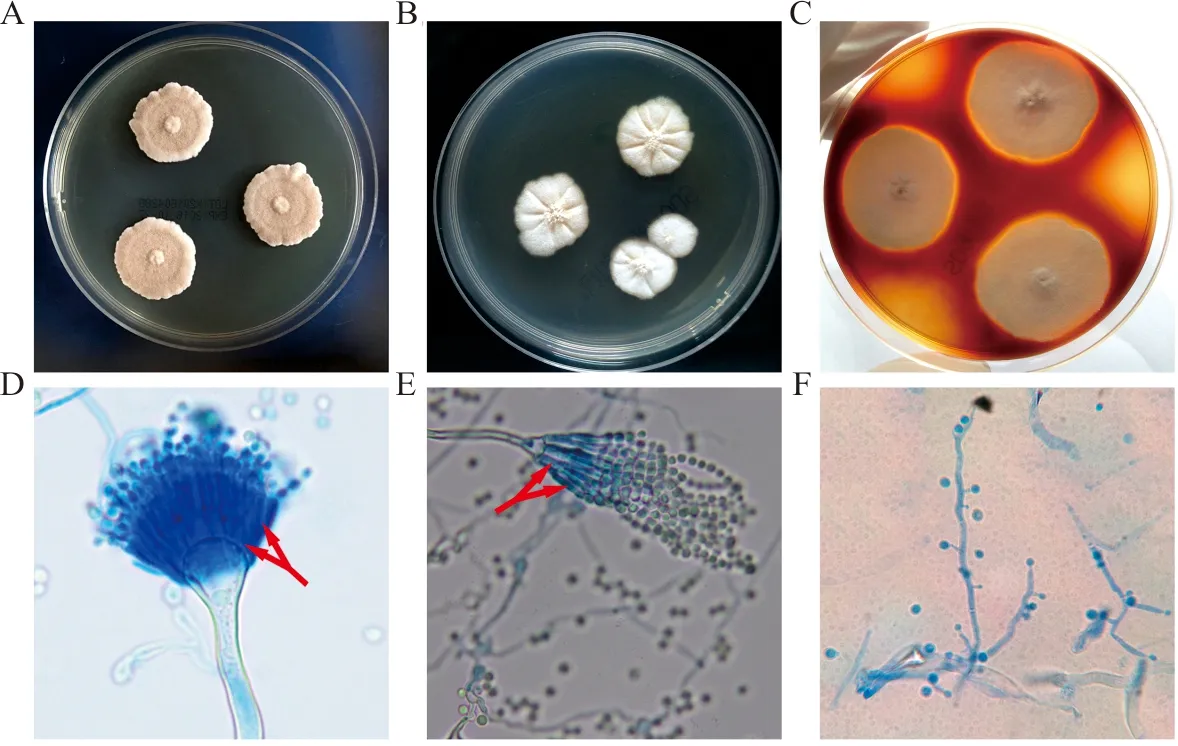
注:A,PDA,28 ℃ 7 d;B,SDA,28 ℃ 7 d;C,SDA,28 ℃ 4 d,可见可溶性红色色素;D、E,分生孢子头,双层小梗(箭头所示),乳酸酸酚棉蓝染色,×400;F,粉孢子,乳酸酚棉蓝染色,×1 000。
图7 土曲霉
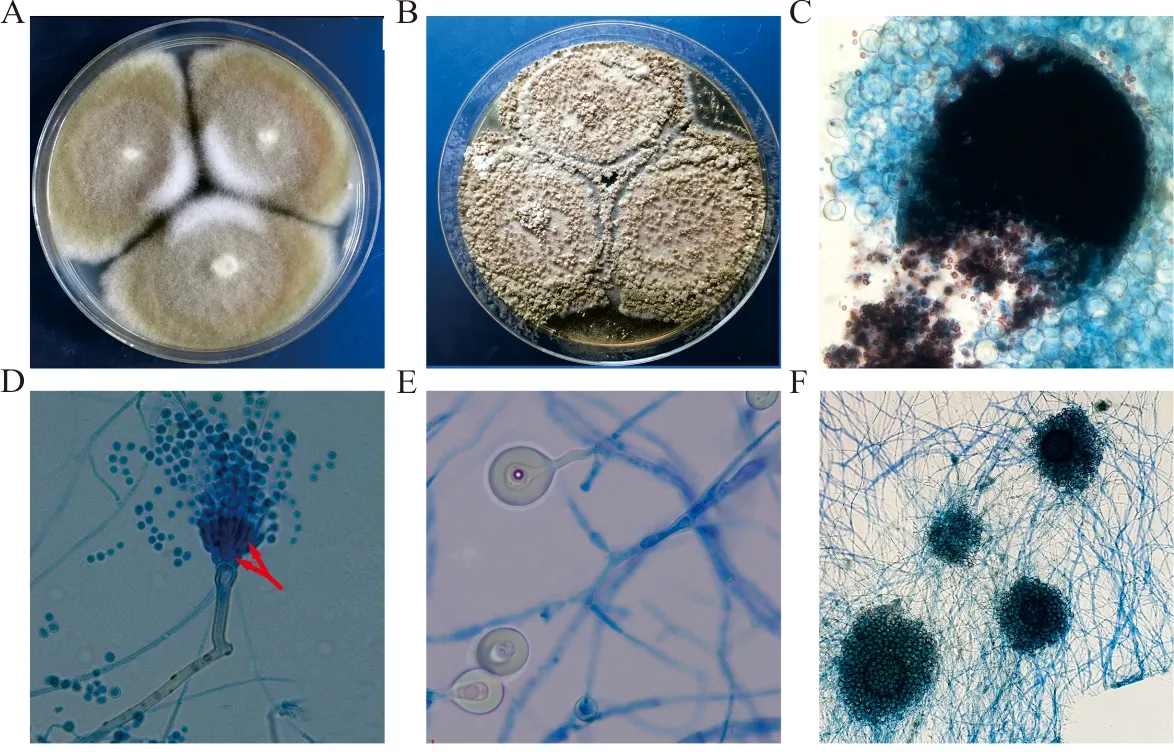
注:A,PDA,28 ℃ 7 d; B,菌核,PDA,28 ℃ 21 d;C,闭囊壳,乳酸酚棉蓝染色,×1 000;D,分生孢子头,双层小梗(箭头所示),乳酸酚棉蓝染色,×400;E,壳细胞,乳酸酚棉蓝染色,×1 000;F,分生孢子头,乳酸酚棉蓝染色,×400。
图8 构巢曲霉
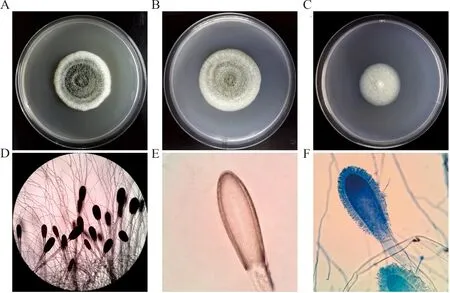
注:A, PDA,28 ℃ 7 d; B, SDA,28 ℃ 7 d; C, 察氏培养基,28 ℃ 7 d; D, PDA,28 ℃ 7 d, 镜下形态,未染色,×100;E,分生孢子头,未染色, ×1 000;F,分生孢子头,乳酸酚棉蓝染色,×1 000。
图9 棒曲霉
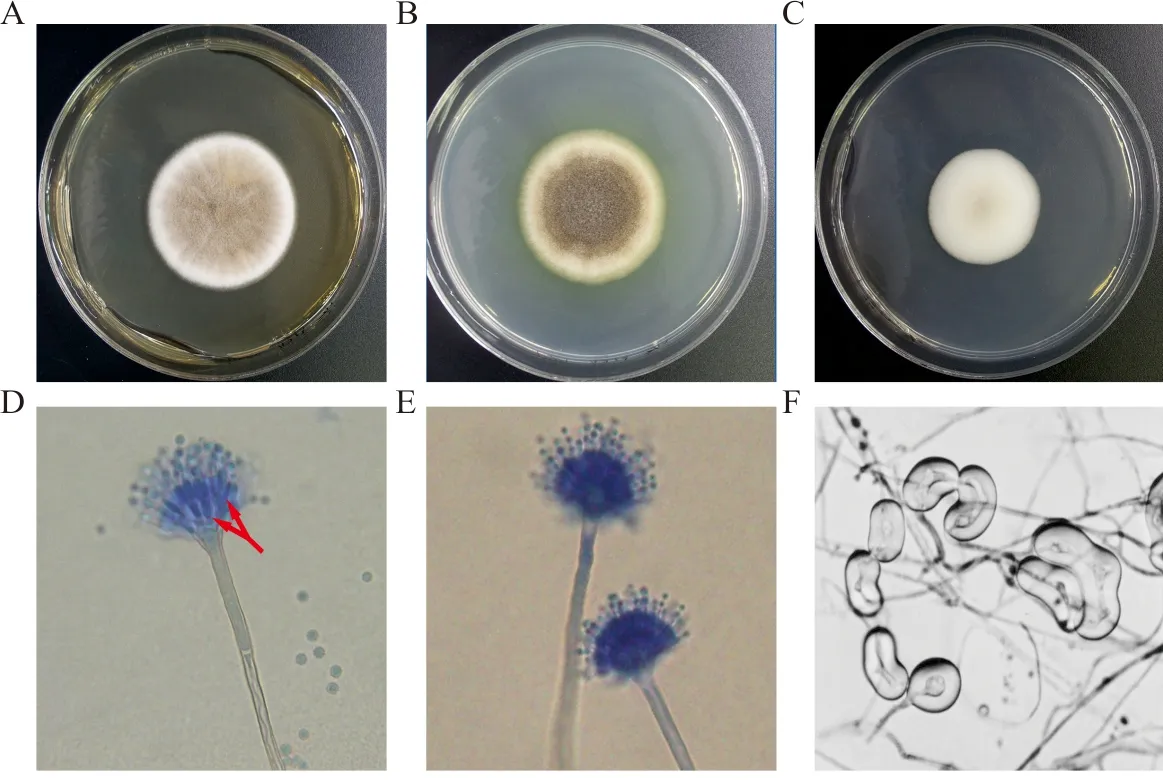
注:A, SDA, 28 ℃ 7 d; B, PDA,28 ℃ 7 d; C, 察氏培养基,28 ℃ 7 d; D, 分生孢子头,双层小梗(箭头所示),乳酸酚棉蓝染色,×400; E, 分生孢子头,乳酸酚棉蓝染色,×400;F, 壳细胞,未染色,×1 000。
图10 焦曲霉
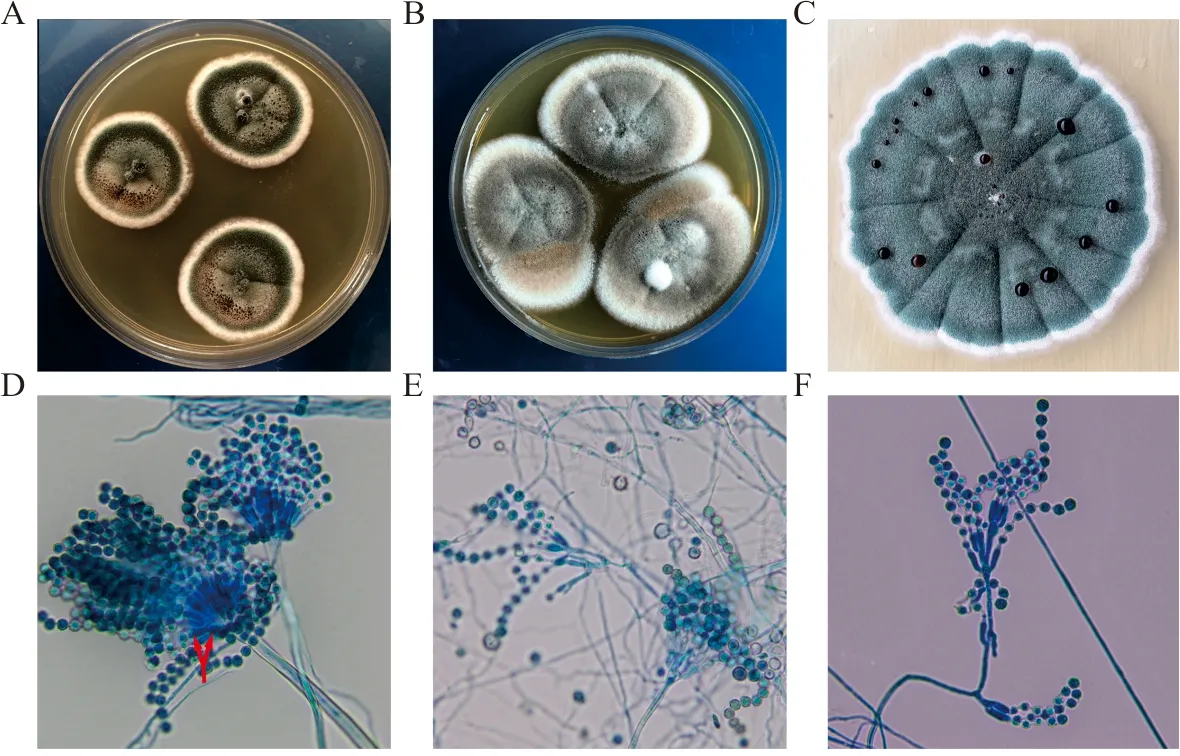
注:A, PDA, 28 ℃ 10 d; B, SDA, 28 ℃ 10 d; C, PDA, 28 ℃ 14 d; D,分生孢子头, 双层小梗(箭头所示), 乳酸酚棉蓝染色,×1 000; E、F, 分生孢子头,青霉样不完整顶囊,乳酸酚棉蓝染色,×400。
图11 聚多曲霉
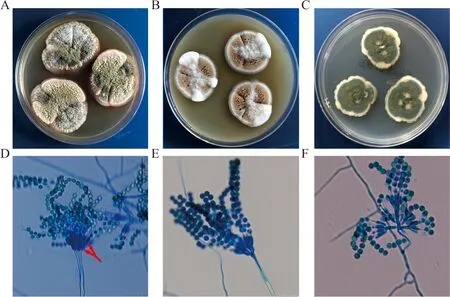
注:A、B, PDA, 28 ℃ 10 d; C, SDA, 28 ℃ 10 d; D, 分生孢子头,双层小梗(箭头所示),乳酸酚棉蓝染色,×1 000; E、F,分生孢子头,青霉样不完整顶囊,乳酸酚棉蓝染色,×1 000。
图12 杂色曲霉
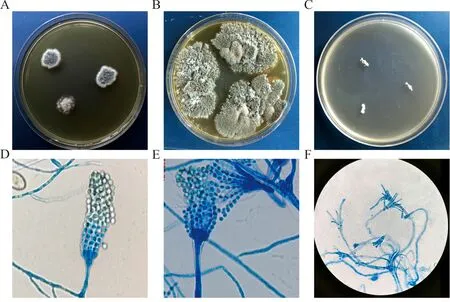
注:A, 200 g/L葡萄糖的PDA,28 ℃ 7 d; B, 200 g/L葡萄糖的SDA,28 ℃ 14 d; C, 20 g/L葡萄糖的SDA,28 ℃ 7 d; D、E, 200 g/L葡萄糖的PDA, 分生孢子头,乳酸酚棉蓝染色,×400;F, 20 g/L葡萄糖的PDA,28 ℃ 7 d,分生孢子头,乳酸酚棉蓝染色,×400。
图13 局限曲霉
5 形态学鉴定应注意的问题
曲霉培养最好使用察氏培养基和PDA培养使其呈现其标准菌落形态,而在沙氏培养基、血平板、巧克力平板等分离培养基上,曲霉生长速度、菌落颜色、产孢速度等方面有比较大偏差,会误导鉴定方向。菌落大小、正反面颜色、纹理、色素、是否分泌液滴对曲霉鉴定有指导意义。但多次传代培养会引起菌落变异,菌落颜色消失逐渐变成白色,液滴和色素消失,影响菌种辨别。镜下主要从分生孢子头形态来辨别,但部分菌株由于药物和宿主因素可导致变异而产孢缺乏,可以通过更换培养基(察氏培养基)、改变光照(如紫外照射),提高培养温度(45 ℃或48 ℃ )、切开培养基阻断营养供给等方式促进产孢,若仍然不产孢,需通过分子生物学方法鉴定[19]。未来可能还将运用曲霉的蛋白质组、代谢组、气味等来鉴定。
临床分离培养出曲霉后,一定要与患者临床症状、影像学、曲霉相关的血清学检查(GM试验、曲霉抗原等)相结合,尤其是来源于开放部位分离的曲霉,应排除污染或定植。
致谢:本文部分图片得到陈东科、陈会、占萍、钱雪琴、冯长海、王冲等同仁帮助,谨表谢意!
[1]Peterson SW. Phylogenetic analysis ofAspergillusspecies using DNA sequences from four loci[J]. Mycologia, 2008, 100(2): 205-226.
[2]Jorgensen JH, Pfaller MA, Carroll KC,etal. Manual of clinical microbiology(11th edition)[M]. Washington, DC: ASM press, 2015: 2037-2039.
[3]Larone DH. Medically important fungi a guide to identification(5th edition)[M]. Washington, DC:ASM press, 2011: 281-293.
[4]Samson RA, Hong S, Peterson SW,etal. Polyphasic taxonomy ofAspergillussectionFumigatiand its teleomorphNeosartorya[J]. Stud Mycol, 2007, 59: 147-203.
[5]Sugui JA, Kwon-Chung KJ, Juvvadi PR,etal.Aspergillusfumigatusand related species[J]. Cold Spring Harb Perspect Med, 2015, 5: a019786.
[6]Balajee SA, Gribskov JL, Hanley E,etal.Aspergilluslentulussp. nov., a new sibling species ofA.fumigatus[J]. Eukaryot Cell, 2005, 4(3): 625-632.
[7]Godet M, Munaut F. Molecular strategy for identification inAspergillussectionFlavi[J]. FEMS Microbiol Lett, 2010, 304(2):157-168.
[8]Varga J, Frisvad JC, Kocsubé S,etal. New and revisited species inAspergillussectionNigri[J]. Stud Mycol, 2011, 69(1): 1-17.
[9]Samson RA, Peterson SW, Frisvad JC,etal. New species inAspergillussectionTerrei[J]. Stud Mycol, 2011, 69(1): 39-55.
[10]Chen AJ, Frisvad JC, Sun BD,etal.AspergillussectionNidulantes(formerlyEmericella): Polyphasic taxonomy, chemistry and biology[J]. Stud Mycol, 2016, 84: 1-118.
[11]Varga J, Rigó K, Molnár J,etal. Mycotoxin production and evolutionary relationships among species ofAspergillussectionClavati[J]. Antonie Van Leeuwenhoek, 2003, 83(2):191-200.
[12]Houbraken J, Due M, Varga J,etal. Polyphasic taxonomy ofAspergillussectionUsti[J]. Stud Mycol, 2007, 59: 107-128.
[13]Samson RA, Varga J, Meijer M,etal. New taxa inAspergillussectionUsti[J]. Stud Mycol, 2011, 69(1): 81-97.
[14]Jurjevic Z, Peterson SW, Horn BW.AspergillussectionVersicolores: nine new species and multilocus DNA sequence based phylogeny[J]. IMA Fungus, 2012, 3(1): 59-79.
[15]Mills JT, Abramson D. Production of sterigmatocystin by isolates ofAspergillusversicolorfrom western Canadian stored barley and rapeseed/canola[J]. Can J Plant Pathol, 1986, 8(2): 151-153.
[16]Veršilovskis A, Saeger SD. Sterigmatocystin: occurrence in foodstuffs and analytical methods - an overview[J]. Mol Nutr Food Res, 2010, 54(1): 136-147.
[17]Mencl K, Otcenásek M, Spacek J,etal.AspergillusrestrictusandCandidaparapsilosis--agents of endocarditis following heart valve replacement[J]. Mykosen, 1985, 28(3): 127-133.
[18]齐祖同. 中国真菌志(第五卷).曲霉属及其相关有性型[M]. 北京:科学出版社, 1997.
[19]CLSI. Interpretive criteria for identification of bacteria and fungi by DNA target sequencing:Approved guideline. CLSI document MM18-A[S]. Wayne, PA: CLSI, 2015.
2017-08-01)
(本文编辑:刘群)
10.13602/j.cnki.jcls.2017.10.09
徐和平,1972年生,男,副主任技师,从事微生物检验工作。
黄江山,主任技师,E-mail:13600918159@163.com。
R446.5
A
