以痰涂片形态学为核心的肺曲霉病诊断六步法的介绍
2017-11-17卢先雷
卢先雷
(成都市第五人民医院临床微生物室,成都 611130)
以痰涂片形态学为核心的肺曲霉病诊断六步法的介绍
卢先雷
(成都市第五人民医院临床微生物室,成都 611130)
介绍根据工作实践建立的肺曲霉病诊断六步法:以痰涂片镜检为核心,包括不染色标本查看脓细胞、1.78 mol/L KOH透明后集菌镜检查菌丝、革兰染色观察菌丝的包裹现象以及中性粒细胞的退行性变化,另外综合应用培养、GM试验、CT、PCR等多种手段进行肺曲霉病的诊断。肺曲霉病诊断六步法是以痰涂片形态学为核心的综合应用多种诊断手段相结合的诊断体系,可提升该类疾病的检出率,一定程度上减少漏诊。
肺曲霉病;显微镜检验;形态学
欧美文献显示,肺曲霉感染在所有深部真菌中发生率始终位居榜首[1]。而曲霉病的早期表现不典型,CT、痰培养、G试验与GM试验等各种诊断手段特异性和敏感性均不尽人意,而当各种症状表现典型后,疾病已经进入后期,此时治疗收效甚微,导致肺曲霉感染死亡率较高[2]。美国感染病协会(Infectious Diseases Society of America,IDSA)根据临床表现和疾病的进展特点将曲霉病综合分为侵袭性肺曲霉病(invasive pulmonary aspergillosis, IPA)、变应性支气管肺曲霉病(allergic bronchopulmonary aspergillosis,ABPA)以及慢性肺曲霉病(chronic pulmonary aspergillosis, CPA),这3类不同的疾病类型有着不同的临床转归,显微镜检查也有不同表现特征[3]。笔者根据不同类型曲霉病的显微镜下特征规律,总结出肺曲霉病诊断六步法,以供参考。
1 肺曲霉病诊断的六步法
肺曲霉病诊断的六步法是在临床实践中反复修订总结出来的一套严格的诊断思路,具体方法由以下六步构成。
1.1不染色标本查看脓细胞筛查标本合格性 曲霉感染具有较强的致炎作用,大量中性粒细胞渗出是其典型的表现之一[4],观察这一指标能快速区分气道定植与感染[5]。
1.21.78 mol/L KOH透明后集菌镜检查菌丝 部分血管侵袭性肺曲霉病与包膜较厚的局灶性肺曲霉球几乎不侵袭支气管,排菌少;经过抗真菌治疗后复查痰涂片时,可能因为痰液中菌量太少或者菌丝不着色而被漏诊;革兰染色时,由于大量细胞背景的掩盖,容易导致漏诊。1.78 mol/L KOH溶液可以快速破坏细胞,但短时间内对真菌细胞无作用,可使少量的菌丝、孢子暴露在视野下,离心取沉淀物通过低倍镜快速搜索,再换高倍镜确认,可快速确认曲霉的存在。在高倍镜下,曲霉菌丝为典型的锐角分支,盲端膨大的鹿角样菌丝,菌丝分隔,粗且不均匀[6]。见图1。

注:高倍镜下可见典型的锐角分支,盲端膨大的鹿角样菌丝,菌丝分隔,粗且不均匀。
图1 痰标本KOH透明后美蓝染色镜检(×400)
1.3革兰染色观察菌丝的包裹现象 IPA患者的痰涂片革兰染色后观察,可见曲霉菌丝大多被大量的中性粒细胞所包裹,细胞紧紧地粘附在菌丝上,形成典型的结节状结构,菌丝着色或者不着色。此结构在低倍镜下即可被发现,再到高倍镜和油镜下进行确认。见图2。ABPA患者的痰液尽管也呈现脓性,但这种包裹现象没有IPA明显[7],见图3。
1.4革兰染色查看中性粒细胞的退行性变化 曲霉产生的胶霉毒素(gliotoxin,GT)直接导致中性粒细胞的凋亡,而真菌毒素半乳糖胺-多聚半乳糖(galactosamino-galactan,GG)则通过一些间接的途径诱导NK细胞以及中性粒细胞的凋亡,这些作用的外在形态学表现就是核固缩与核碎裂[8-10]。该现象出现在曲霉菌丝量少或者缺乏的痰涂片中,提示该病例极大可能是为IPA。见图4、图5。而ABPA的核固缩往往缺乏或者直接核溶解。而在CPA中,核固缩的出现极罕见。

注:A,×400,镜下可见典型的包裹现象,菌丝着色浅,被大量中性粒细胞所粘附和包裹;B,×1 000,镜下可见典型的包裹现象,菌丝透明未着色;C,两幅均为典型的包裹,左图菌丝相互缠绕,但未着色,右图部分着色,菌丝锐角分支,分隔,末端膨大,状如鹿角。
图2 侵袭性肺曲霉感染患者痰标本直接涂片革兰染色观察菌丝的包裹现象

注:大量菌丝,包裹现象不明显,中性粒细胞均匀分布,细胞核发生核溶解。
图3 变应性支气管肺曲霉病痰涂片革兰染色镜检(×1 000)

注:A、B,菌丝缺乏;C、D,核固缩与曲霉菌丝同时存在。黑色箭头所指为中性粒细胞核固缩。
图4 侵袭性肺曲霉感染患者痰标本直接涂片革兰染色镜下中性粒细胞核固缩现象(×1 000)
1.5真菌培养及鉴定 根据曲霉在PDA平板上的颜色不同,将曲霉分为烟色、黄色、杂色、黑色、土色等组,有助于区分气道定植、气道变应性和侵袭性,以及判断入血的可能性[11]。通过笔者的病例调查,发现导致IPA的主要是PDA上烟色组曲霉,而其他种罕见;而PDA上黄色组曲霉似乎只与ABPA有一些关系,痰培养阳性也大多属于气道定植,这与文献[12]的研究结论一致;PDA上土色组曲霉则更多导致肺外感染,例如曲霉性鼻窦炎,颅内感染和血流感染;PDA上黑色组曲霉和黄色组曲霉与曲霉性外耳道炎关系较密切,在肺部感染中极其罕见。
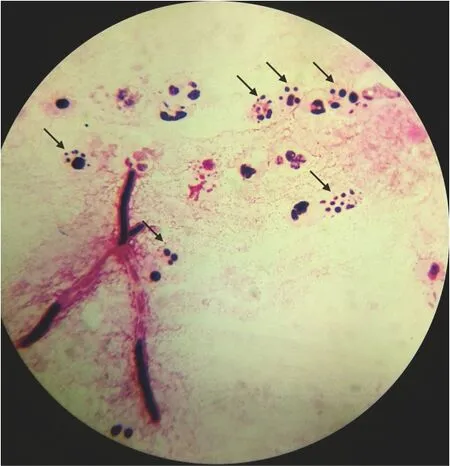
图5 侵袭性肺曲霉感染患者痰标本直接涂片革兰染色镜下中性粒细胞核碎裂现象(箭头所指)(×1 000)
PDA菌落形态只是初步分组的依据之一,还需要结合菌落的乳酸棉酚蓝染色结果,根据分生孢子梗、分生孢子、顶囊、小梗(以及瓶梗)以及子囊的有无和形态作进一步鉴定。然而,即便有形态学鉴定手段,依然很难将曲霉鉴定至种,种级水平的鉴定往往依赖分子手段,例如内转录间隔区间(ITS)、钙调蛋白基因、18S rRNA序列分析等。
1.6综合运用涂片、培养、GM试验、灌洗液PCR、CT诊断和肺活检进行疾病诊断 由于肺曲霉病的早期诊断的困难,单靠一种手段难以做到快速和准确,多手段综合应用,相互补充将是今后曲霉感染诊断的共同方向。(1)痰涂片快速、直观,可准确反映感染与气道定植,并可以根据涂片进行初步的分型,见表1。但阳性率依然不如灌洗液PCR和肺活检。(2)培养可以准确鉴定曲霉菌,但对于临床意义的判断,痰涂片的价值也不容小窥。(3)血清GM试验对于IPA的准确度很高,与肺穿组织活检有较高的符合率,然而因其阳性预测值过低,限制了该试验在临床的应用。近些年来有学者推荐采用肺泡灌洗液做GM试验可大大提升该试验的阳性率[13]。由于cut off值的设定依然没有统一,不同厂家试剂和不同文献方法学的差异,该试验到目前为止还处于评价总结阶段。(4)灌洗液PCR扩增曲霉基因,在诊断肺曲霉病的所有方法学中阳性率最高,但该方法只报告肺部(包括气道内)有曲霉的存在,但究竟是气道定植、支气管变应性还是侵袭性无法鉴别。(5)CT诊断是反映肺部病变特征和程度的优秀诊断手段,但因同病异像以及异病同像的存在导致该方法在曲霉诊断中依然属于模糊性手段,还需要大量其他指标作为补充性鉴别诊断。(6)肺活检属于肺曲霉病诊断中的确诊手段。然而肺活检因其侵入性采样的高风险,对医生采用该方法的适用性评价能力和操作娴熟程度要求非常高,目前还无法全国性推广。在曲霉诊断中,该方法所占比例非常低。肺曲霉病不同临床分型临床常用的各种诊断手段的比较见表2。

表1 不同分型曲霉菌病的痰涂片表现
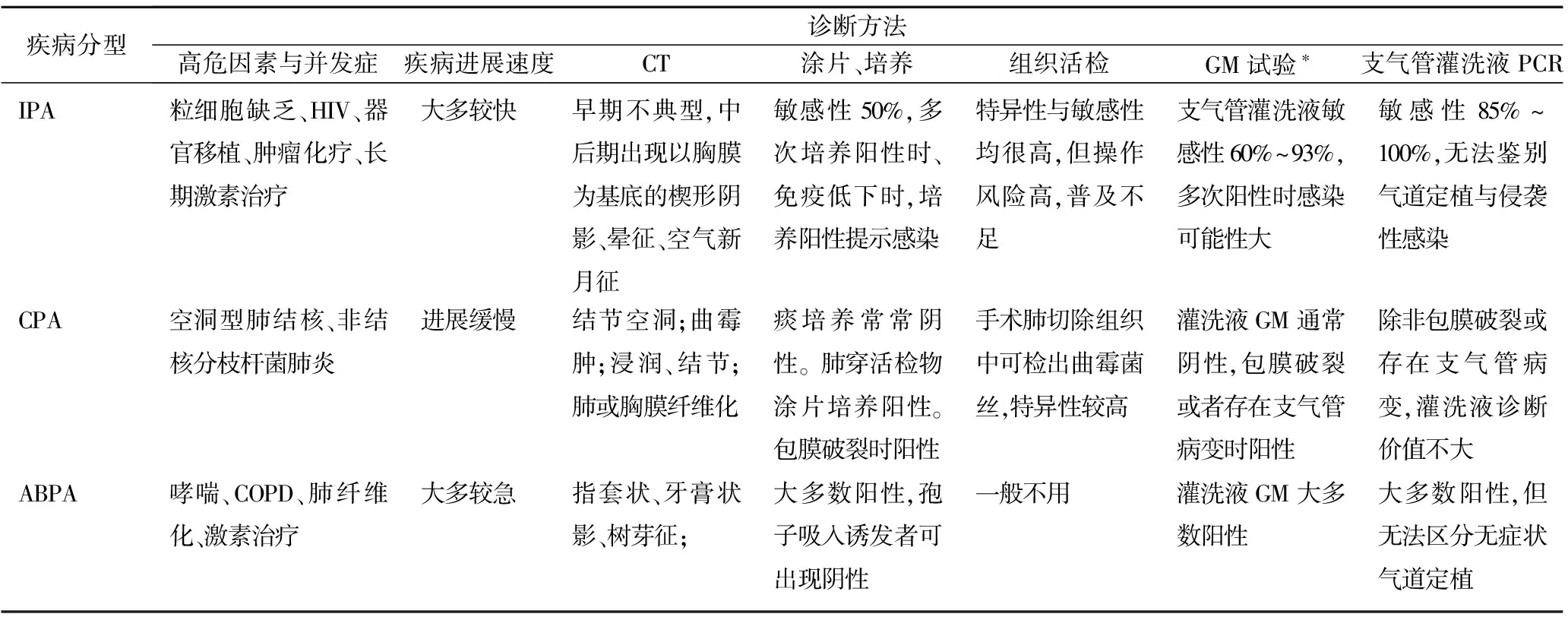
表2 各类型肺曲霉菌病诊断要点与方法学评价[2]
注:*,血清GM试验敏感性低,不提倡采用。
此外,ABPA的确诊方法还包括总IgE升高,曲霉特异IgE>1 000 IU/mL;痰标本直接涂片瑞氏染色发现嗜酸性粒细胞数量与比例的增加,见图6;以及临床症状胸闷喘憋、反复脓痰,抗生素治疗无效,抗真菌治疗可缓解症状;真菌培养与PCR检测持续阳性与CT缺乏典型肺组织侵袭表现或者仅表现为气道内痰栓形成也是诊断ABPA的关键要点[2]。

注:镜下可见大量嗜酸性粒细胞。
图6 变应性支气管肺曲霉病患者痰标本直接涂片瑞氏染色(×1 000)
2 总结
肺曲霉病诊断六步法是以痰涂片形态学为核心的综合应用多种诊断手段的诊断体系,可以对肺曲霉病做出快速而准确的诊断,为临床最终确认和治疗肺曲霉菌病提供有力的支持。需要注意的是,由于肺曲霉病在不同基础疾病人群中,以及同一疾病不同阶段中表现的不典型性和多变性,任何单一的手段在肺曲霉菌的诊断中都是局限的,综合应用多种手段,相互补充,才是提高肺曲霉病诊断阳性率和准确性的关键。
[1]De Pauw B, Walsh TJ, Donnelly JP,etal. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group[J]. Clin Infect Dis, 2008, 46(12):1813-1821.
[2]Kosmidis C, Denning DW. The clinical spectrum of pulmonary aspergillosis[J]. Thorax, 2015, 70(3):270-277.
[3]Walsh TJ, Anaissie EJ, Denning DW,etal. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America[J]. Clin Infect Dis,2008, 46(3):327-360.
[4]刘金辉, 杨芬, 罗闳丹,等. NF-κB启动的炎症反应在小鼠侵袭性肺曲霉病肺损伤中的作用[J]. 微生物学通报, 2008, 35(11):1769-1773.
[5]李培, 苏欣, 施毅. 气道侵袭性曲霉病[J]. 中华结核和呼吸杂志, 2011, 34(9):694-696.
[6]陈东科, 孙长贵. 实用临床微生物检验与图谱[M].北京:人民卫生出版社, 2011.
[7]陈东科, 孙长贵. 临床微生物学检验图谱[M]. 北京:人民卫生出版社,2016:505-512.
[8]Coméra C, André K, Laffitte J,etal. Gliotoxin fromAspergillusfumigatusaffects phagocytosis and the organization of the actin cytoskeleton by distinct signalling pathways in human neutrophils[J]. Microbes Infect, 2007,9(1):47-54.
[9]Bellocchio S, Moretti S, Perruccio K,etal. TLRs govern neutrophil activity in aspergillosis[J]. J Immunol,2004,173(12): 7406-7415.
[10]Robinet P, Baychelier F, Fontaine T,et.al. A polysaccharide virulence factor of a human fungal pathogen induces neutrophil apoptosis via NK cells[J]. J Immunol,2014,192(11):5332-5342.
[11]Versalovic J, Carroll K, Funke G,etal. Manual of Clinical Microbiology[M].10th ed. Washington, DC: ASM Press,2011.
[12]Zarrinfar H, Saber S, Kordbacheh P,etal. Mycological microscopic and culture examination of 400 bronchoalveolar lavage (BAL) samples[J]. Iranian Journal of Public Health, 2012, 41(7):70-76.
[13]Izumikawa K, Yamamoto Y, Mihara T,etal. Bronchoalveolar lavage galactomannan for the diagnosis of chronic pulmonary aspergillosis[J]. Med Mycol, 2012, 50(8):811-817.
2017-04-25)
(本文编辑:刘群)
10.13602/j.cnki.jcls.2017.10.06
卢先雷,1974年生,男,主管技师,大专,从事临床微生物检验、抗菌药物合理应用以及微生物检验试剂研发工作。
R446.5
A
