多重PCR法同时检测黄酒酒曲中多种生物胺产生菌
2017-11-17朱晓娟徐瑞涛王道安金佳玉
朱晓娟,赵 磊,徐瑞涛,王道安,陈 烁,金佳玉,张 健*
(天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室,天津 300457)
多重PCR法同时检测黄酒酒曲中多种生物胺产生菌
朱晓娟,赵 磊,徐瑞涛,王道安,陈 烁,金佳玉,张 健*
(天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室,天津 300457)
该研究建立了检测多种生物胺产生菌的多重聚合酶链反应(PCR)方法,首先检测了已报道的针对酪胺、腐胺产生菌和革兰氏阴性组胺产生菌的多对引物的特异性,针对革兰氏阴性菌的组氨酸脱羧酶基因的引物特异性差,重新设计了该引物,在此基础上,建立了可同时检测酪胺、腐胺和组胺产生菌的多重PCR方法,并优化了多重PCR反应条件为退火温度50℃,Mg2+浓度1.0 mmol/L,引物浓度配比为Tdc-F/R 0.2 μmol/L,Hdc1/2 0.4 μmol/L和Odc3/4 0.4 μmol/L。该方法特异性强,对酪胺、腐胺和组胺产生菌的灵敏度分别为1.2 ng/μL、1.5 ng/μL和1.5 ng/μL,可用于黄酒酒曲中生物胺产生菌的快速检测。
多重聚合酶链反应;检测;黄酒酒曲;生物胺产生菌
生物胺是一类低分子质量含氮的碱性有机化合物,其产生通常需要3个条件:有分泌氨基酸脱羧酶的微生物;前体物质(氨基酸)的存在;具有适宜这些微生物生长和分泌氨基酸脱羧酶的环境条件。生物胺普遍存在于多种食品中,尤其是黄酒、葡萄酒、啤酒、奶酪和发酵香肠等发酵食品中[1]。适量的生物胺在生物体内具有重要的生理作用,但是,当人体吸收过量的生物胺时,将产生一系列应激反应,可能引起头痛、呼吸紊乱、心悸等不良症状,严重情况下,可以引起大脑出血,甚至死亡[2]。在众多的生物胺中,组胺对人体的毒害作用最大,其次是酪胺[3],腐胺、尸胺、精胺和亚精胺没有明确的危害健康的作用[4],但是它们与氮结合会产生致癌物质亚硝酸盐,它们的存在还会加强酪胺和组胺的毒性[5]。因为个体差异的影响,以及食品中其他胺类物质的干扰,使得生物胺的毒理学评估非常困难,现有的限量标准主要是针对组胺和酪胺。美国食品及药物管理局(food and drug administration,FDA)规定水产品中组胺的限量标准为50 mg/kg,酪胺的限量标准为100 mg/kg;欧盟规定在鱼类食品中,组胺的限量标准为100 mg/kg[6]。在酒类饮料中尚无生物胺的限量标准,只有可能的引起中毒的含量,如组胺2~10 mg/L,酪胺10~80 mg/L,苯丙氨酸3 mg/L[7]。虽然各个国家针对生物胺的风险评估有一定差异,但共识是应努力减少食品中生物胺含量,从而降低食品摄入风险[8]。黄酒中的生物胺含量在39.30~241 mg/L之间,其中组胺、酪胺和腐胺所占的比例最大[9]。生物胺一旦形成,很难去除[10],因此在生物胺产生之前,对其形成风险进行预警至关重要,而对生物胺产生菌的检测则是风险预警的核心问题。
检测生物胺产生菌的方法有三种:微生物学方法、化学方法和分子生物学方法。微生物学方法的基本原理是根据产生生物胺菌株的生理特征及其生长过程中的生化变化,采用特异性选择培养基来进行筛选、鉴别,此方法误差大,只适合于初筛[11];化学方法即利用各种测定生物胺的化学手段测定细菌培养液中生物胺的含量,从而对微生物菌株做出判定。目前应用最为普遍的化学方法是高效液相色谱(highperformance liquidchromatography,HPLC)法。化学方法不仅可以定性判定产生物胺的微生物菌株,而且还可以定量评价其生物胺的产生能力,从而对其安全性做出评价。但该类方法费时费力,且只有生成生物胺才能检测,达不到预警的效果[12];分子生物学方法是根据已鉴定的氨基酸脱羧酶的氨基酸序列保守区设计引物,通过聚合酶链反应(polymerase chain reaction,PCR)技术进行扩增,根据电泳分析和序列比对来判定其是否具有氨基酸脱羧酶,从而确定该菌株是否具有产生物胺的能力,此类方法操作简便、特异性强、灵敏度高,且可在生物胺未产生前检测到生物胺产生菌,可用于菌株风险评估和发酵预警[13]。引物、反应体系和条件是PCR检测方法的关键。当前PCR分子检测技术已成功应用于细菌的氨基酸脱羧酶基因检测,如酪胺产生菌,腐胺产生菌和组胺产生菌[14],然而对某些革兰氏阴性的组胺产生菌不能得到有效扩增[15],因此进行全新的引物设计精确检测革兰氏阴性组胺产生菌显得尤为重要。另外,多重PCR作为一种在常规PCR基础上改进发展起来的新型PCR扩增技术,可同时检测多种样品,具有高效、高产、低成本等优点,目前已经得到广泛应用,并成为样品快速检测技术的发展方向[16]。多重PCR的引物选择是较为关键的步骤,尽量使各引物的退火温度一致,避免同对引物或多对引物之间形成引物二聚体,避免引物之间的同源性及碱基互补性。除此之外,反应体系的组成,如缓存液的成分、脱氧核糖核苷三磷酸(deoxy-ribonucleosidetriphosphate,dNTP)的浓度和反应条件都会影响实验结果[17]。
黄酒中所含生物胺的量远远大于其他发酵酒类,这主要是酿造黄酒原料中富含较多氨基酸,为生物胺的形成提供了丰富的前体物质[8],同时在酿造过程中添加含有大量微生物的酒曲进行开放式发酵,引入了大量产生氨基酸脱羧酶的微生物[18],从而导致了生物胺的大量产生。针对上述问题,本研究设计了针对革兰氏阴性组胺产生菌的全新的引物,通过优化多重PCR的反应条件,建立了可同时检测酪胺、腐胺和革兰氏阴性组胺产生菌的多重PCR检测方法。目的是用于黄酒酿造之初的安全预警,提升相关行业的安全生产能力。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
12株生物胺产生菌株,3株不产生物胺的菌株:筛选自黄酒酒曲,为天津科技大学生化过程与技术实验室保存菌株,其编号、革兰氏染色结果和产生物胺种类详见表1。
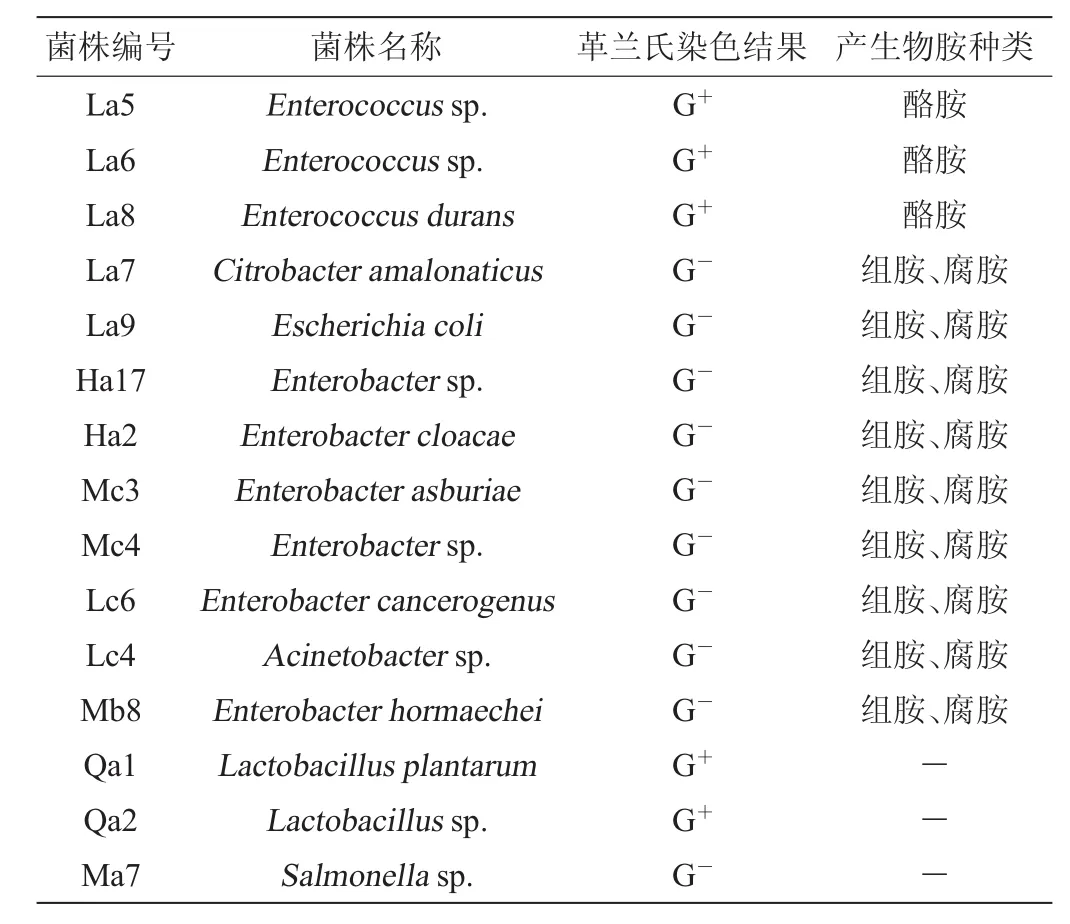
表1 实验所用菌株名称及性质Table 1 Name and nature of experimental strains
1.1.2 主要试剂
100 bp ladder Marker、DL 5kbp Marker、rTaqDNA聚合酶、dNTP、MgCl2、10×PCR buffer(Mg2+free)、10×PCR buffer(Mg2+plus)、细菌DNA提取试剂盒、DNA纯化回收试剂盒:大连宝生物有限公司。
1.1.3 培养基
胰蛋白胨大豆肉汤(tryptic soy broth,TSB)培养基:胰蛋白胨17 g/L,大豆蛋白胨3 g/L,葡萄糖2.5 g/L,氯化钠5 g/L,磷酸氢二钾2.5 g/L,调节pH为7.3~7.5,121℃高压灭菌15 min。
1.2 仪器与设备
5334 PCR扩增仪、微量移液器、5418R离心机:德国Eppendorf公司;DU640核酸蛋白分析仪:美国Backman公司;DYY-6C型电泳仪:北京六一生物科技公司;ChampGel5000凝胶成像仪:北京赛智创业科技有限公司;UV-1800PC分光光度计:上海美谱达仪器有限公司。
1.3 方法
1.3.1 模板DNA的制备及质量测定
将-80℃冻存的菌株接于TSB液体培养基上,37℃活化12h,于相应固体平板上进行划线分离,37℃培养24h后,挑取单菌落于TSB液体培养基中37℃培养10 h左右。分别测量菌体的OD600nm值(革兰氏阳性细菌的OD600nm<1.0,革兰氏阴性细菌的OD600nm>1.0时,符合基因组试剂盒的要求),按照细菌基因组DNA提取试剂盒操作说明制备模板DNA。并利用核酸蛋白分析仪测量DNA的浓度。将制备好的模板DNA进行分装,-20℃冻存。
1.3.2 引物设计
组氨酸脱羧酶可使组氨酸脱羧形成组胺,酪氨酸脱羧酶可使酪氨酸脱羧形成酪胺,而鸟氨酸脱羧酶催化鸟氨酸脱羧形成腐胺。组氨酸脱羧酶包括两种类型:源于革兰氏阳性菌的丙酮酰依赖型和源于革兰氏阴性菌的磷酸吡哆醛依赖型。酪氨酸脱羧酶和鸟氨酸脱羧酶通常不按革兰氏染色分类[19]。本研究选取已报道的针对磷酸吡哆醛依赖型组氨酸脱羧酶基因的引物Hdc-2F/Hdc-2R、KPF2/KPR4、Hdc-f/Hdc-r、106/107、HIS2-F/HIS2-R,针对酪氨酸脱羧酶基因的引物(Tdc-F/R)和针对鸟氨酸脱羧酶的引物(Odc3/4)来验证引物的特异性。根据美国国家生物技术信息中心(national center of biotechnology information,NCBI)最新收录的源于菌株Enterobactersp.的组氨酸脱羧酶序列及与之高度相似(99%)并且同属磷酸吡哆醛依赖型天冬氨酸转氨酶超家族的源于Enterobacter cloacae,Enterobacter asburiae的2,4-二氨基丁酸脱羧酶序列进行比对,利用PrimerPremier 5.0软件进行引物设计,合成新的引物组氨酸脱羧酶的引物Hdc1/Hdc2(GGYTNAARCARCCNGARATG/GCRTCNACRTGNACCCADAT)。所有引物均由北京华大基因有限公司合成,序列详细信息见表2。
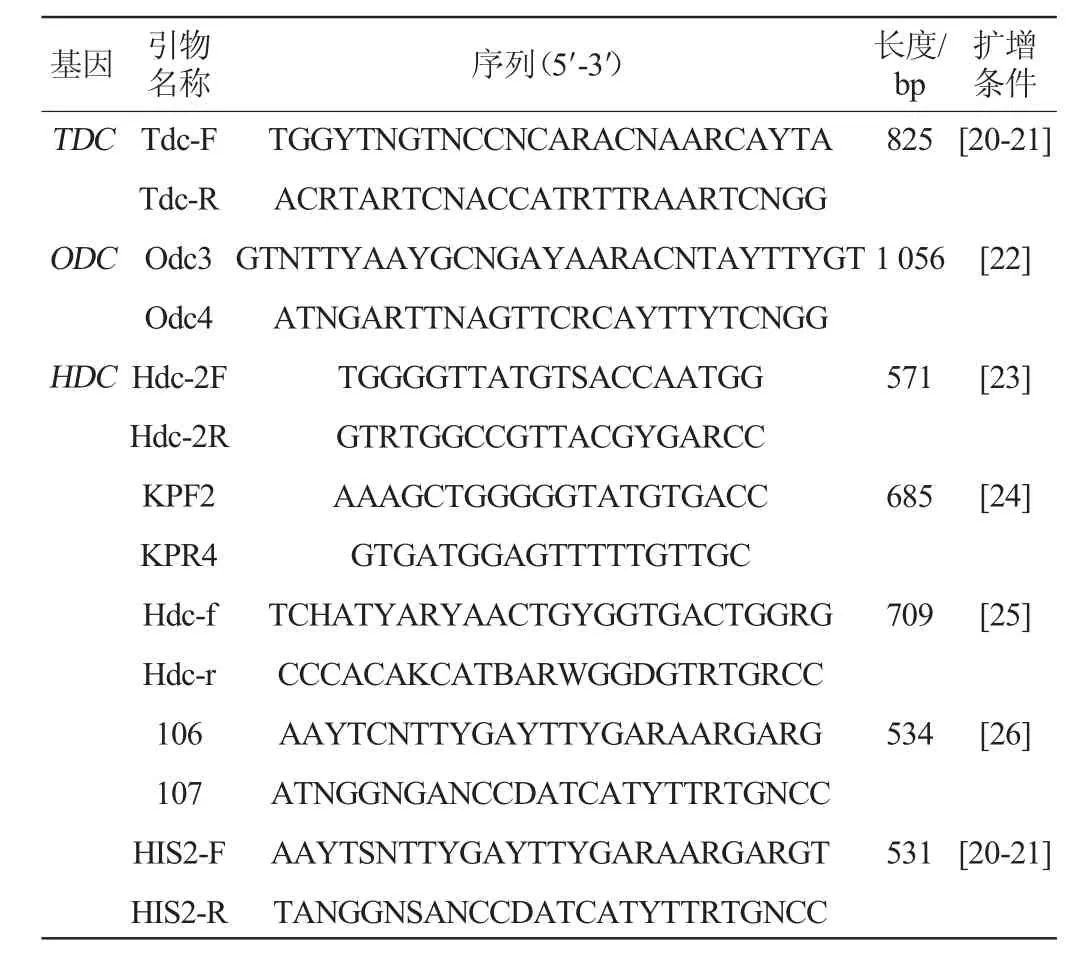
表2 多重PCR引物设计Table 2 Design for premiers of multiplex PCR
1.3.3 单一PCR扩增条件
采用已报道的引物,扩增时的反应体系和条件均参见表2。采用Hdc1/Hdc2引物PCR扩增时的反应体系(25 μL):10×Buffer:2.5 μL,rTaq聚合酶0.25 μL(5 U/μL),dNTPs:2.0 μL(各2.5 mmol/L),DNA模板1.0 μL(10 ng/μL),引物1.0μL(初始浓度10μmol/L),其余用双蒸水补足。反应条件为:95℃预变性5 min,95℃变性30 s,52℃退火30 s,72℃延伸2min,30个循环,72℃延伸10min。反应结束后,取4μL PCR产物,进行琼脂糖凝胶电泳检测。取50 μL扩增体系的PCR产物经琼脂糖凝胶电泳后进行切胶回收,采用大连宝生物的纯化回收试剂盒回收片段,交给北京华大基因有限公司进行测序。
1.3.4 多重PCR条件优化
按照L16(45)正交设计,优化多重PCR的退火温度、Mg2+浓度以及各引物的浓度,其他反应条件和反应体系同1.3.3。因为没有菌株同时产酪胺、腐胺和组胺,所以分别选取菌株Mc4(产组胺和腐胺)和菌株La8(产酪胺)为目标菌,进行正交试验。综合考虑菌株Mc4扩增时组氨酸脱羧酶和鸟氨酸脱羧酶基因片段扩增后的条带的明亮程度,以及菌株La8扩增时酪氨酸脱羧酶基因片段扩增后的条带的明亮程度选择最优的因素水平组合,确定多重PCR的最佳反应体系和条件。
1.3.5 多重PCR特异性实验
选取菌株Mc4、La8的DNA进行混合,根据其DNA含量1.0∶0.5(10 ng∶5 ng)组合,阴性菌株Ma7、Qa1及Qa2做模板。按照1.3.4优化的条件进行扩增,检测3对引物Hdc1/Hdc2、Tdc-F/Tdc-R、Odc3/Odc4的特异性。
1.3.6 多重PCR的灵敏度测试
分别将菌株Mc4和La8的DNA按照测定浓度进行10倍比梯度稀释,使两株菌株的DNA质量浓度分别为150ng/μL、15 ng/μL、1.5 ng/μL、0.15 ng/μL和120 ng/μL、12 ng/μL、1.2ng/μL、0.12ng/μL。分别按照1.3.4优化的条件进行扩增,分析多重PCR对检测酪胺、腐胺和革兰氏阴性组胺产生菌的灵敏度。
1.3.7 多重PCR方法对黄酒酒曲筛选菌株的检测应用
按照1.3.4优化好的多重PCR方法对黄酒酒曲中筛选出来的菌株进行多重PCR扩增,验证该方法对黄酒酒曲中生物胺产生菌检测的有效性。
2 结果与分析
2.1 单重PCR检测结果
按照文献[20-26]中报道的7对引物,将12株产生物胺阳性菌株和3株不产生物胺的阴性菌株(见表2)进行扩增,其中2株阳性菌株的扩增结果如图1所示。由图1可知,腐胺产生菌扩增片段为1056bp,酪胺产生菌扩增片段为825bp,且符合预期结果大小;而组胺产生菌均未得到有效扩增;对3株阴性菌株,所有引物均无法扩增出条带。从NCBI数据库搜索可知,这些针对组氨酸脱羧酶的引物,靶标均为含有378个氨基酸的组氨酸脱羧酶的基因序列。2014年NCBI近新收录的肠杆菌属的组氨酸脱羧酶含有488个氨基酸,该酶与含有378个氨基酸的组氨酸脱羧酶的序列差别很大,相似度仅为15%,而与2,4-二氨基丁酸脱羧酶序列高度相似,相似度为99%。目前虽然没有2,4-二氨基丁酸脱羧酶可以催化组氨酸脱羧合成组胺的报道,但已有其能转化酪氨酸生成酪胺的报道[27],考虑到2,4-二氨基丁酸脱羧酶与组氨酸脱羧酶同属磷酸吡哆醛依赖型天冬氨酸转氨酶超家族,且该酶和肠杆菌属的含有488个氨基酸的组氨酸脱羧酶的高度相似性,推测该酶很可能具有与组氨酸脱羧酶同样的功能。因此,本研究比较了肠杆菌属的组氨酸脱羧酶和本研究所用菌株中的2,4-二氨基丁酸脱羧酶序列,设计了全新的引物Hdc1/Hdc2。按照1.3.3的扩增条件,对所有9株产组胺的菌株,采用该引物均可扩增出大小为735 bp的条带,而对3株阴性对照菌株均没有扩增出条带。这说明新设计的组胺酸脱羧酶引物可以有效检测组胺产生菌。
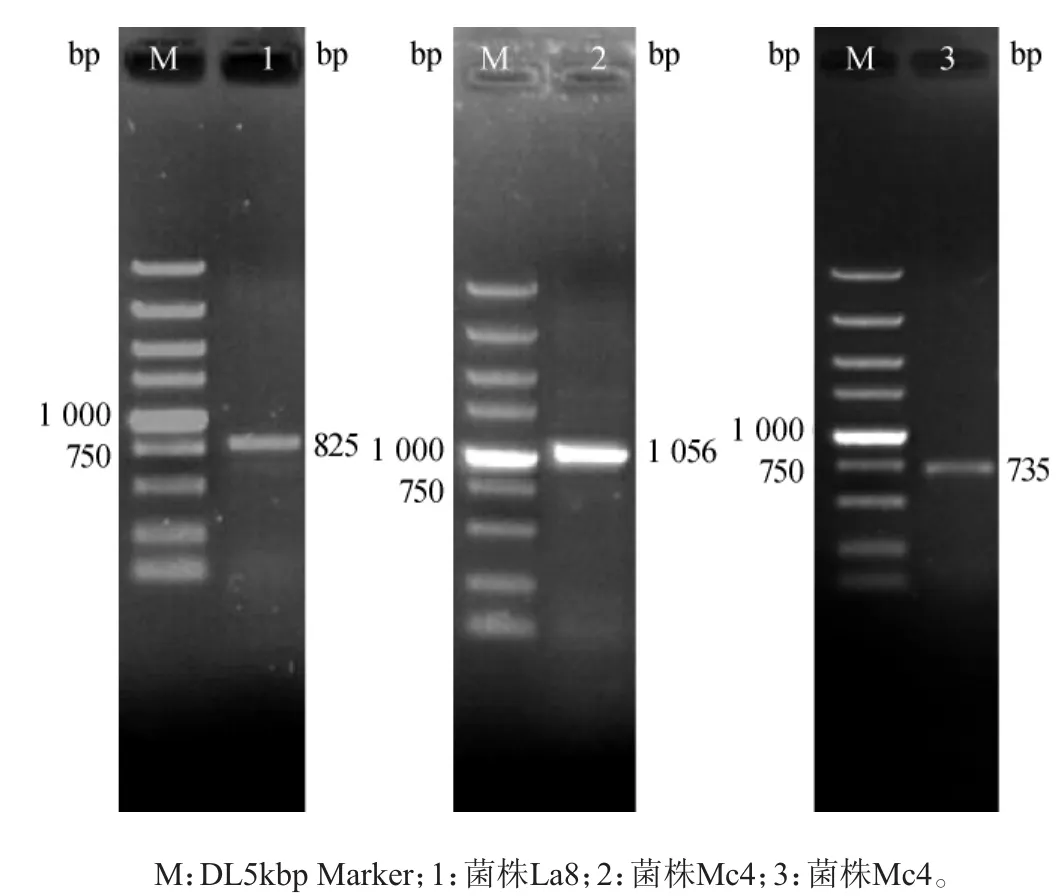
图1 单重PCR扩增产物凝胶电泳图Fig.1 Gel electrophoresis of monoplex PCR amplification products
2.2 多重PCR条件优化
由于单重PCR在进行操作时需要逐一加入单对引物和模板,为使操作更加简便,本实验建立了多重PCR的方法。单一PCR分别检测酪胺,腐胺和革兰氏阴性组胺产生菌时,所用的引物具有不同Tm值,则进行PCR时退火温度会有明显不同,各引物与模板结合的偏好性不同,则各引物的终浓度会不同。因此要建立同时检测酪胺,腐胺和革兰氏阴性组胺产生菌的多重PCR方法,必需要对反应体系和退火温度进行优化。本研究采用L16(45)正交设计对3对引物的浓度,退火温度和Mg2+浓度进行优化,结果见表3。由表3可知,6号试验效果较好,即退火温度为50℃,Mg2+浓度为1.0 mmol/L,引物浓度配比为:Tdc-F/R 0.2 μmol/L,Hdc1/2 0.4 μmol/L和Odc3/4 0.4 μmol/L。在最佳的结果下,多重PCR的凝胶电泳图见图2所示,三对引物均能得到较亮的扩增条带,说明该组正交试验结果较好。
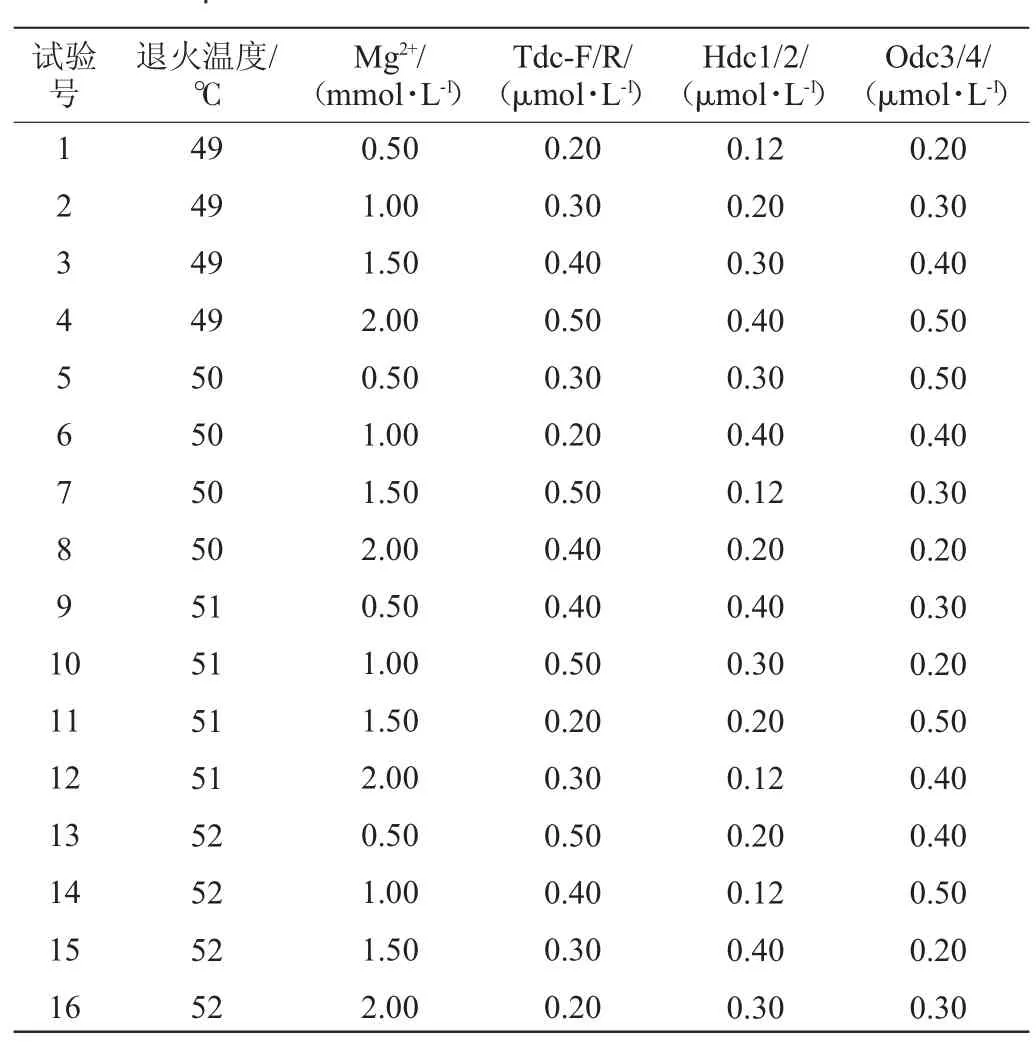
表3 多重PCR条件优化正交试验设计Table 3 Design of orthogonal experiments for PCR conditions optimization
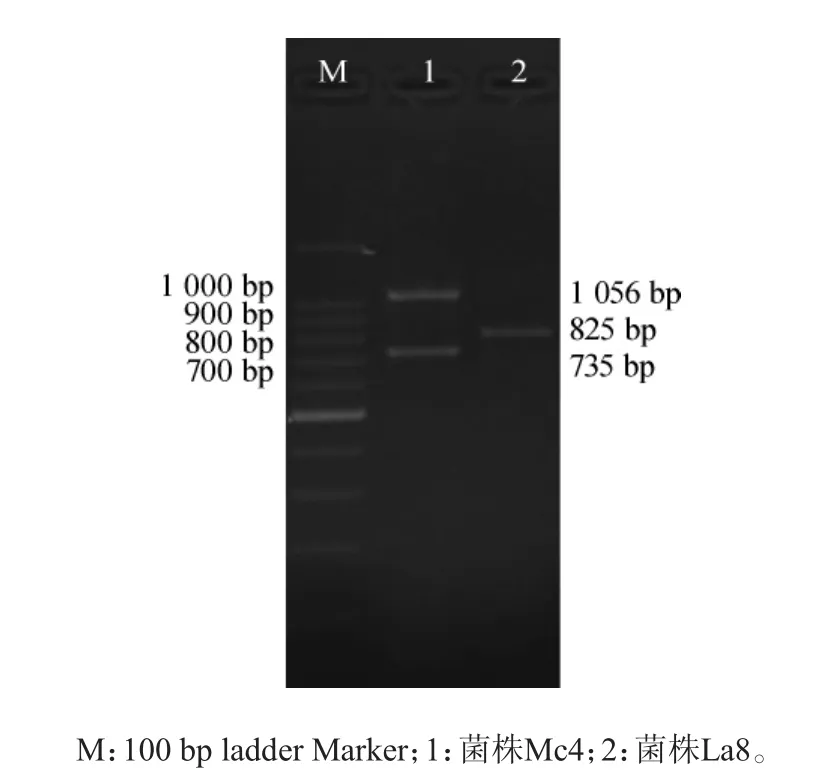
图2 多重PCR扩增产物凝胶电泳图Fig.2 Gel electrophoresis of multiplex PCR amplification products
2.3 多重PCR特异性检验
为了进一步对多重PCR的引物进行特异性检验,验证不同引物和模板之间是否会形成错配,将菌株Mc4和La8的DNA模板按照DNA含量1.0∶0.5(10 ng∶5 ng)比例进行预混作为模板,扩增条件按照2.2优化的结果。多重PCR特异性检验结果见图3。由图3可知,多重PCR产物经琼脂糖凝胶电泳,结果表明这三种引物能够很好的扩增生物胺产生菌的氨基酸脱羧酶序列,特异性条带较亮,任意一株阴性对照组都没有出现扩增,没有出现非特异性条带,可得到这三对引物特异性良好。表明建立的多重PCR方法对检测腐胺和酪胺产生菌以及革兰氏阴性组胺产生菌,具有较好的特异性。
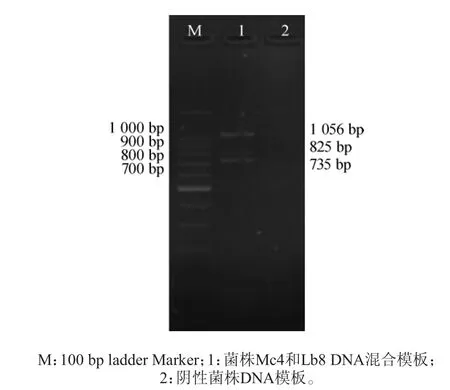
图3 多重PCR特异性扩增产物凝胶电泳图Fig.3 Gel electrophoresis of multiplex PCR specificity amplification products
2.4 多重PCR灵敏度检验
菌株Mc4和La8的DNA质量浓度分别是150.200ng/μL、120.850 ng/μL,将其进行十倍梯度稀释,以该DNA稀释液做模板进行PCR反应,从而确定DNA最低检测限,结果见图4。由图4可知,当模板质量浓度为1.5ng/μL为检测到组胺条带最低浓度,1.5 ng/μL为检测到腐胺条带的最低浓度,1.2 ng/μL为检测酪胺条带的最低浓度。琼脂糖凝胶电泳表明三种引物,Hdc1/2、Odc3/4、Tdc-F/R引物所对应的各自DNA模板检出限分别为1.5 ng/μL、1.5 ng/μL及1.2 ng/μL。
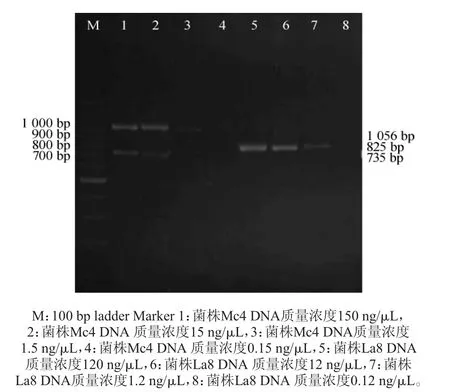
图4 多重PCR灵敏度扩增产物凝胶电泳图Fig.4 Gel electrophoresis of multiplex PCR sensitivity amplification products
2.5 多重PCR方法对黄酒酒曲生物胺产生菌株的检测应用
通过筛选出的两株菌建立了酪胺,腐胺和革兰氏阴性组胺产生菌的多重PCR方法,为了进一步验证及应用该方法,按照多重PCR的优化条件,对酒曲中筛选出的在不同培养基富集的全部菌株进行应用,结果见图5。由图5可知,三对引物都能够在对应的位置得到相应的PCR扩增产物,结果表明,建立的多重PCR方法在检测黄酒酒曲中生物胺产生菌时,与这12株菌的HPLC的结果具有一致性。其中菌株Mc4在735 bp处和1 056 bp处有条带,说明该菌株能够产生组胺和腐胺,由图6可知,菌株Mc4发酵液(培养4 d)高效液相色谱检测结果中出现组胺和腐胺色谱峰,表明该多重PCR的方法可以用于酒曲中生物胺产生菌的快速检测。
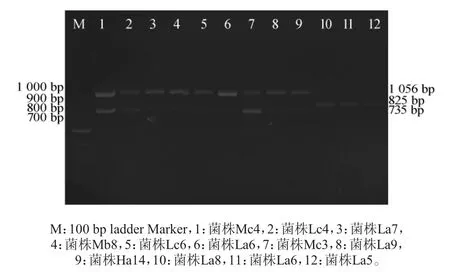
图5 多重PCR检测黄酒酒曲生物胺产生菌扩增产物凝胶电泳图Fig.5 Gel electrophoresis of multiplex PCR amplification products of biogenic amines-producing bacteria in Chinese rice wineJiuqu
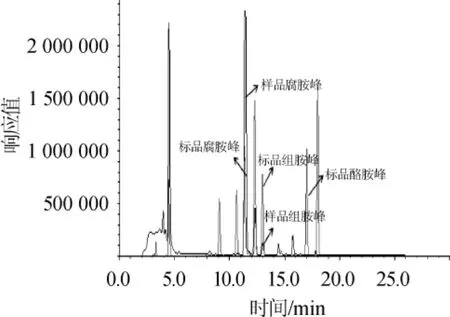
图6 生物胺标准品及菌株Mc4产生物胺的高效液相色谱图Fig.6 HPLC chromatogram of biological amine standard and biogenic amines-produced by strain Mc4
3 结论
本研究建立了一种可同时检测三种生物胺产生菌的多重PCR的方法。在进行PCR的过程中,选取了文献中报道的两对特异性引物[20-22]。另外根据某些生物胺产生菌的种属,进行了全新的引物设计,得到了一对能够扩增革兰氏阴性组胺产生菌的引物。对多重PCR的过程进行了优化,最后的优化结果为退火温度50℃,Mg2+浓度1.0 mmol/L,引物Tdc-F/R浓度0.2 μmol/L,Odc3/4浓度0.4 μmol/L,Hdc1/2浓度0.4 μmol/L,该方法特异性强,对酪胺、腐胺和组胺产生菌的灵敏度分别为1.2ng/μL、1.5ng/μL和1.5 ng/μL,该方法可有效应用于黄酒酒曲中生物胺产生菌的检测,对黄酒的安全生产有重要意义。
[1]王 瑞,陈新军,吴新月,等.新疆赤霞珠葡萄酒发酵过程中生物胺含量的变化[J].中国酿造,2017,36(1):131-134.
[2]李志军,栾同青,钟其顶,等.发酵型饮料酒中生物胺研究进展[J].食品研究与开发,2013,34(12):111-115.
[3]MAIJALA R,EEROLA S.Contaminant lactic acid bacteria of dry sausages produce histamine and tyramine[J].Meat Sci,1993,35(3):387-395.
[4]HERNANDEZ J T,IZQUIERDO P M,VECIANA-NOGUES T,et al.Biogenic amines and polyamine contents in meat and meat products[J].J Agr Food Chem,1997,45(6):2098-2102.
[5]SHALABY A R.Significance of biogenic amines to food safety and human health[J].Food Res Int,1996,29(7):675-690.
[6]ZHU H,YANG S,ZHANG Y,et al.Simultaneous detection of fifteen biogenic amines in animal derived products by HPLC-FLD with solidphaseextractionafterderivatizationwithdansylchloride[J].Anal Method,2016,8(18):3747-3755.
[7]SOUFLEROS E H,BOULOUMPASI E,ZO A,et al.Determination of biogenic amines in Greek wines by HPLC and ultraviolet detection after dansylation and examination of factors affecting their presence and concentration[J].Food Chem,2007,101(2):704-716.
[8]LADERO V,FERNANDEZ M,ALVAREZ M A.Effect of post-ripening processing on the histamine and histamine-producing bacteria contents of different cheeses[J].Int Dairy J,2009,19(12):759-762.
[9]LU Y,LU X,CHEN X,et al.A survey of biogenic amines in Chinese rice wines[J].Food Chem,2007,100(4):1424-1428.
[10]CARDOZO M,LIMA K D S C,FRANCA T C C,et al.Biogenic amines:A public health problem[Aminas Biogênicas:Um Problema de Saúde Pública][J].Rev Virt Química,2013,5(2):149-168.
[11]ROIG-SAGUES A X,HERNANDEZ-HERRERO M M,LOPEZSABATER E I,et al.Evaluation of three decarboxylating agar media to detect histamine and tyramine-producing bacteria in ripened sausages[J].Lett Appl Microbiol,1997,25(5):309-312.
[12]LOUKOU Z,ZOTOU A.Determination of biogenic amines as dansyl derivatives in alcoholic beverages by high-performance liquid chromatography with fluorimetric detection and characterization of the dansylated amines by liquid chromatography-atmospheric pressure chemical ioniz[J].J Chromatogr A,2003,996(1-2):103-113.
[13]FADHLAOUI-ZID K,CURIEL J A,LANDETA G,et al.Biogenic amine production by bacteria isolated from ice-preserved sardine and mackerel[J].Food Control,2012,25(1):89-95.
[14]LANDETE J M,FERRER S,POLO L,et al.Biogenic amines in wines from three Spanish regions[J].J Agr Food Chem,2005,53(4):1119-1124.
[15]TAKAHASHI H,KIMURA B,YOSHIKAWA M,et al.Cloning and sequencing of the histidine decarboxylase genes of gram-negative,histamine-producing bacteria and their application in detection and identification of these organisms in fish[J].Appl Environ Microbiol,2003,69(5):2568-2579.
[16]张玉霞,黄 鸣.食品检验中多重PCR技术的应用[J].中国卫生检验杂志,2008,18(5):958-960.
[17]HENEGARIU O,HEEREMA N A,DLOUHY S R,et al.Multiplex PCR:critical parameters and step-by-step protocol[J].Biotechniques,1997,23(3):504-511.
[18]毛青钟,俞关松.黄酒浸米浆水中优势细菌的不同对发酵的影响[J].酿酒,2010,37(5):76-80.
[19]赵艳卓,刘树文.酒酒球菌中生物胺相关基因的检测[J].中国酿造,2011,30(12):40-42.
[20]DE l R B,MARCOBAL A,CARRASCOSA A V,et al.PCR detection of foodborne bacteria producing the biogenic amines histamine,tyramine,putrescine,and cadaverine[J].J Food Prot,2006,69(10):2509-2514.[21]DE l R B,MARCOBAL A,MUNOZ R.Gene organization of the ornithine decarboxylase-encoding region inMorganella morganii[J].J Appl Microbiol,2007,102(6):1551-1560.
[22]MARCOBAL A,DE l R B,MORENO-ARRIBAS M V,et al.Multiplex PCR method for the simultaneous detection of histamine-,tyramine-,and putrescine-producing lactic acid bacteria in foods[J].J Food Prot,2005,68(4):874-878.
[23]WONGSARIYAK,BUNYAPRAPHATSARAN,YASAWONGM,etal.Development of molecular approach based on PCR assay for detection of histamine producing bacteria[J].J Food Sci Technol,2016,53(1):640-648.
[24]KANKI M,YODA T,TSUKAMOTO T,et al.Klebsiella pneumoniae producesnohistamine:RaoultellaplanticolaandRaoultella ornithinolytica strains are histamine producers[J].Appl Environ Microbiol,2002,68(7):3462-6.
[25]LANDETE J M,DE L R B,MARCOBAL A,et al.Molecular methods for the detection of biogenic amine-producing bacteria on foods[J].Int J Food Microbiol,2007,117(3):258-269.
[26]RIVASBDL,ÁNGELAMARCOBAL,MUNOZR.Improvedmultiplex-PCR method for the simultaneous detection of food bacteria producing biogenic amines[J].Fems Microbiol Lett,2005,244(2):367-372.
[27]BURRELL M,HANFREY C C,KINCH L N,et al.Evolution of a novel lysinedecarboxylaseinsiderophorebiosynthesis[J].Molecul Microbiol,2012,86(2):485-499.
Multiplex polymerase chain reaction for simultaneous detection of biogenic amines-producing bacteria in Chinese rice wineJiuqu
ZHU Xiaojuan,ZHAO Lei,XU Ruitao,WANG Daoan,CHEN Shuo,JIN Jiayu,ZHANG Jian*
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China)
A multiplex polymerase chain reaction (mPCR)method for the detection of biogenic amines-producing bacteria established in this research.Firstly,the specificity of some reported primers against tyramine,putrescine and gram-negative histamine-producing bacteria was detected,and the poor primer-specificity against gram-negative histamine-producing bacteria was observed.To solve this problem,the primers for gram-negative histamine producing bacteria were redesigned.A mPCR method for simultaneous detection of tyramine,putrescine and histamine-producing bacteria was established.After that,the annealing temperature was 50℃,the concentration of Mg2+was 1.0 mmol/L and the concentration ratio of the Tdc-F/R,Hdc1/2,Odc3/4 primers were 0.2 μmol/L,0.4 μmol/L,and 0.4 μmol/L,respectively.This method was specific for amplification of the biogenic amine-producing bacteria.The detect sensitivity of tyramine,putrescine and histamine were 1.2 ng/μl,1.5 ng/μl,and 1.5 ng/μl,respectively.The method can be applied in the rapid detection biogenic amines-producing bacteria in Chinese rice wineJiuqu.
multiplex polymerase chain reaction;detection;Chinese rice wineJiuqu;biogenic amines-producing bacteria
TS207.3
0254-5071(2017)10-0036-06
10.11882/j.issn.0254-5071.2017.10.009
2017-07-16
国家自然科学基金资助项目(31471725);天津科技大学大学生实验室创新基金(1604A103)
朱晓娟(1992-),女,硕士研究生,研究方向为轻工技术与工程。
*通讯作者:张 健(1978-),男,副研究员,博士,研究方向为发酵食品安全。
