植物乳杆菌YI-Y 2013冻干保护剂配方优化
2017-11-16樊振南佟立涛周素梅易翠平
樊振南 - 佟立涛 - 周素梅 - 易翠平 -
(1. 长沙理工大学化学与生物工程学院,湖南 长沙 410114;2. 中国农业科学院农产品加工研究所,北京 100193) (1. School of Chemistry and Biological Engineering, Changsha University of Science and Technology, Changsha, Hunan 410114, China; 2. Institute of Agro-products Processing Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
植物乳杆菌YI-Y 2013冻干保护剂配方优化
樊振南1FANZhen-nan1佟立涛2TONGLi-tao2周素梅2ZHOUSu-mei2易翠平1YICui-ping1
(1. 长沙理工大学化学与生物工程学院,湖南 长沙 410114;2. 中国农业科学院农产品加工研究所,北京 100193) (1.SchoolofChemistryandBiologicalEngineering,ChangshaUniversityofScienceandTechnology,Changsha,Hunan410114,China; 2.InstituteofAgro-productsProcessingScienceandTechnology,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
为制备鲜湿米粉发酵剂,以分离自米粉自然发酵液的植物乳杆菌YI-Y 2013的菌体存活率为目标,在单因素试验基础上,经过Plackett-Burman试验筛选出有显著效果的3种保护剂:山梨醇、麦芽糊精和甘油,进一步通过中心组合试验设计和响应面分析得到显著性的拟合回归方程。结果表明,最佳保护剂配方为:山梨醇浓度1.1 g/100 g,麦芽糊精浓度24.8 g/100 g,甘油浓度2.4 g/100 g,该条件下菌体存活率为(76.08±2.68)%,与预测值较为接近。
植物乳杆菌YI-Y 2013;保护剂;存活率
直投式发酵剂是一种活菌含量高、应用简单、可提升产品品质的发酵剂[1]。直投式发酵剂的常用干燥方法有喷雾干燥[2]、流化床干燥[3]、空气对流干燥[4]和真空冷冻干燥[5]等,其中真空冷冻干燥是植物乳杆菌最常用的干燥方法。真空冷冻干燥具有适用范围广、存活率高、运输方便等特点。但由于冻干过程中微生物体内的游离水会形成较大冰晶对微生物造成不可恢复的损伤,从而导致菌体死亡,因此通常需要添加合适的冻干保护剂来提高菌体的存活率[6-7]。植物乳杆菌种类繁多,在肉类[8]、奶类[9]、泡菜[10]及酸面团[11]等发酵食品中均有应用。随着研究人员[12-13]对鲜湿米粉发酵过程的不断研究,发现植物乳杆菌对鲜湿米粉的品质有重要的影响,但米粉直投式发酵剂的制备至今鲜见报道。由于植物乳杆菌来源不同,其形状和结构都有差异,因此对植物乳杆菌冻干保护剂进行优化具有十分重要的意义。
本研究拟通过对比不同保护剂在植物乳杆菌冻干过程中的作用效果,并优化复合保护剂的配比,为鲜湿米粉直投式发酵剂的制备提供理论支持。
1 材料与方法
1.1 材料与试剂
植物乳杆菌(Lactobacillusplantarum,L.plantarum) YI-Y 2013:由本实验室从鲜湿米粉自然发酵液中采用纯培养的方法划线分离,并对其技术特征进行分析、基因测序鉴定后保存备用[14](原名称为CSL 23),现已在中国典型培养物保藏中心保藏,保藏编号为CCTCC M 2017533;
MRS肉汤和MRS培养基:广东环凯微生物科技有限公司;
山梨醇,葡萄糖、麦芽糖、海藻糖和甘油:分析纯,国药集团化学试剂有限公司;
麦芽糊精:山东西王食品有限公司。
1.2 主要仪器与设备
双人单面净化工作台:SW-CT-2FD型,苏州净化设备有限公司;
离心机:TG16型,长沙东旺实验仪器有限公司;
冷冻干燥机:FFD-1A型,北京医博康实验仪器有限公司;
电热鼓风干燥箱:101-2A型,天津市泰斯特仪器有限公司;
高压蒸汽灭菌锅:YXQ-LS-18SI型,上海博实业有限公司医疗设备厂;
恒温水浴锅:DJK-2000-L型,天津市泰斯特仪器有限公司;
恒温振荡培养箱:THTZ-C型,苏州培英实验设备责任有限公司;
电热恒温培养箱:DHH5000II型,天津市泰斯特仪器有限公司;
超低温冰箱:MDF-382E型,日本三洋电器生物医药公司。
1.3 试验方法
1.3.1 工艺流程
活化菌种→纯培养→液体培养→离心过滤收集菌泥→加入保护剂→分装→预冻→真空冷冻干燥→冻干菌粉→活菌计数
1.3.2 操作要点
(1) 纯培养:将活化好的菌种经过2次划线培养,挑选出单个菌落作为液体培养菌种。
(2) 液体培养及收集菌泥:将菌种接种至含有MRS肉汤的三角瓶中,在37 ℃条件下,培养18 h后收集菌体;将菌液移入250 mL无菌带盖离心杯中,4 500 r/min离心25 min,弃上清液,用0.85 g/100 mL无菌生理盐水洗涤沉淀菌体,4 500 r/min离心25 min,弃上清液即得菌泥。
(3) 保护剂处理及添加:将葡萄糖、麦芽糖、山梨醇、麦芽糊精、海藻糖、甘油等保护剂配制成所需浓度后,进行灭菌处理(121 ℃,15 min);混合保护剂以同样的方式灭菌。将取1.0 g菌泥与5 mL 0.85 g/100 mL无菌生理盐水混合制备成菌液(20 g/100 mL),以菌悬液∶保护剂=1∶3比例混合均匀,制成细胞悬液。
(4) 冷冻干燥条件:在-68 ℃条件下冷冻3 h,取出后放入真空冷冻干燥机中,在压力<25 Pa,-52 ℃的条件下干燥16 h,然后放置于4 ℃冰箱中保存备用。
(5) 活菌计数:将冻干粉从冰箱中取出,加入1 mL 0.85 g/100 mL 无菌生理盐水混匀,使其与冻干前菌悬液的体积相等,放置在30 ℃水浴锅中水浴10 min,备用。
1.3.3 菌体存活率的测定 参考GB 4789.2—2016方法稍作修改:采用MRS培养基进行平板计数,37 ℃条件下培养(48±2) h,测定冻干前后活菌总数,并按式(1)计算存活率。
预应力技术在桥梁公路作业中的应用,已有较长时间,但我国在这方面起步晚,技术发展仍有较大的进步空间,在实际操作施工过程中也没有明确规范步骤,因此,施工要求标准较低,施工不严格,在通常情况下,很多施工单位采取的方法都是采用1.5级的油压表作为施工计量工具,但是在实际施工过程中,由于施工技术人员的素质水平较低,没有控制好张拉幅度,使最终得出的数值与实际需要的数值相差甚远,而且由于张拉力在不同阶段出现较大差异,因此导致混凝土环境整体下降,结构强度较低。所以,在张拉力控制方面,需要不断明确操作规范,提高攻克技术难题的能力,不断提升设备的质量。
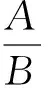
(1)
式中:
c——菌体存活率,%;
A——1 mL菌悬液冻干后菌落总数,CFU;
B——1 mL菌悬液冻干前菌落总数,CFU。
1.4 试验设计
1.4.1 单因素设计 以菌体存活率为评价指标,选取了葡萄糖、麦芽糖、山梨醇、麦芽糊精、海藻糖、甘油作为保护剂[15-18],并比较它们对植物乳杆菌YI-Y 2013在真空冷冻干燥过程中的保护效果。
(1) 甘油保护效果:甘油添加量为1,2,3,4,5 g/100 g,不添加其他保护剂,测定甘油对植物乳杆菌YI-Y 2013的保护效果。
(2) 麦芽糖保护效果:麦芽糖添加量为2,4,6,8,10 g/100 g,不添加其他保护剂,测定麦芽糖对植物乳杆菌YI-Y 2013的保护效果。
(4) 海藻糖保护效果:海藻糖添加量为0.5,1.0,1.5,2.0,2.5 g/100 g,不添加其他保护剂,测定海藻糖对植物乳杆菌YI-Y 2013的保护效果。
(5) 山梨醇保护效果:山梨醇添加量为1,2,3,4,5 g/100 g,不添加其他保护剂,测定山梨醇对植物乳杆菌YI-Y 2013的保护效果。
(6) 麦芽糊精保护效果:麦芽糊精添加量为10,15,20,25,30 g/100 g,不添加其他保护剂,测定麦芽糊精对植物乳杆菌YI-Y 2013的保护效果。
1.4.2 优化设计 以菌体存活率为评价指标,选定葡萄糖、麦芽糖、山梨醇、麦芽糊精、海藻糖、甘油作为保护剂进行Plackett-Burman试验设计和分析,从中筛选出3种保护效果较好的山梨醇、甘油和麦芽糊精为因素,并以菌体存活率为响应变量进行中心组合试验及响应面分析。
1.5 数据处理
试验设计、数据分析以及模型建立分别采用Excel 2003、Minitab 16和Design-Expert.V8.0.6软件进行方差分析和模型分析。
2 结果与讨论
2.1 单因素分析
2.1.1 甘油浓度的选择 由图1可知,在一定范围内,随着甘油浓度的增加,菌体存活率呈现上升趋势,当甘油浓度为3 g/100 g时,存活率达到(29.21±2.64)%,之后菌体存活率无显著变化(P<0.05)。因此,选择甘油浓度为3 g/100 g进行后续试验。这与许多研究结果基本一致,许女等[17]添加含0.5%甘油的复合保护剂,使得冻干后植物乳杆菌MA2的存活率达到61%;方义川等[1]添加含1%甘油、2.5%脱脂奶粉、2.5%葡萄糖、1%蔗糖和2.5% VC的混合保护剂,使得嗜酸乳杆菌的存活数达到1.27×1012CFU/g。甘油在乳酸菌冻干保护剂中较为常用,研究发现,甘油可以渗透到菌体内部,增强菌体与水的结合能力[19],减少游离水含量,并增加溶液粘性,从而减缓晶核的生长,使形成的冰晶较细小,以达到保护菌体的目的[18]。但甘油浓度过高,会延长冻干时间,浪费能源[20]。
2.1.2 葡萄糖和麦芽糖浓度的选择 由图2可知,当麦芽糖的浓度低于6 g/100 g时,随着浓度的增大菌体存活率呈上升趋势,但高于6 g/100 g时,随着浓度的继续增大,菌体存活率无显著变化(P<0.05)。因此,选择麦芽糖浓度为6 g/100 g 进行后续试验。随着葡萄糖浓度不断地增大菌体存活率呈上升趋势,浓度高于8 g/100 g以后,存活率无显著变化(P<0.05),因而选择葡萄糖浓度为8 g/100 g进行后续试验。韩德权等[15]发现,葡萄糖添加量为10%时,植物乳杆菌冻干后存活率可以达到30%以上;Chen等[21]发现,麦芽糖添加量为3%时,嗜酸乳杆菌冻干后存活率为2.47%,而空白对照组约为0.8%。这些研究表明,葡萄糖和麦芽糖在菌种冻干过程中均有较好的保护效果。而麦芽糖保护效果优于葡萄糖,可能与冻干样品玻璃化温度有关[22]。
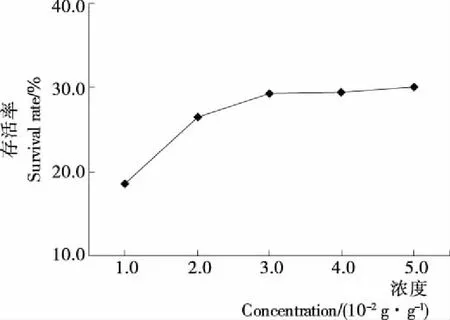
图1 甘油浓度对菌体存活率的影响Figure 1 Effect of glycerol concentrationon the survival rate of L. plantarum YI-Y 2013

图2 葡萄糖和麦芽糖浓度对菌体存活率的影响
Figure 2 Effect of glycerol and maltose concentrationon the survival rate ofL.plantarumYI-Y 2013
2.1.3 海藻糖和山梨醇浓度的选择 由图3可知,山梨醇质量浓度低于1.5 g/100 g时,菌体存活率不断增加,当其浓度高于1.5 g/100 g时,菌体存活无显著变化(P<0.05)。因此,山梨醇的浓度应取1.5 g/100 g最为合适。海藻糖的浓度低于2 g/100 g时,菌体存活率随海藻糖浓度的增大而增大,高于2 g/100 g时,菌体存活率无显著变化(P<0.05)。当海藻糖和山梨醇浓度均为在0.75 g/100 g时,菌体存活率一致。Nahr等[23]添加含20.5%海藻糖的复合保护剂,使得冻干后植物乳杆菌菌种存活量为1.93×109CFU/mL;Lee等[24]添加10%山梨醇和10%脱脂乳粉,使得植物乳杆菌JH 287冻干存活率达到86.37%。表明海藻糖和山梨醇作为植物乳杆菌的冻干保护剂有显著的效果。研究表明,海藻糖具有多个羟基,能与菌体表面的自由基结合,避免菌体暴露在介质中,同时可与蛋白质形成氢键取代水[25],稳定细胞膜和蛋白质结构[26];山梨醇具有多个羟基,在冻干过程中可与菌体蛋白质极性基团结合形成氢键[17],稳定蛋白质的结构和功能。海藻糖与山梨醇的结构相似,但对此菌种的冻干保护效果有显著差异(P<0.05),可能与菌种自身的特点有关。

图3 海藻糖和山梨醇浓度对菌体存活率的影响
Figure 3 Effect of trehalose and sorbitor concentration on the survival rate ofL.plantarumYI-Y 2013
2.1.4 麦芽糊精质量浓度的选择 由图4可知,当麦芽糊精浓度低于25 g/100 g时,随着浓度的增加菌体存活率呈上升趋势,当浓度>25 g/100 g时,菌体存活率无显著变化(P<0.05)。赵静等[18]研究显示,添加脱脂乳粉15.0 g/L,蔗糖20.0 g/L,麦芽糊精25.0 g/L和甘油3.0 mL/L可以使高产γ-氨基丁酸植物乳杆菌存活率达到75.3%。麦芽糊精是大分子保护剂[17],通过“包裹”的形式避免菌体暴露在介质中,维持菌体的稳定性[18]。
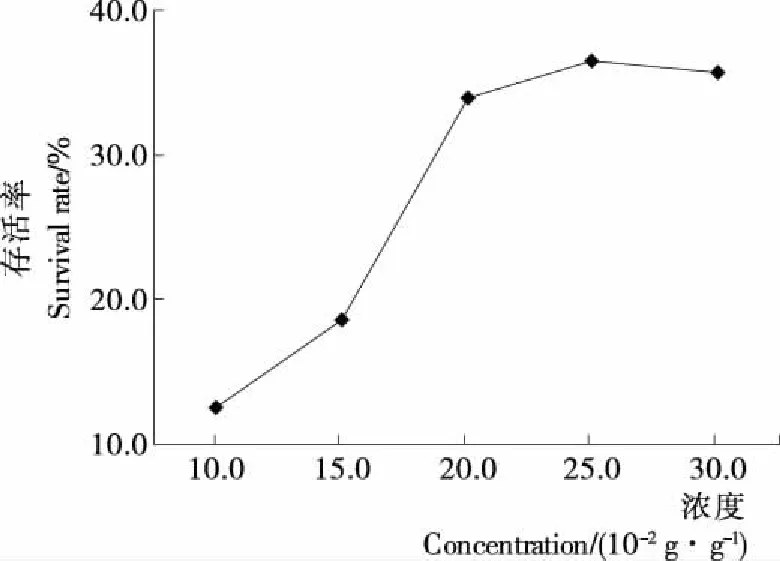
图4 麦芽糊精浓度对菌体存活率的影响
Figure 4 Effect of maltodextrin concentrationon the survival rate ofL.plantarumYI-Y 2013
2.2 Plackett-Burman 设计及结果分析
选用N=12的Plackett-Burman试验设计,试验设计和结果见表1、2,试验结果分析见表3。由表3可知,山梨醇、甘油、麦芽糊精和葡萄糖对菌体保护有促进作用,海藻糖和麦芽糖有抑制作用。根据回归方程系数可知,与其他3种保护剂相比,葡萄糖的促进效果不显著(P<005)。有研究[27]表明,在保护剂的选择过程中大分子和小分子保护剂的配合使用可增强保护效果。因此,选择山梨醇、麦芽糊精和甘油作为中心组合试验的研究对象。

表1 Plackett-Burman试验设计因素及水平Table 1 Factors and levels of Plackett-Burman test design g/100 g
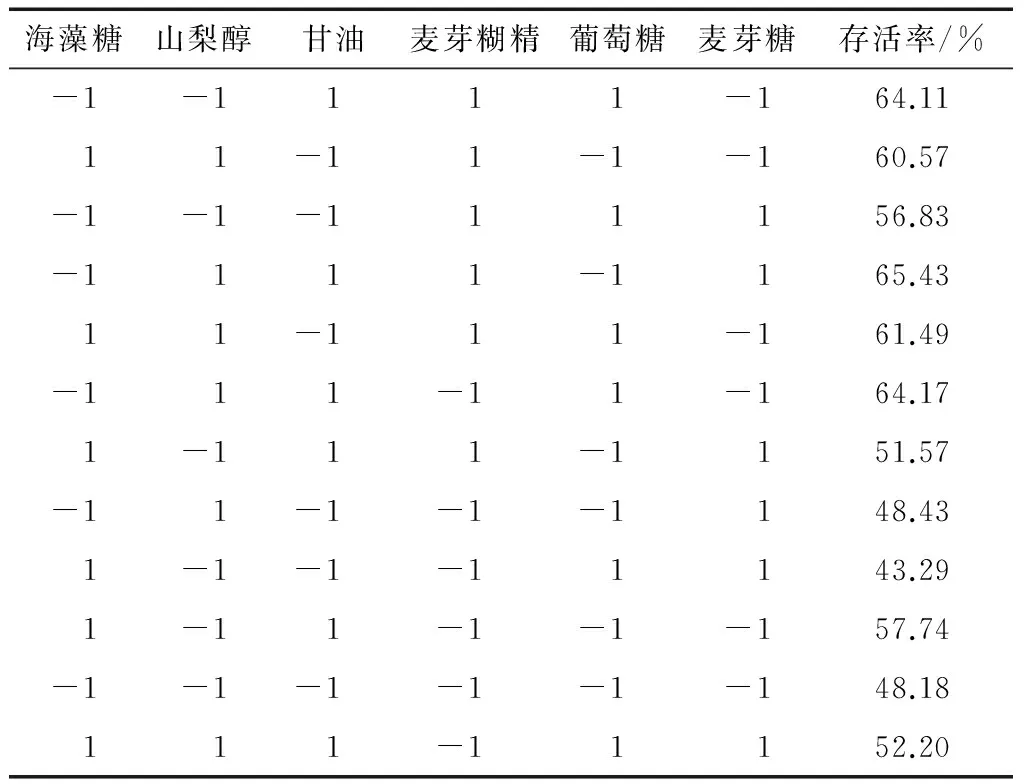
表2 Plackett-Burman 试验设计及结果Table 2 Plackett-Burman test design and results
2.3 中心组合试验及响应面分析
根据Plackett-Burman试验结果选择3种效果较好的保护剂进行中心组合试验,因素水平及结果见表4、5。
以存活率(Y)为因变量,因素A、B、C为自变量的回归方程为:
Y=7 832.5.14-2.83A+0.99B-1.05C-1.32AB+4.34BC-6.25A2-10.46B2-9.81C2。
(2)
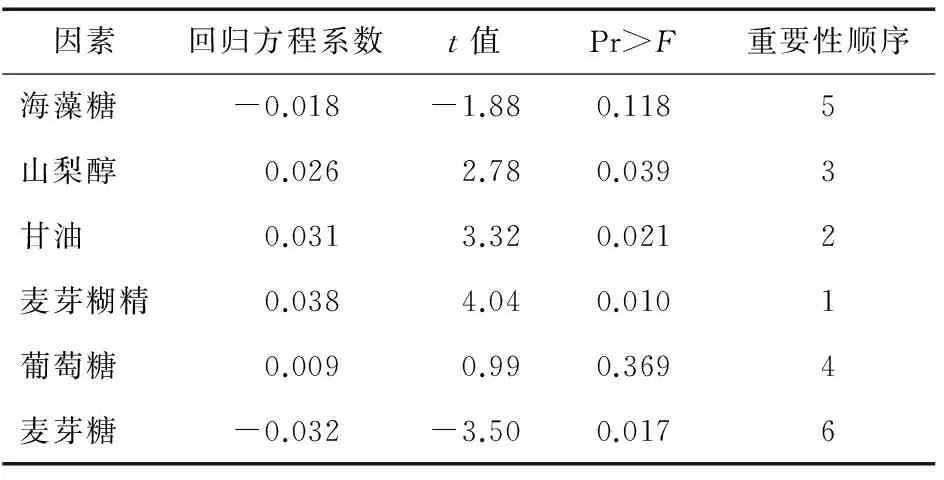
表3 Plackett-Burman 试验结果分析Table 3 Plackett-Burman test results analysis

表4 中心组合试验因素及水平Table 4 Factors and levels of central composite experiment g/100 g
用F值检验评估方程,得到的概率水平在95%的条件下回归方程有显著性(P<0.05)。方程(2)的确定系数R2=0.964 7,说明96.47%的试验数据可以用于方程解释。图5是响应面三维图,证实了拟合面含有真实的最大值。通过软件计算得到最优方案为:山梨醇浓度1.13 g/100 g、麦芽糊精浓度24.8 g/100 g、甘油浓度2.45 g/100 g,此时菌体存活率76.68%。为了检验预测值,取山梨醇浓度1.1 g/100 g,麦芽糊精浓度24.8 g/100 g,甘油浓度2.4 g/100 g,进行3次重复实验,得到的平均菌体存活率(76.08±2.68)%,此时干粉中的菌体含量为8.6×1011CFU/g。基本上与数学模型得到的最大菌体存活率符合,说明响应面法优化得到的数学模型与试验数据拟合较好。
Figure 5 Response surface plots of the effect of sorbitor, maltodextrin and glycerol on the survival rate ofL.plantarumYI-Y 2013
表5中心组合试验设计及结果
Table 5 Central composite experimental design and result of the survival rate ofL.plantarumYI-Y 2013
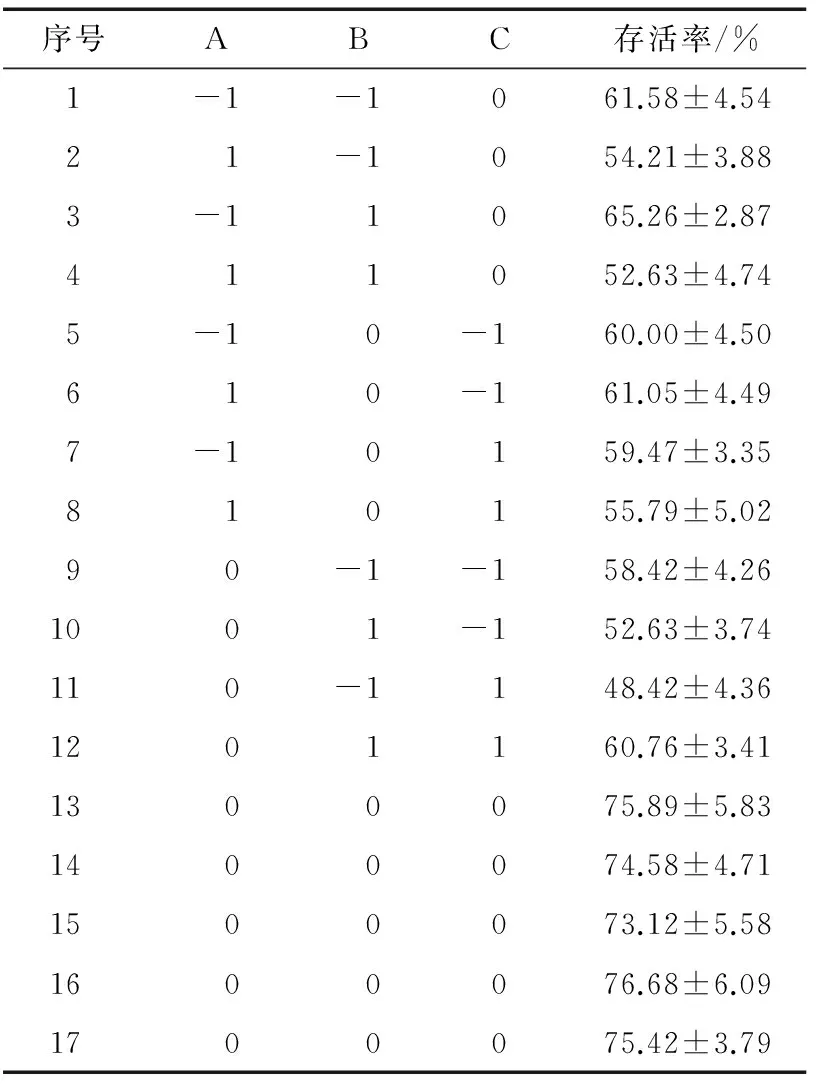
序号ABC存活率/%1-1-1061.58±4.5421-1054.21±3.883-11065.26±2.87411052.63±4.745-10-160.00±4.50610-161.05±4.497-10159.47±3.35810155.79±5.0290-1-158.42±4.261001-152.63±3.74110-1148.42±4.361201160.76±3.411300075.89±5.831400074.58±4.711500073.12±5.581600076.68±6.091700075.42±3.79
3 结论
在单因素试验确定各因素最适浓度的基础上,经过Plackett-Burman试验筛选出有显著效果的3种保护剂:山梨醇、麦芽糊精和甘油,通过中心组合试验设计和响应面分析拟合出一个三元二次方程,并得到最佳值。最佳保护剂配方为:山梨醇浓度1.1 g/100 g,麦芽糊精浓度24.8 g/100 g,甘油浓度2.4 g/100 g,此时菌体存活率为(76.08±2.68)%,干粉中菌体含量为8.6×1011CFU/g。虽然植物乳杆菌YI-Y 2013在该法中菌体存活率仍然低于报道[28]中植物乳杆菌NCU 116的(91.76±1.82)%,但相比不加保护剂时YI-Y 2013菌体存活率的9.48%已有极显著提高(P<0.01),可能除菌种之间的差异外,配方的优化还有进一步提升的空间。可为植物乳杆菌YI-Y 2013制备直投式发酵剂应用于鲜湿米粉的控制发酵提供理论依据。
[1] 方义川, 杨虹坤, 何谦, 等. 直投式乳酸菌发酵剂的研制[J]. 现代食品科技, 2012(8): 990-994.
[2] GOLOWCZYC M A, SILVA J, ABRAHAM A G, et al. Preservation of probiotic strains isolated from kefir by spray drying.[J]. Letters in Applied Microbiology, 2010, 50(1): 7-12.
[3] STRASSER S, NEUREITER M, GEPPL M, et al. Influence of lyophilization, fluidized bed drying, addition of protectants, and storage on the viability of lactic acid bacteria[J]. Journal of Applied Microbiology, 2009, 107(1): 167-177.
[4] DIMITRELLOU D, TSAOUSI K, KOURKOUTAS Y, et al. Fermentation efficiency of thermally dried immobilized kefir on casein as starter culture[J]. Process Biochemistry, 2008, 43(12): 1 323-1 329.
[5] 贺金梅, 刘俊轩, 孙颖, 等. 固态微生物菌剂干燥和菌体保存的研究进展[J]. 食品工业科技, 2012, 33(15): 423-427.
[6] MIYAMOTO-SHINOHARA Y, SUKENOBE J, IMAIZUMI T, et al. Survival of freeze-dried bacteria[J]. Journal of General & Applied Microbiology, 2008, 54(1): 9-24.
[7] 乔晓玲, 闫祝炜, 张原飞, 等. 食品真空冷冻干燥技术研究进展[J]. 食品科学, 2008, 29(5): 469-474.
[8] GEET A, AJIT S Yadav. Antioxidant and antimicrobial profile of chicken sausages prepared after fermentation of minced chicken meat with Lactobacillus plantarum, and with additional dextrose and starch[J]. LWT-Food Science and Technology, 2017, 77: 249-258.
[9] MISHRA S, MISHRA H N. Effect of Synbiotic Interaction of Fructooligosaccharide and Probiotics on the Acidification Profile, Textural and Rheological Characteristics of Fermented Soy Milk[J]. Food & Bioprocess Technology, 2013, 6(11): 3 166-3 176.
[10] SMITAHASINI P, SATARUPA P, SETHURAMAN S P, et al. Anthocyanin-rich sweet potato lacto-pickle: production, nutritional and proximate composition[J]. International Journal of Food Science & Technology, 2010, 44(3): 445-455.
[11] GOBBETTI M, SIMONETTI M S, CORSETTI A, et al. Volatile compound and organic acid productions by mixed wheat sour dough starters: influence of fermentation parameters and dynamics during baking[J]. Food Microbiology, 1995, 12(95): 497-507.
[12] 易翠平, 任梦影, 周素梅, 等. 纯种发酵对鲜湿米粉品质的影响[J]. 食品科学, 2017, 38(4): 20-25.
[13] 易翠平, 周慧, 佟立涛. 鲜米粉加工过程中的发酵工艺研究进展[J]. 食品与机械, 2013, 29(5): 223-225.
[14] 杨有望. 鲜湿米粉自然发酵的研究[D]. 长沙: 长沙理工大学, 2016: 40-63.
[15] 韩德权, 杨丽娟, 孙庆申, 等. 响应面法优化植物乳杆菌冻干保护剂[J]. 食品科学, 2010, 31(5): 219-224.
[16] 李家鹏, 张学刚, 乔晓玲, 等. 响应面法优化植物乳杆菌冷冻干燥保护剂配方的研究[J]. 食品科学, 2008, 29(6): 146-150.
[17] 许女, 习傲登, 张玢. 真空冷冻干燥工艺参数对植物乳杆菌MA2活性的影响[J]. 中国酿造, 2011, 30(11): 34-38.
[18] 赵静, 梁金钟. 直投式产γ-氨基丁酸植物乳杆菌冻干保护剂生产工艺的优化[J]. 食品工业科技, 2015, 36(9): 140-143.
[19] 蒲丽丽, 刘宁, 张英华, 等. 乳酸菌冻干保护剂及保护机理的研究进展[J]. 现代食品科技, 2005(1): 50-52.
[20] 张炎, 张卫兵, 宋雪梅, 等. 冻干保护剂对复合低温乳酸菌发酵剂的影响[J]. 食品工业科技, 2015(7): 144-147.
[21] CHEN He, MA Zhen-xing, SHU Guo-wei, et al. Effect of Sucrose, lactose, glucose, maltose on survival of lactobacillus acidophilus during freeze-drying[J]. Advanced Materials Research, 2012, 382: 396-399.
[22] 周新丽, 刘建峰, 张绍志, 等. 生物材料冻干保护剂的热分析[J]. 制冷学报, 2008, 29(5): 54-57.
[23] FATEMEH Keivani Nahr, REZA Rezaei Mokarram, MOHAMMAD Amin Hejazi, et al. Optimization of the nanocellulose based cryoprotective medium to enhance the viability of freeze driedLactobacillusplantarum, using response surface methodology[J]. LWT-Food Science and Technology, 2015, 64(1): 326-332.
[24] LEE S B, KIM D H, PARK H D. Effects of protectant and rehydration conditions on the survival rate and malolactic fermentation efficiency of freeze-dried Lactobacillus plantarum, JH287[J]. Applied Microbiology & Biotechnology, 2016, 100(18): 7 853-7 863.
[25] 蒲丽丽, 刘宁. 保加利亚乳杆菌冻干保护剂保护作用的研究[J]. 中国酿造, 2010, 29(5): 46-48.
[26] FUCHIGAMI M, OGAWA N, AI T. Trehalose and hydrost-atic pressure effects on the structure and sensory properties of frozen tofu (soybean curd)[J]. Innovative Food Science & Emerging Technologies, 2002, 3(2): 139-147.
[27] MANALIS N, MAGKANARI F. Production of traditional Gre-ek yoghurt using Lactobacillus strains with probiotic potential as starter adjuncts[J]. International Dairy Journal, 2006, 16(1): 52-60.
[28] 熊涛, 黄锦卿, 宋苏华, 等. 植物乳杆菌真空冷冻干燥保护剂配方优化[J]. 南昌大学学报: 理科版, 2010, 34(6): 561-565.
Optimizationoffreeze-dryingprotectantforLactobacillusplantarumYI-Y2013
In order to prepare fresh rice noodle through starter, the survival rate ofL.plantarumYI-Y 2013 isolated from natural fermentation liquid was used as target. 3 kinds of protective agent through single factor experiment and Plackett-Burman test were screened, i.e., sorbitol, maltodextrin and glycerin. Moreover, the response surface analysis and fit the regression equations were carried out, and the results indicated that the best protection formula was: sorbitol 1.1 g / 100 g, maltodextrin 24.8 g / 100 g, and glycerol 2.4 g / 100 g. The bacteria survival rate was found arriving to (76.08±2.68)%, close to the prediction model.
L.plantarumYI-Y 2013; protectant; survival rate
公益性行业(农业)科研专项经费(编号:201303070);国家自然科学基金(编号:31771899)
樊振南,男,长沙理工大学在读硕士研究生。
易翠平(1973—),女,长沙理工大学教授,博士。
E-mail: yicp963@163.com
2017—03—07
10.13652/j.issn.1003-5788.2017.09.027
