外源性氧化胁迫对酿酒酵母突变株Y518合成谷胱甘肽的影响
2017-11-16郑丽雪王立梅
郑丽雪 - 齐 斌 孙 姜 王立梅 -
(1. 常熟理工学院生物与食品工程学院,江苏 常熟 215500;2. 中海海洋无锡海洋工程装备有限公司,江苏 无锡 214000) (1. College of Biological and Food Engineering, Changshu Institute of Technology, Changshu, Jiangsu 215500, China; 2. Wuxi Ocean Engineering Equipment Co. Ltd. of Zhonghai Ocean, Wuxi, Jiangsu 214000, China)
外源性氧化胁迫对酿酒酵母突变株Y518合成谷胱甘肽的影响
郑丽雪1ZHENGLi-xue1齐 斌1QIBin1孙 姜2SUNJiang2王立梅1WANGLi-mei1
(1. 常熟理工学院生物与食品工程学院,江苏 常熟 215500;2. 中海海洋无锡海洋工程装备有限公司,江苏 无锡 214000) (1.CollegeofBiologicalandFoodEngineering,ChangshuInstituteofTechnology,Changshu,Jiangsu215500,China; 2.WuxiOceanEngineeringEquipmentCo.Ltd.ofZhonghaiOcean,Wuxi,Jiangsu214000,China)
利用外源过氧化氢对酿酒酵母突变株Y518进行氧化胁迫来研究外源性氧化胁迫对Y518合成谷胱甘肽的影响。结果表明:添加过氧化氢会抑制Y518细胞生长,但会促进其合成谷胱甘肽;当过氧化氢的添加时间为24 h,添加量为0.6 mmol/L时,Y518胞内谷胱甘肽含量达到(13.69±0.28) mg/g,比未添加过氧化氢时提高了约14%;在24 h时添加0.6 mmol/L 过氧化氢会对Y518产生外源性氧化胁迫,激活转录调节子YAP1和SKN7调控γ-谷氨酰半胱氨酸合成酶和谷胱甘肽合成酶编码基因GSHI和GSHII的表达,提高γ-谷氨酰半胱氨酸合成酶和谷胱甘肽合成酶的活力,以促进Y518合成谷胱甘肽。因此,添加外源过氧化氢能够使酿酒酵母突变株Y518产生外源性氧化胁迫,促进Y518进一步合成谷胱甘肽。
过氧化氢;酿酒酵母;氧化胁迫;谷胱甘肽
谷胱甘肽(glutathione,GSH)是由谷氨酸、半胱氨酸和甘氨酸3种氨基酸残基组成的小分子化合物,自然界中的绝大多数动植物和微生物细胞均能够合成GSH[1-3]。作为细胞内的一种天然抗氧化活性物质,GSH能够直接与氧化性物质反应或者作为清除自由基的基质进而抵御由活性氧(reactive oxygen species,ROS)造成的氧化性损伤[4-6],因此GSH常作为天然抗氧化剂被添加到各类食品及其原料中。随着食品安全意识的不断提高,人们对食品中天然抗氧化剂的应用需求越来越强烈,因此国内外对于GSH的需求量日益增大,这其中存在的巨大商业价值推动了GSH的生产。
以酿酒酵母(Saccharomycescerevisiae)作为发酵菌株通过微生物发酵法生产GSH是目前常用的一种GSH生产方法,相比溶剂萃取法、化学合成法和酶转化法具有安全、高效、无污染和操作简便等优点[7-9]。然而,普通Saccharo-mycescerevisiae菌株的胞内GSH含量一般不足细胞干重的1%[10],因此通过各种物理、化学或者生物方法对Saccharomycescerevisiae进行处理从而提高其胞内GSH积累量已经成为研究的热点[11-13]。
在前期的研究中,本实验室通过亚硝基胍诱变筛选得到一株高产GSH的Saccharomycescerevisiae突变株Y518[14],并且通过转录组学研究发现内源性氧化胁迫能够促进Y518合成GSH[15]。本研究欲在此基础上,进一步通过添加外源过氧化氢对Y518进行氧化胁迫来研究外源性氧化胁迫对Y518合成GSH的影响,以期能够为进一步提高Y518的谷胱甘肽发酵产量提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
Saccharomycescerevisiae突变株Y518:本实验室(苏州食品生物技术重点实验室)筛选保藏。
1.1.2 试剂
GSH检测试剂盒、Cu/Zn超氧化物歧化酶(Cu/Zn-superoxide dismutase,Cu/Zn-SOD)检测试剂盒、过氧化氢酶(catalase,CAT)检测试剂盒、酵母细胞裂解液:上海碧云天生物技术有限公司;
γ-谷氨酰半胱氨酸合成酶(γ-glutamyl systeine synthetase,GSH I)检测试剂盒、GSH合成酶(GSH II)检测试剂盒:苏州科铭生物技术有限公司;
总RNA提取试剂盒、DNA酶试剂盒:德国Qiagen公司;
cDNA合成试剂盒、荧光染料试剂盒、RNA制胶试剂盒:美国Bio-Rad公司;
过氧化氢(hydrogen peroxide,H2O2):分析纯,生工生物工程(上海)股份有限公司。
1.1.3 培养基
Saccharomycescerevisiae培养基[16]:酵母膏5 g/L、葡萄糖20 g/L、磷酸二氢钾6 g/L、硫酸钾3 g/L、硫酸铵5 g/L、硫酸镁1.5 g/L,pH 6.0。
1.2 仪器与设备
酶标仪:iMark型,美国Bio-Rad公司;
RCR仪:MyCycler型,美国Bio-Rad公司;
实时荧光定量PCR仪:CFX96 Touch型,美国Bio-Rad公司;
全自动电泳仪:Experion型,美国Bio-Rad公司;
高通量组织破碎仪:TissueLyser II型,德国Qiagen公司。
1.3 方法
1.3.1 酵母发酵培养 用接种环挑取活化好的突变株Y518单菌落,接种到Saccharomycescerevisiae培养基中,于30 ℃、180 r/min摇床培养18 h,得到种子液;再将种子液以10%(体积分数)的接种量接种到Saccharomycescerevisiae培养基中,于相同条件下发酵培养64 h。
1.3.2 GSH含量和细胞干重的测定 取发酵液于4 ℃、12 000 r/min离心5 min,收集菌体细胞并用0.85%生理盐水洗涤2次后按照GSH检测试剂盒说明书的要求利用酶标仪测定GSH含量,测定结果以mg/g(以细胞干重计)表示;细胞干重于105 ℃条件下烘干测定。
1.3.3 Cu/Zn-SOD、CAT、GSH I和GSH II活力的测定
Cu/Zn-SOD、CAT、GSH I和GSH II的活力分别按照对应检测试剂盒说明书的要求在酶标仪上进行测定,测定结果以U/mg(以细胞干重计)表示。
1.3.4 酵母总RNA的提取、纯化和完整性检测 取发酵液于4 ℃、12 000 r/min离心5 min,弃去上清液,收集菌体细胞并用冷的焦碳酸二乙酯(diethy pyrocarbonate,DEPC)水洗涤2次后用液氮猝灭2 min;加入600 μL酵母细胞裂解液和适量直径0.45~0.55 mm的玻璃珠,用高通量组织破碎仪于30 Hz震荡破碎处理5 min;将裂解产物转移至新的离心管中,于4 ℃、12 000 r/min离心5 min后按照总RNA提取试剂盒和DNA酶试剂盒说明书的要求提取和纯化总RNA;根据RNA制胶试剂盒说明书的操作说明将总RNA样品注入RNA检测芯片内,利用全自动电泳仪对RNA的完整性进行检测。
1.3.5 cDNA的合成和基因相对表达量的检测 按照cDNA 合成试剂盒说明书的要求利用PCR仪将RNA反转录为cDNA,反转录反应程序为:25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min,保持4 ℃待用;按照荧光染料试剂盒说明书的要求利用实时荧光定量PCR仪测定基因的相对表达量,扩增效率采用cDNA梯度稀释法计算,相对表达倍数按照2-△△Ct法计算,参照基因为β-Actin,反应程序为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。
2 结果与分析
2.1 H2O2添加时间对GSH发酵产量的影响
分别在发酵8,16,24,32 h时添加0.4 mmol/L H2O2,并测定发酵周期64 h内Y518的生长曲线和胞内GSH含量,结果见图1。未添加H2O2时,Y518 在前16 h快速生长,16~48 h缓慢生长,48 h后逐渐下降;而在不同发酵时间添加H2O2后Y518的细胞干重均呈现出下降的趋势[图1(a)],表明添加H2O2会抑制Y518的生长,与陈珊等[17]的研究结果一致,可能是H2O2作为强氧化剂会对酵母细胞产生一定的毒害作用。未添加H2O2时,Y518的胞内GSH含量随着发酵时间的延长逐渐增加,在48 h达到最高[(12.02±0.12) mg/g],随后开始下降;而在不同发酵时间添加H2O2后,Y518的胞内GSH含量均呈现出先快速增加后缓慢降低的趋势[图1(b)],相比之下在24 h添加H2O2后Y518的胞内GSH含量在40 h达到最高[(12.98±0. 24) mg/g],表明在24 h添加H2O2较为合适。
2.2 H2O2添加量对GSH发酵产量的影响
在发酵24 h时分别添加0.2,0.4,0.6,0.8 mmol/L H2O2,并测定发酵周期64 h内Y518的生长曲线和胞内GSH含量,结果见图2。添加不同浓度H2O2后Y518的细胞干重均呈现出下降的趋势,添加0.8 mmol/L H2O2后Y518的细胞干重下降最显著,细胞生长抑制最严重[图2(a)];而随着H2O2浓度的增大,Y518的胞内GSH含量先呈现出逐渐增加的趋势,在添加0.6 mmol/L时达到最高[(13.69±0.28) mg/g],继续增大到0.8 mmol/L后GSH含量反而有所降低[图2(b)],可能是过大的H2O2浓度对酵母细胞的生长抑制较严重[图2(a)],减弱了胞内GSH的合成,表明在24 h添加0.6 mmol/L H2O2较为合适。

图1 Y518在不同H2O2添加时间下的细胞干量和胞内GSH含量Figure 1 Dry cell weight and intracellular GSH content of Y518 under different addition time of H2O2
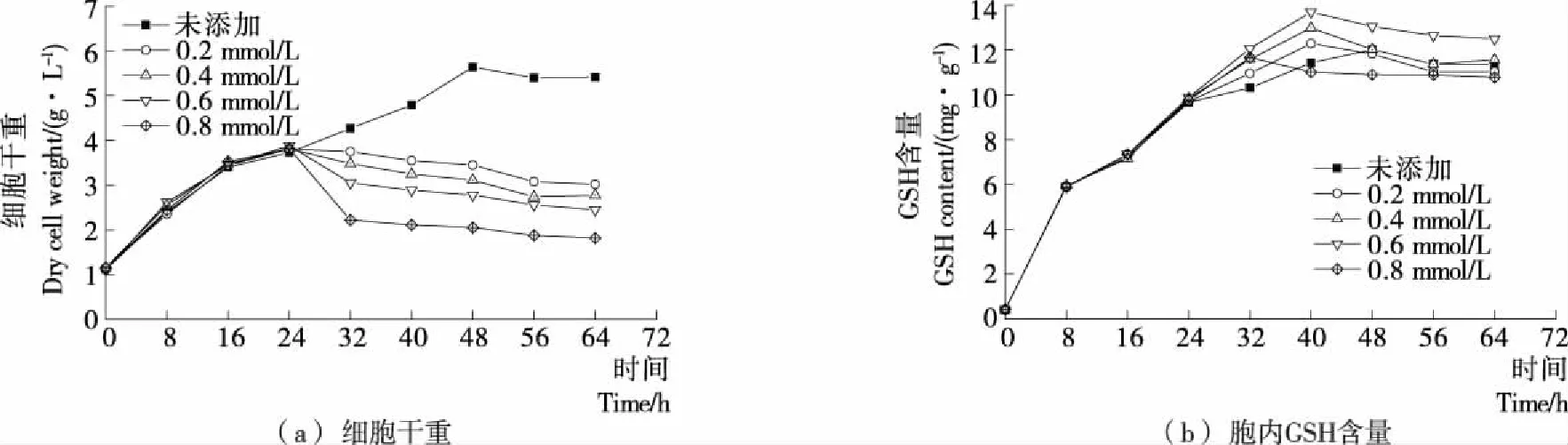
图2 Y518在不同H2O2添加量下的细胞干量和胞内GSH含量Figure 2 Dry cell weight and intracellular GSH content of Y518 under differentaddition amount of H2O2
2.3 抗氧化酶系的活力
Cu/Zn-SOD和CAT是抗氧化酶系中的2种重要的活性酶,能够在细胞遭受氧化胁迫时清除胞内过多的ROS,维持细胞氧化还原环境的平衡[18-19]。由图3可知,随着发酵时间的延长,未添加H2O2时Y518的Cu/Zn-SOD和CAT的活力变化趋势一致,均呈现出先增加后降低的趋势;而在24 h添加0.6 mmol/L H2O2后Cu/Zn-SOD和CAT的活力显著高于未添加H2O2的,表明添加H2O2对Y518的细胞产生了氧化胁迫,使Cu/Zn-SOD和CAT活力提高。
2.4 GSH合成酶系的活力
酵母细胞内GSH的合成反应是由GSH合成酶系分步催化完成的,首先谷氨酸和半胱氨酸在限速酶GSH I的催化下反应生成γ-谷氨酰半胱氨酸,进一步在GSH II的催化下γ-谷氨酰半胱氨酸和甘氨酸反应生成GSH[20-21]。由图4可知,随着发酵时间的延长,未添加H2O2时Y518的GSH I和GSH II的活力变化趋势一致,均呈现出逐渐降低的趋势;而在24 h添加0.6 mmol/L H2O2后GSH I和GSH II的活力显著高于未添加H2O2时的,表明添加H2O2对Y518细胞产生氧化胁迫使GSH I和GSH II活力提高,促进了GSH的合成。
2.5 总RNA的质量
对提取的总RNA完整性进行鉴定,结果见图5。电泳图上呈现的3条带分别为28S、18S和5S,条带清晰可见没有弥散,表明提取的总RNA完整性好,没有降解,符合后续基因相对表达量检测的质量要求。
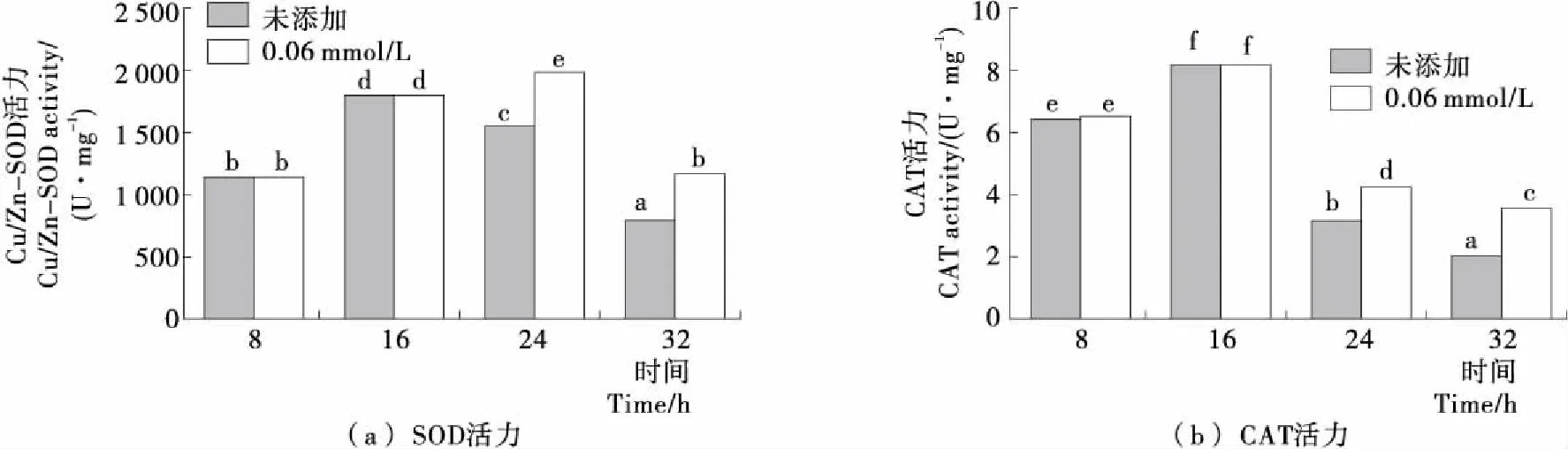
不同小写字母表示差异显著(P<0.05)图3 Y518未添加和添加0.6 mmol/L H2O2的Cu/Zn-SOD和CAT活力Figure 3 Cu/Zn-SOD activity and CAT activity of Y518 added without and with 0.6 mmol/L H2O2
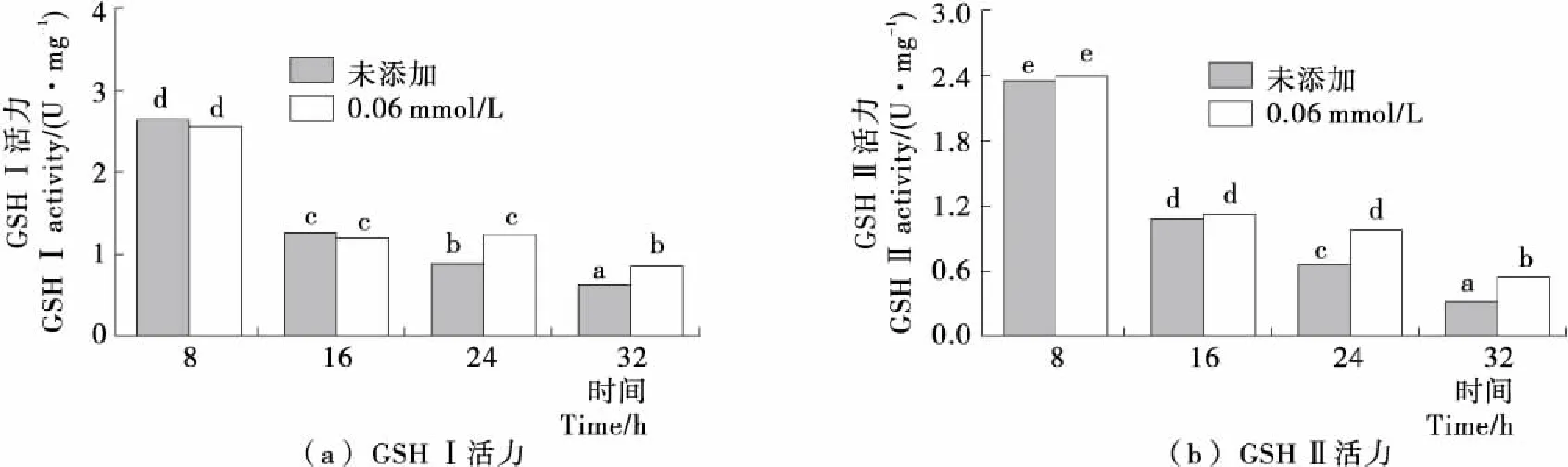
不同小写字母表示差异显著(P<0.05)图4 Y518未添加和添加0.6 mmol/L H2O2的GSH I和GSH II活力Figure 4 GSH I activity and GSH II activity of Y518 added without and with 0.6 mmol/L H2O2
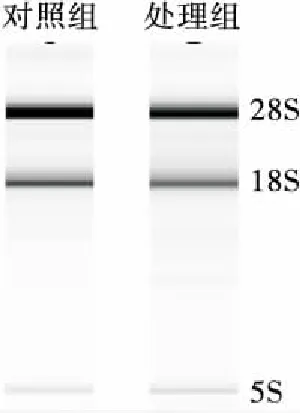
图5 Y518未添加和添加0.6 mmol/L H2O2的 总RNA电泳图
Figure 5 RNA electrophoretogram of Y518 added without and with 0.6 mmol/L H2O2
2.6 GSH合成酶系基因和转录调节子基因的相对表达量
基因GSHI和GSHII分别编码GSH I和GSH II,其表达受到转录调节子YAP1和SKN7的联合调控[22],在存在氧化胁迫的情况下,酵母细胞会激活YAP1和SKN7的表达上调GSHI和GSHII的表达量,进而增强GSH的合成[23],发酵32 h时Y518的GSHI、GSHII、YAP1和SKN7的相对表达量测定结果见表1。在24 h添加0.6 mmol/L H2O2后Y518的GSHI、GSHII、YAP1和SKN7的相对表达量均显著上调(上调倍数≥2),结果表明,添加H2O2产生氧化胁迫后激活了转录调节子YAP1和SKN7调控GSHI和GSHII的表达,促进了Y518合成GSH。

表1 Y518参与GSH合成的差异表达基因Table 1 Up or down-regulated gene expression of antioxidant activity in Y518 relative to 2-10515
3 结论
以亚硝基胍诱变筛选出的一株高产GSH的Saccharomycescerevisiae突变株Y518为研究对象,通过添加外源H2O2研究了外源性氧化胁迫对Y518合成GSH的影响。研究表明添加H2O2会抑制Y518的生长,但会促进其合成GSH;H2O2的最佳添加时间为24 h,最佳添加量为0.6 mmol/L,最佳条件下Y518胞内GSH含量达(13.69±0.28) mg/g,比未添加H2O2时提高了约14%;在24 h添加0.6 mmol/L H2O2会对Y518产生外源性氧化胁迫,激活转录调节子YAP1和SKN7,调控GSHI和GSHII的表达,进而提高GSH I和GSH II的活力,促进Y518进一步合成GSH。
[1] 陈志颖, 张子健, 焦瑞杰, 等. 利用啤酒废酵母扩培物制备富含谷胱甘肽酵母抽提物[J]. 中国酿造, 2015, 34(11): 61-65.
[2] 姚晨阳, 刘敬, 张启美, 等. 谷胱甘肽在水产养殖中的应用研究进展[J]. 山东科学, 2016, 29(1): 105-109.
[3] 郑丽雪, 谢群凡, 王立梅, 等. 不同pH值酿酒酵母分批发酵生产谷胱甘肽数学模型建立[J]. 食品科学, 2013, 34(13): 162-164.
[4] SAFONOVA O A, POPOVA T N, KRYL’SKII E D, et al. Synthesis and estimation of the influence of 2,4-Dimethoxyphenylbiguanide on the glutathione antioxidant system activity in heart and blood serum of rats with experimental rheumatoid arthritis[J]. Pharmaceutical Chemistry Journal, 2016, 49(11): 749-752.
[5] KEI H, SATOSHI F, PAWEL B, et al. Glutathione and tryptophan metabolism are required forArabidopsisimmunity during the hypersensitive response to hemibiotrophs[J]. Proceedings of the National Academy of Sciences, 2013, 110(23): 9 585-9 594.
[6] CAROLE M, CHARLOTTE J, JEAN-FRANÇOIS M, et al. The utilization of sulfur amino acid in the mercapturate pathway to detoxify maximal therapeutic dose of acetaminophen is associated with glutathione and protein homeosteny in adult rats[J]. Faseb Journal, 2013, 27(7): 295-310.
[7] 刘千, 陈黎, 胡用军, 等. 麦胚谷胱甘肽提取与含量测定方法研究[J]. 中国粮油学报, 2012, 27(10): 104-108.
[8] 李鑫. HPLC法检测酶法合成中还原型/氧化型谷胱甘肽[J]. 广东化工, 2014, 41(5): 158-159.
[9] 孙姜, 朱益波, 王立梅, 等. 原生质体诱变选育高产GSH菌株及基因表达分析[J]. 食品科学, 2013, 34(23): 176-179.
[10] PENNINCKX M J, JASPERS C J, LEGRAIN M J. The glutathione-dependent glyoxalase pathway in the yeastSaccharo-mycescerevisiae[J]. Journal of Biological Chemistry, 1983, 258(10): 6 030-6 036.
[11] 胡林华, 谭天伟. 高产谷胱甘肽酵母菌株的选育和培养条件的初探[J]. 高校化学工程学报, 2005, 19(2): 273-276.
[12] 郑丽雪, 刘梦滢, 王立梅, 等. 不同发酵时期添加金属离子对酿酒酵母合成谷胱甘肽的影响[J]. 食品研究与开发, 2014, 35(6): 93-95.
[13] 邵娜, 卫功元, 葛晓光, 等. 紫外线γ-射线复合诱变筛选S-腺苷甲硫氨酸和谷胱甘肽联产发酵菌株[J]. 辐射研究与辐射工艺学报, 2010, 28(2): 107-113.
[14] 王雅楠, 梅艳珍, 郑丽雪, 等. 高产GSH酵母突变株Y518谷胱甘肽合成酶结构分析[J]. 食品科学, 2009, 30(17): 258-261.
[15] 王立梅, 任清华, 郑丽雪, 等. 内源性氧化胁迫促进酿酒酵母合成谷胱甘肽的潜在机制分析[J]. 食品科学, 2017, 38(4): 26-31.
[16] GARRIDO E O, GRANT C M. Role of thioredoxins in the response ofSaccharomycescerevisiaeto oxidative stress induced by hydroperoxides[J]. Molecular Microbiology, 2002, 43(4): 993-1 003.
[17] 陈珊, 贺小贤, 潘亚磊. 过氧化氢和混合氨基酸对酿酒酵母发酵谷胱甘肽影响的研究[J]. 食品工业科技, 2008(11): 142-144.
[18] NEDEVA T S, PETROVA V Y, ZAMFIROVA D R, et al. Cu/Zn superoxide dismutase in yeast mitochondria-a general phenome-non[J]. FEMS Microbiology Letters, 2004, 230(1): 19-25.
[19] TANAKA T, IZAWA S, INOUE Y. GPX2, encoding a phospholipid hydroperoxide glutathione peroxidase homologue, codes for an atypical 2-Cys peroxiredoxin inSaccharomycescerevisiae[J]. Journal of Biological Chemistry, 2005, 280(51): 42 078-42 087.
[20] BLAIR I A. Analysis of endogenous glutathione-adducts and their metabolites[J]. Biomedical Chromatography, 2010, 24(1): 29-38.
[21] GRANT C M, MACIVER F H, DAWES I W. Glutathione is an essential metabolite required for resistance to oxidative stress in the yeastSaccharomycescerevisiae[J]. Current Genetics, 1996, 29(6): 511-515.
[22] LEE J, GODON C, LAGNIEL G, et al. Yap1 and Skn7 control two specialized oxidative stress response regulons in yeast[J]. Journal of Biological Chemistry, 1999, 274(23): 16 040-16 046.
[23] BROMBACHER K, FISCHER B B, RÜFENACHT K, et al. The role of Yap1p and Skn7p-mediated oxidative stress response in the defence ofSaccharomycescerevisiaeagainst singlet oxygen[J]. Yeast, 2006, 23(10): 741-750.
EffectsofexogenousoxidationstressonglutathionesynthesisinSaccharomycescerevisiaemutantY518
Effects of exogenous oxidative stress on glutathione production bySaccharomycescerevisiaemutant Y518 were researched by addition of exogenous hydrogen peroxide. The results showed that the addition of hydrogen peroxide inhibited the growth of Y518 cells, but promoted the synthesis of glutathione of Y518. The best addition time and amount of hydrogen peroxide were respectively 24 h and 0.6 mmol/L. The content of gluconate reached (13.69±0.28) mg/g, increased by about 14% compared to that without hydrogen peroxide. Exogenous oxidation stress on Y518 was produced by adding 0.6 mmol/L hydrogen peroxide at 24 h, which activated the transcription regulation factorYAP1 andSKN7 to control expressions ofγ-glutamylcysteine synthetase, then that of glutathione synthetase encoded genesGSHIandGSHII, and finally enhanced the activities ofγ-glutamylcysteine and glutathione synthetases to promote glutathione synthesis in Y518. Therefore, the addition of exogenous hydrogen peroxide could produce exogenous oxidation stress on Y518 and further promote Y518 to synthesize glutathione.
hydrogen peroxide;Saccharomycescerevisiae; oxidation stress; glutathione
郑丽雪,女,常熟理工学院高级实验师,硕士。
齐斌(1965—),男,常熟理工学院研究员,博士。
E-mail:qibin65@126.com
2017—05—12
10.13652/j.issn.1003-5788.2017.09.004
