一种简便的环糊精超分子包结比测算新方法
2017-11-16张伟锋王建辉王成峰宁静恒
张伟锋 - 罗 新 王建辉 - 王 敏 刘 龙 王成峰 - 宁静恒 -
(长沙理工大学化学与生物工程学院,湖南 长沙 410114) (School of Chemical and Biological Engineering, Changsha University of Science & Technology, Changsha, Hunan 410114, China)
一种简便的环糊精超分子包结比测算新方法
张伟锋ZHANGWei-feng罗 新LUOXin王建辉WANGJian-hui王 敏WANGMin刘 龙LIULong王成峰WANGCheng-feng宁静恒NINGJing-heng
(长沙理工大学化学与生物工程学院,湖南 长沙 410114) (SchoolofChemicalandBiologicalEngineering,ChangshaUniversityofScience&Technology,Changsha,Hunan410114,China)
利用紫外可见分光光度计,通过测定β-环糊精-山梨酸超分子包合物的紫外吸光度,提出一种新的差量法用以测算该超分子的包结比,其值与经典的摩尔比法及相溶解度法相同,均为1∶1,表明该类超分子是由1分子主体分子(β-环糊精)包结1分子客体分子(山梨酸)而成。差量法为多次测量吸光度再取平均值进行测算,其结果较摩尔比法更为准确;其测算过程,不受外界因素干扰,无需绘制相图,较相溶解度法更为简便。
包结比;差量法;环糊精;山梨酸
超分子又称主-客体化合物,是基于主客体分子间疏水、氢键等弱相互作用力所形成的分子聚集体[1]。环糊精作为一类典型的主体分子,在超分子化学领域应用极为广泛[2-4]。其中,β-环糊精(β-Cyclodextrins,β-CD),由7个葡萄糖单元环合而成,具有内腔疏水外壁亲水的特殊结构,其空腔可包合疏水性有机物形成超分子从而改变后者的理化性质[5-6]。环糊精包合物在食品工业的应用很多,如Shao等[7]利用β-环糊精包结绿原酸形成笼状超分子,可在保留原有绿原酸抗氧化性能的同时有效提高其稳定性;G. Astray等[8]发现β-环糊精可包合肉桂醛、薄荷醇和柠檬醛等,对这些常见的食品香料起到保护和缓释的作用。环糊精在食品工业中的这些应用,都基于其对客体分子的包合作用有助于对客体分子理化性能的改善。因此,探讨环糊精与客体分子之间的包合作用、包合方式、包合能力等系列机理问题,既是环糊精超分子化学研究的核心内容,也是拓宽环糊精应用必须解决的关键问题。
在超分子的包结机理研究中,包结比决定主、客体分子以何种比例进行包合,是探讨主客体分子包合方式的首要参数。常见包结比的测算方法有紫外分光光度法[9]、荧光光谱法[10]、核磁共振谱法[11]、差示扫描量热法[12]及单晶X射线衍射法等[13-14]。其中,荧光光谱法易受其他离子干扰,核磁共振法样品纯度要求极高,差示扫描量热法检测时间长,单晶X射线衍射法不易制样且谱图解析难度大,此外,上述包结比的测算方法所需仪器都较昂贵,不便广泛开展。
基于此,利用常见的紫外可见分光光度计,以实验室自制的β-环糊精-山梨酸包合物为例,提出一种新的测算包结比的方法——差量法。该法首先确定β-环糊精-山梨酸包合物的总质量,利用紫外可见光光度计,测定此质量下β-环糊精-山梨酸包合物的吸光度值,依据紫外工作曲线计算包合物中山梨酸的质量,则主体分子β-环糊精的质量可由差量法计算确定(包合物总质量减去山梨酸质量),由此可得主客体分子的摩尔比亦即包合物的包结比。这一新的包结比测算方法,因其关键的吸光度数据是在多次测定后再取平均值,所以其计算结果将较经典的摩尔比法准确;同时其测算过程无需绘制复杂相图,因此较经典的相溶解度法将要简便得多。应用新的差量法对β-环糊精与山梨酸的包结比进行研究,有利于为深入研究此类超分子的包结机理提供新的简便方法或途径。
1 材料与方法
1.1 仪器与试剂
紫外可见分光光度计:TU-1901型,北京普析通用公司;
β-环糊精:分析纯,上海强顺化学试剂有限公司;
山梨酸和无水乙醇:分析纯,国药集团化学试剂有限公司;
去离子水:实验室自制;
其他试剂:均为分析纯。
1.2 试验过程
1.2.1 包合物的制备 参照文献[15]方法进行改进。准确称取精制的β-环糊精1.135 0 g(0.001 0 mol)和山梨酸0.246 7 g(0.002 2 mol),分别溶于40 mL去离子水和2.5 mL 无水乙醇中,将溶液混合,一定温度下超声一定时长使之反应完全,保温5 min后趁热过滤,滤液自然冷却至室温再静置,3 d后即可获得较好晶体。
1.2.2 确认紫外测量波长 参照文献[16]的方法进行改进。准确称取山梨酸0.010 0 g(0.089 2 mmol),用少量无水乙醇溶解,转移至100 mL容量瓶中定容,无水乙醇定容并摇匀,作为标准液备用。移取适量的标准液,置于25 mL容量瓶中,无水乙醇定容,以无水乙醇为参比,采用紫外可见分光光度计进行测试,在200~400 nm内扫描,确认其最大吸收波长λmax。
1.2.3 绘制工作曲线 参照文献[17]的方法进行改进。准确移取适量标准液,置于25 mL容量瓶中,加无水乙醇定容,以无水乙醇为参比,在最大吸收波长处测量吸光度,以吸光度值(A)为横坐标、浓度(C)为纵坐标作图,绘制山梨酸的工作曲线。
1.2.4 待测样品的测定 准确移取适量待测液,置于25 mL容量瓶中,加无水乙醇定容,以无水乙醇为参比,在最大吸收波长处测量吸光度,用标准工作曲线计算待测样浓度。
2 结果与讨论
2.1 最大吸收波长λmax
图1为山梨酸在波长200~400 nm处的紫外吸收曲线。由图1可知,在255 nm处吸收最强,因此最大吸收波长λmax=255 nm,即为后续试验中采用的紫外测量波长。
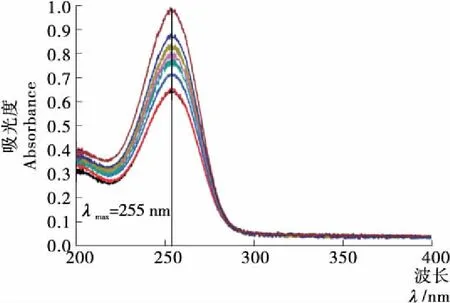
图1 山梨酸紫外光谱Figure 1 UV-vis spectraof sorbic acid
2.2 工作曲线的绘制
图2为山梨酸在最大吸收波长λmax=255 nm处的工作曲线。由图2可得,吸光度值与山梨酸浓度呈良好的线性关系。其线性回归方程式为:A=1.083×105C+0.174 6,R2=0.998 5。
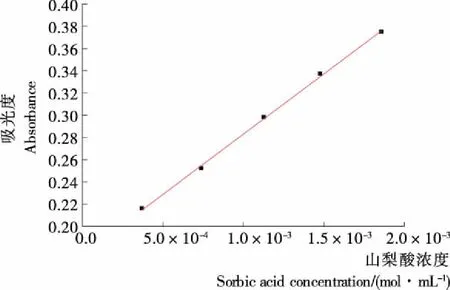
图2 山梨酸的紫外工作曲线Figure 2 UV-viscalibration curve of sorbic acid
2.3 包结比的测算方法比较
2.3.1 差量法 利用紫外可见分光光度计,通过测定β-环糊精-山梨酸超分子包合物的紫外吸光度值,提出一种新的测算包结比方法——差量法。首先准确称量β-环糊精-山梨酸超分子包合物的总质量,利用紫外可见分光光度计,测定此质量下包合物中山梨酸的质量。根据差量法,得β-环糊精的质量(包合物总质量减去山梨酸质量),进而计算出主客体分子的摩尔数之比,即为包合物的包结比。
以实验室自制的β-环糊精-山梨酸包合物为例,差量法测算包合物包结比过程:
若β-环糊精-山梨酸包合物的总质量为m包(g),定容后溶液体积为V定(mL),在λmax=255 nm处的吸光度值为A包,由于包合物中的主体分子环糊精无紫外吸收,可得A包=A山梨酸(山梨酸紫外吸光度值),代入上述线性回归方程式中,得:
A包=1.083×105C山梨酸+0.174 6,R2=0.998 5。
(1)
由式(1)求得包合物中山梨酸摩尔浓度C山梨酸(mol/mL)为:

(2)
由式(2)可得包合物中山梨酸质量为:
m山梨酸=C山梨酸V定M山梨酸。
(3)
则包合物中β-环糊精质量为:
mβ-环糊精=m包-m山梨酸。
(4)
已知β-环糊精分子量为Mβ-环糊精,可得包合物中β-环糊精的摩尔数为:

(5)
同样地,由山梨酸分子量M山梨酸可得包合物中山梨酸的摩尔数为:

(6)
由式(5)、(6)可知包结比R为:

(7)
将式(4)代入式(7),可得:
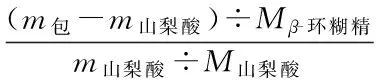
(8)
将式(2)、(3)代入式(8)可得:
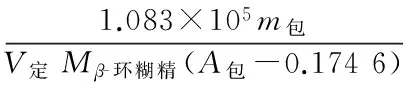
(9)
将M山梨酸=112.13,Mβ-环糊精=1 135代入式(9),可得包结比的计算公式为:

(10)
式中:
R——包结比;
m包——包合物的质量,g;
V定——包合物溶液定容体积,mL;
A包——包合物吸光度。
由于m包和V定均为定值,所以由方程(10)可知,只要采用紫外分光光度计测定包合物的A包,即可算出其包结比。例如,分别准确称量(m包)0.002 0,0.006 0,0.010 0 gβ-环糊精-山梨酸超分子包合物,置于50 mL容量瓶中,用去离子水定容,即V定=50 mL,在λmax=255 nm处测得吸光度A包,测量3次取平均值,按上述方法根据式(10)计算包结比,结果见表1。
由表1可知:多次测算包结比的结果均为1∶1,表明1分子β-环糊精与1分子山梨酸包结形成了超分子包合物。显然,当采用差量法确定其包结比时,可准确称取一定质量的包合物(m包)配置一定体积的溶液(V定),然后只需采用紫外分光光度计测定溶液的吸光度值(A包),并经多次测量取其平均值,即可由式(10)方便且准确地计算出包结比。
2.3.2 经典方法测算包合物包结比
(1) 摩尔比法:摩尔比法[18]也是采用紫外分光光度法测算包合物包结比的一种方法。其原理是固定一个组分的浓度和体积不变,改变另一组分的体积即改变其测试浓度,在最大吸收波长处测定吸光度值,以摩尔比(即环糊精溶液与山梨酸溶液的体积比)为横坐标、吸光度值为纵坐标作图,图中曲线转折点对应的摩尔比(体积比),即为该包合物的包结比。
表1差量法测算β-环糊精-山梨酸的包结比†
Table 1 Determination of the inclusion ratio ofβ-cyclodextrin-sorbic acid by subtraction method

测量组数包合物总质量m包/g吸光度A包A包平均值包结比10.00200.17820.00200.1760.1781︰130.00200.17940.00600.18350.00600.1860.1851︰160.00600.18570.01000.19080.01000.1890.1901︰190.01000.191
†V定均为50 mL。
图3为β-环糊精与山梨酸溶液吸光度值随摩尔比(体积比)变化曲线。β-环糊精水溶液的浓度为1×10-9mol/mL,山梨酸乙醇溶液的浓度为1×10-9mol/mL,山梨酸溶液体积为10 mL,β-环糊精体积分别为2,5,10,12,15,20 mL,在λmax=255 nm处分别测定,吸光度值,即可作图3。由图3可知,当β-环糊精与山梨酸摩尔比(体积比)为1∶1时,吸光度值发生明显的变化,由此可以判定β-环糊精与山梨酸的包结比为1∶1,虽然摩尔比法比差量法简便,但溶液长时间暴露在空气中,易氧化变质,其计算结果的准确性低于多次取平均值的差量法。
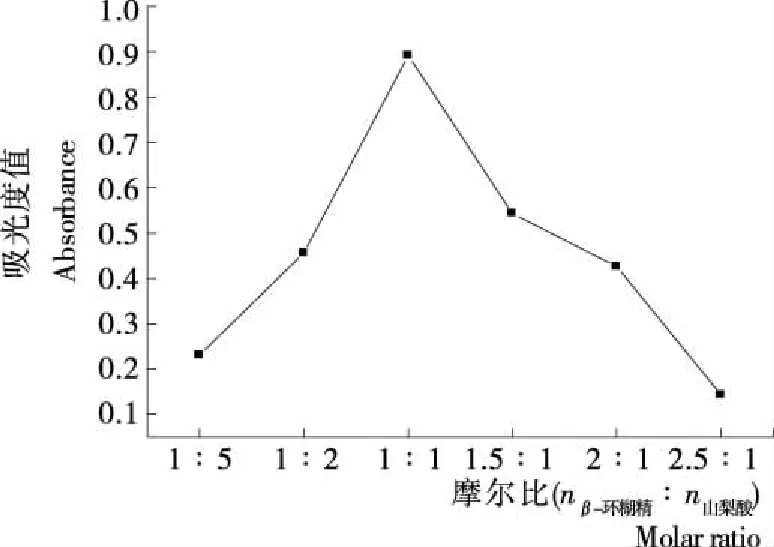
图3 吸光度与摩尔比的关系变化图Figure 3 The relationship between the absorbance and the molar ratio
(2) 相溶解度法:相溶解度法[19]是用于包合物包结机理研究的经典方法,在测定包合常数的同时能获得客体分子包合后溶解度行为的改变,继而推断出主客体分子的包结比。
图4为包合物的相溶解度图。如图 4所示,根据Higuchi等[19]研究表明,超分子包合物相溶解等、温线有5种类型,AP、AL、AN、BS和BL。其中,AL类型随主体分子浓度增加,客体分子溶解度呈线性增加,表明形成包结比为1∶1的包合物;AP类型包合物的溶解度较大;AN类型包结行较为复杂;BS类型为客体分子溶解度先随主体分子浓度的增大而增大,而后逐渐析出包合物结晶;BL类型表明形成包合物后,溶解度开始下降。采用相溶解度法绘制β-环糊精-山梨酸包合物的相溶解度图,随着β-环糊精浓度的增加,山梨酸溶解度增加,二者呈线性关系,其相溶解度图属AL型,表明β-环糊精与山梨酸形成包结比为1∶1的包合物。相溶解度法虽然在测算包结比的同时可计算包合常数,但易受外界因素(如温度)干扰,作图方法复杂,计算过程较差量法繁琐。

SO为无主体分子时客体的溶解度;ST为溶解客体分子的浓度;SC为溶解性差包合物的极限溶解度
图4 相溶解度图
Figure 4 Phase solubility isotherm types
3 结论
(1) 采用差量法成功测算了β-环糊精-山梨酸超分子包合物的包结比。此方法同经典的摩尔法及相溶解度法相比,所得包结比均为1∶1,说明1分子β-环糊精包结1分子山梨酸形成了超分子包合物。
(2) 差量法为本研究提出的一种新的、简便的包结比测算方法。只需利用紫外可见分光光度计,测定一定质量下包合物的吸光度值,根据客体分子工作曲线计算出该质量下包合物中客体分子的质量,根据差量法,得主体分子的质量(包合物质量减去客体分子质量),进而计算出主客体分子的摩尔数之比,即为包合物的包结比。此方法同经典的摩尔法及相溶解度法相比,较前者准确,较后者简单,为超分子包结比的确定提供一种新的简便且准确的计算方法。
[1] SZEJTLI J. Introduction and general overview of cyclodextrin chemistry[J]. Chemical Reviews, 1998, 98(5): 1 743-1 753.
[2] VALLE E M M. Cyclodextrin their uses: A review[J]. Process Biochemistry, 2004, 39(9): 1 033-1 046.
[3] DAVIS M E, BREWSTER M E. Cyclodextrin-based pharmaceutics: Past, present and future[J]. Dressnature Reviews Drug Discovery, 2004, 3(12): 1 023-1 035.
[4] NING Jing-heng, WANG Yu-fang, WU Qi, et al. Novel supramolecular assemblies of repulsive DNA-anionic porphyrin complexes based on covalently modified multi-walled carbon nanotubes and cyclodextrins[J]. RSC Advances, 2015, 5(27): 21 153-21 160.
[5] LAKKAKULA J R, MAÇEDO KRAUSE R W. A vision for cyclodextrin nanoparticles in drug delivery systems and pharmaceutical applications[J]. Nanomedicine, 2014, 9(6): 877-896.
[6] DENG Jie, LIU Xin-yue, MA Lang, et al. Heparin-mimicking multilayer coating on polymeric membrane via LbL assembly of cyclodextrin-based supramolecules[J]. Applied Materials & Interfaces, 2017, 6(23): 21 603-21 614.
[7] SHAO Ping, ZHANG Jia-feng, FANG Zhong-xian, et al. Complexing of chlorogenic acid withβ-cyclodextrins: Inclusion effects, antioxidative properties and potential application in grape juice[J]. Food Hydrocolloids, 2014, 41(6): 132-139.
[8] ASTRAY G, MEJUTO J C, MORALES J, et al. Factors controlling flavors binding constants to cyclodextrins and their applications in foods[J]. Food Research International, 2010, 43(4): 1 212-1 218.
[9] DANIEL K, BRINKER U H. Induced circular dichroism and UV-vis absorption spectroscopy of cyclodextrin inclusion complexes: Structural elucidation of supramolecular azi-adamantane (spiro[adamantane-2,3-diazirine])[J]. Journal of the American Chemical Society, 1998, 120(45): 11 627-11 632.
[10] AICART E, JUNQUERA E. Complex formation between purine derivatives and cyclodextrins: A fluorescence spectroscopy study[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2003, 47(3): 161-165.
[11] SCHNEIDER H, FRANK HACKET A, RÜDIGER V, et al. NMR studies of cyclodextrins and cyclodextrin complexes[J]. Chemical Reviews, 1998, 98(5): 1 755-1 786.
[12] FICARRA R, TOMMASINI S, RANERI D, et al. Study of flavonoids/β-cyclodextrins inclusion complexes by NMR, FT-IR, DSC, X-ray investigation[J]. Journal of Pharmaceutical & Biomedical Analysis, 2002, 29(6): 1 005-1 014.
[13] AIGNER Z, BERKESI O, FARKAS G, et al. DSC, X-ray and FTIR studies of a gemfibrozil/dimethyl-β-cyclodextrin inclusion complex produced by co-grinding[J]. Journal of Pharmaceutical & Biomedical Analysis, 2012, 57: 62-67.
[13] 刘彦利. 三种β-环糊精包结物的表征和晶体结构解析[D]. 天津: 天津大学, 2009: 58-64.
[15] 张清峰, 姜子涛, 占豪, 等. 紫外分光光度法研究β-环糊精与甲基橙的包结行为[J]. 光谱实验室, 2005, 22(5): 1 074-1 078.
[16] 罗见春, 陈学梁, 张景勍. 紫外分光光度法测定紫杉醇羟丙基-β-环糊精包合物的包合率[J]. 激光杂志, 2014(6): 66-67.
[17] 耿庆霞. 以瓜环为主体的超分子探针对金属离子的识别作用[D]. 贵阳: 贵州大学, 2016: 32-35.
[18] 李向军, 连军. 相溶解度法研究芦荟大黄素和环糊精及其衍生物的包结作用[J]. 分析科学学报, 1999(5): 368-371.
[19] HIGUCHI T, CONNORS K A. Phase solubility techniques[J]. Advances in Analytical Chemistry and Instrumentation, 1965(4): 117-212.
Anewandsimplemethodforcalculatingtheinclusionratioofcyclodextrinsupramolecules
Based on UV absorbance, a new and simple subtraction method was proposed for the calculation of the inclusion ratio, and it was proved to be equal in number to the classical molar ratio or phase solubility method. Using any kind of these three methods, the results always showed that the inclusion ratio of this complex was 1∶1, which indicated that this kind of supramolecular complex was formed through an inclusion interaction between 1 host molecule (β-cyclodextrin) and 1 guest molecule (sorbic acid). Sincethe subtraction methodadopted a repetitive measurement and took the averaged, its result was more accurate than the molar ratio method; meanwhile, due to the advantage of less interference factors and especiallyno need of drawing a complicated phase diagram, its calculation process was much simpler than the phase solubility method.
inclusion ratio; subtraction method; cyclodextrins; sorbicacid
国家自然科学基金(编号:21505005);湖南省自然科学基金项目(编号:2015JJ2011);湖南省教育厅项目(编号:15C0023);湖南省电力与交通材料保护省重点实验室开放基金(编号:2017CL07);湖南省大学生研究性学习和创新性实验计划(编号:湘教通〔2016〕202号)
张伟锋,男,长沙理工大学在读硕士研究生。
宁静恒(1975—),女,长沙理工大学副教授,博士。
E-mail: ningjingheng@126.com
2017—05—07
10.13652/j.issn.1003-5788.2017.09.002
