制备型快速柱层析检测煎炸油极性组分含量
2017-11-16曹文明印瑜洁
薛 斌 曹文明 - 印瑜洁 -
(1. 贝雷〔上海〕生物科技有限公司,上海 201203;2. 丰益〔上海〕生物技术研发中心有限公司,上海 200137;3. 上海市粮食科学研究所,上海 200333) (1. Beilei〔Shanghai〕 Biotechnology Co., Ltd, Shanghai 201203, China; 2. Wilmar 〔Shanghai〕 Biotechnology Research & Development Center Co., Ltd., Shanghai 200137, China; 3. Shanghai Grain Science Research Institute, Shanghai 200333, China)
制备型快速柱层析检测煎炸油极性组分含量
薛 斌1XUEBin1曹文明2CAOWen-ming2印瑜洁3YINYu-jie3
(1. 贝雷〔上海〕生物科技有限公司,上海 201203;2. 丰益〔上海〕生物技术研发中心有限公司,上海 200137;3. 上海市粮食科学研究所,上海 200333) (1.Beilei〔Shanghai〕BiotechnologyCo.,Ltd,Shanghai201203,China; 2.Wilmar〔Shanghai〕BiotechnologyResearch&DevelopmentCenterCo.,Ltd.,Shanghai200137,China; 3.ShanghaiGrainScienceResearchInstitute,Shanghai200333,China)
采用制备型快速柱层析,建立快速分离制备并检测煎炸油中极性组分含量的技术。利用油脂极性组分专用中压制备液相色谱技术,用专用的商品化FLASH柱为分离制备色谱柱,以体积比87∶13的石油醚—乙醚为洗脱液,洗脱液流速25 mL/min,发现当非极性组分洗脱11 min时,恰好能实现煎炸油中极性与非极性组分的分离,且分离速度快,仅需41 min,检测重复性RSD<5%,均优于传统人工柱层析技术,与传统人工柱层析技术的相比,其相对偏差也<±6%,表明基本一致。
制备型快速柱层析;极性组分;非极性组分;煎炸油
油脂的极性组分指食用油脂的主要成分甘油三酯发生氧化或降解后产生的各种极性较强的脂质化合物的统称[1-2]。它是食用油在煎炸食品工艺条件下发生热氧化反应、热聚合反应、热氧化聚合反应、热裂解反应和水解反应,产生的比正常植物油分子(甘油三酯)极性大的成分,其中分解产生的丙烯酞胺、 多环芳烃类为致癌物[3]。极性组分的含量是目前国内外评价食用油脂在煎炸过程中劣变程度的重要指标[4-5]。许多国家把煎炸油中的极性组分含量(24%~27%)作为法定界限,超过一定限值的油脂必须废弃[6]。
国内外检测油脂中极性组分含量的传统方法是硅胶玻璃柱层析技术[7]1-8[8],该技术完全依靠人工操作,不仅费时(120 min),而且精密度和准确性较差[3]。所以,对于煎炸油极性组分含量的快速检测技术,一直是研究的重点。当前, 极性组分快速检测技术主要有介电常数法、近红外色谱法、图像分析技术、核磁共振法等[3,9-10]。但这些快速检测方法对油脂极性组分测定的原理尚不明确,目前一般只能作为现场快速初筛方法,尚不能作为实验室的仲裁检测方法,来取代传统的硅胶玻璃柱层析技术。为此,本研究拟采用制备型快速柱层析技术(又称为中压制备色谱技术)建立煎炸油极性组分的快速检测技术。
1 材料与方法
1.1 材料与试剂
乙醚、石油醚(沸程30~60 ℃)、丙酮、三氯甲烷、冰醋酸、95%乙醇、磷钼酸:分析纯,国药集团上海化学试剂有限公司;
海沙:化学纯,国药集团上海化学试剂有限公司;
硅胶60薄层层析板:默克化工技术(上海)有限公司;
FLASH柱:EOPC20型,博纳艾杰尔科技有限公司;
煎炸油脂样品:由实验室用大豆油、玉米油等植物油在200 ℃左右煎炸10~50 h获得。
1.2 仪器与设备
中压制备液相色谱系统(EOPC系统):EOPC型,配套30 mL玻璃收集管及1 000 mL小口玻璃收集瓶,博纳艾杰尔科技有限公司;
旋转蒸发仪:RE-52A型,上海亚荣生化仪器厂;
分析天平:BSA224S型,精度0.000 1 g,赛多利斯公司;
真空恒温干燥箱:YZF-6020型,上海姚氏仪器设备厂。
1.3 方法
1.3.1 煎炸油样品的制备 取煎炸油脂样品按照文献[11]方法进行除杂质和脱水处理。
1.3.2 非极性组分洗脱体积的研究 以非极性组分洗脱液(石油醚与乙醚体积比87∶13)为流动相,以25 mL/min的流速对EOPC系统的流动相管路进行润洗,然后取1支EOPC20型FLASH柱,连接入EOPC系统的流动相管路,以同样的非极性组分洗脱液为流动相,25 mL/min的流速润洗EOPC专用FLASH柱10 min,弃去润洗液。
称取1 g煎炸油样品用5 mL石油醚溶解后,用10 mL的一次性塑料注射器吸取,并快速注射入EOPC20型FLASH柱的入口处,然后以非极性组分洗脱液为流动相,25 mL/min 的流速对其进行洗脱,同时启动EOPC系统的自动部分收集器,将每1 min流出的洗脱液收集于1个试管内,共洗脱12 min。通过EOPC系统的紫外检测器,获得200 nm 波长的洗脱色谱图。同时,将EOPC系统的溶剂温度设定为10 ℃。洗脱结束后,将非极性组分洗脱液分别倒入12个相应的、已预先中恒重的平底烧瓶。并逐个置于60 ℃水浴中旋转蒸发至近干,再置于45 ℃、-0.1 MPa下彻底烘干后,于干燥器内冷却至室温,称重。所得每个平底烧瓶的质量减去先前相应空白平底烧瓶的质量,即为其所对应的非极性组分的质量。
1.3.3 极性组分的洗脱和收集 在非极性组分洗脱结束后,立即改用极性组分洗脱液(丙酮与乙醚体积比4∶6)进行洗脱,洗脱时间20 min,其它洗脱条件同“1.3.2”。全部洗脱液收集于1 000 mL小口玻璃收集瓶内,旋转蒸发和真空干燥操作同1.3.2,获得煎炸油样品的极性组分。
1.3.4 分离效果薄层色谱的验证 将1.3.2中获得的所有非极性组分合并为油脂的非极性组分,按照文献[7]6中方法,对其进行薄层色谱的验证。
2 结果与分析
2.1 非极性组分洗脱时间的确定
由图1可知,非极性组分需11 min才能充分地洗脱,其中大部分的非极性组分在6 min内都已洗脱,但在6~11 min时,仍有少量的非极性组分洗脱,虽然量很小,但会使最终的薄层色谱验证时产生如图3(b)所示的不合格分离结果。所以,为了保障非极性组分充分的洗脱,将非极性组分洗脱时间定为11 min。

图1 非极性组分洗脱时间-洗脱质量关系曲线图Figure 1 Curve of relation between elution time & elution mass during non-PCs elution
对比图1、2,发现二者的曲线十分相似,说明以200 nm为检测波长时,非极性组分洗脱的紫外色谱图可反映非极性组分的质量洗脱情况。
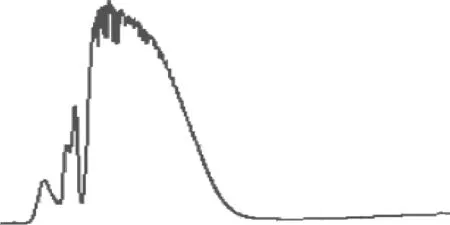
图2 制备型快速柱层析洗脱非极性组分的200 nm 波长色谱图
Figure 2 Chromatogram of non-polar compounds in 200 nm eluted by preparative FLASH chromatography
2.2 分离效果薄层色谱验证的结果
按照文献[7]6中的相关技术要求,采用薄层色谱技术对分离获得的非极性组分和极性组分的准确性和有效性进行验证。发现当非极性组分的洗脱时间为11 min时,分离成功,获得的油脂非极性组分和极性组分的薄层色谱见图3(a)。若非极性组分洗脱时间缩短,就会出现图3(b)的情况,表明对油脂的非极性组分的洗脱不够,有少量的非极性组分与后续的极性组分共洗脱,使极性组分的测定值偏高。若非极性洗脱时间延长,则获得薄层色谱图会出现图3(c)的情况,表明有少量的极性较弱的组分随着非极性组分一同被洗脱,使极性组分的测定值偏低。所以最佳的洗脱时间为11 min。

1. 非极性组分 2. 极性组分图3 油脂极性组分和非极性组分薄层色谱图Figure 3 Thin-layer chromatogram of polar compounds and non-polar compounds
2.3 制备型快速柱层析法与传统人工柱层析法测定结果的比对
取8个极性组分含量不同的煎炸油脂样品,以传统人工柱层析法[7]1-8的检测结果为基准,计算制备型快速柱层析法检测值的相对偏差,结果见表1。
表1制备型快速柱层析法与人工柱层析法测定煎炸油脂极性组分含量结果的比对
Table 1 Comparison of preparative FLASH chromatogra-phy and traditional column chromatography for detecting PCs in frying oils %
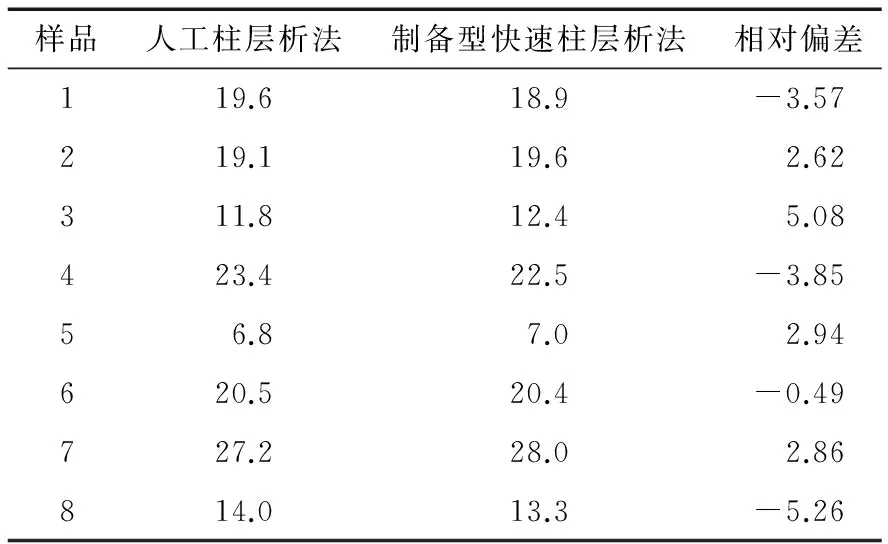
由表1可知,与传统人工柱层析法相比,制备型快速柱层析法的煎炸油极性组分含量检测值的相对偏差均小于±6%,表明这2种方法的检测结果基本一致。
2.4 制备型快速柱层析法与传统人工柱层析法测定结果重复性的比较
取3个极性组分含量不同的煎炸油样品,分别采用传统人工柱层析法和制备型快速柱层析法进行测定,进行5次平行试验,结果见表2、3。

表2 制备型快速柱层析法的重复性数据Table 2 Repeatability of preparative FLASH chromatography %
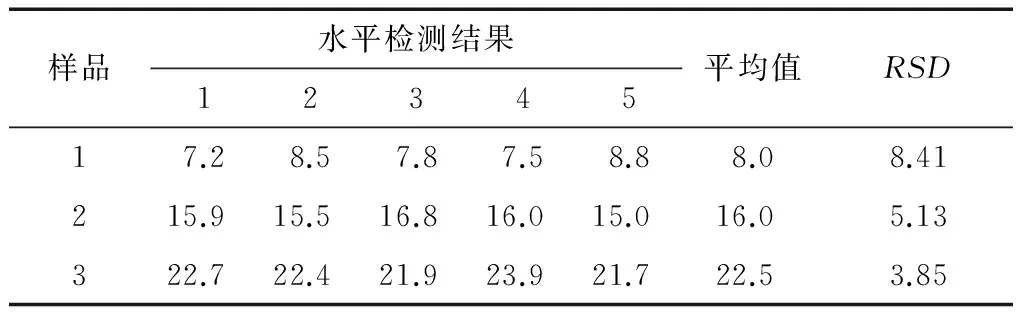
表3 人工柱层析法的重复性数据Table 3 Repeatability of traditional column chromatography %
由表2、3可知,对于相同的极性组分含量水平的煎炸油,制备型快速柱层析法检测结果的重复性要明显优于传统的人工柱层析法,其重复性RSD<5%。
3 结论
采用制备型快速柱层析技术,以体积比为87∶13的石油醚—乙醚为非极性组分洗脱液,流速25 mL/min,以EOPC专用FLASH柱为分离色谱柱,通过试验优化,确定分离煎炸油中非极性组分最佳的洗脱时间为11 min,实现了在40 min左右对油脂中极性组分和非极性组分的快速分离,建立了制备型快速柱层析检测油脂中极性组分含量的方法。
与传统的硅胶玻璃柱层析技术相比,采用制备型快速柱层析技术来分离检测煎炸油的极性组分含量,不仅时间短(仅需41 min),还实现了极性组分的自动化分离,提高了检测的精密度和准确性,更为重要的是,其对极性组分的分离检测整理与传统的硅胶玻璃柱层析技术的基本相同,完全可取代传统的硅胶玻璃柱层析技术,作为实验室快速检测煎炸油极性组分含量的仲裁方法。
[1] 印瑜洁, 薛斌. 硅胶柱层析分离煎炸油中极性和非极性组分的研究[J]. 粮食与油脂, 2016, 29(6): 72-74.
[2] CAO Wen-ming , ZHANG Kang-yi, XUE Bin, et al. Determination of oxidized triacylglycerol polymers by preparative flash chromatography and high-performance size-exclusion chromatography[J]. Asian Journal of Chemistry, 2013, 25(16): 9 189-9 149.
[3] 李浩南, 邹勇, 张彩, 等. 煎炸油脂中极性组分检测方法[J]. 粮食与油脂, 2006(5): 18-21.
[4] 李阳, 钟海雁, 李晓燕, 等. 煎炸用油品质变化及测定方法研究进展[J]. 食品与机械, 2008, 24(6): 148-151.
[5] 马玉亭, 侯利霞, 刘玉兰, 等. 玉米油在油条煎炸过程中的品质变化[J]. 食品与机械, 2016, 32(2): 16-19.
[6] SAGUY I S, DANA D. Integrated approach to deep fat frying: engineering, nutrition, health and consumer aspects[J]. Journal of Food Engineering, 2003, 56: 143-152.
[7] International Standard Organization. ISO 8420(2002) Animal and vegetable fats and oils Determination of content of polar compounds[S]. Switzerland: ISO Press, 2002.
[8] 中华人民共和国卫生部, 中国国家标准化委员会. GB/T 5009.202—2003 食用植物油煎炸过程中的极性组分(PC)的测定[S]. 北京: 中国标准出版社, 2003: 587-600.
[9] 李徐, 刘睿杰, 金青哲, 等. 介电常数在煎炸油极性组分快速检测中的应用[J]. 食品安全质量检测学报, 2014, 5(7): 1 918-1 922.
[10] 陈秀梅, 于修烛, 王亚鸽, 等. 基于近红外光谱的煎炸油极性组分定量分析模型构建[J]. 食品科学, 2014, 35(2): 238-242.
[11] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化委员会. GB/T 15687—2008 动植物油脂 试样的制备[S]. 北京: 中国标准出版社, 2008: 1-2.
DetectthecontentofpolarcomponentsinfryingoilsbypreparativeFLASHchromatography
A fast method of separating and detecting the polar compounds in frying oils by preparative FLASH chromatography was established in this study. Applying the EOPC type medium pressure liquid preparative chromatography system as hardware platform and EOPC-specified FLASH column as separation & preparation column, petroleum ether∶diethyl ether(87∶13) as elution solvent, 25 min/min as flow speed, we found polar components(PCs) and non-polar components(non-PCs) in frying oils could be separated properly when elution time of non-PCs was 11min. Separation speed was fast, as the time took by preparative FLASH chromatography was only 41 min, repeatability RSDs of preparative FLASH chromatography were no more than 5%, which were both better than that of traditional manual column chromatography. The results acquired by preparative FLASH chromatography were almost equal to those acquired by traditional manual column chromatography, as their relative deviations were within ±6% according to the results acquired by traditional manual column chromatography.
preparative FLASH chromatography; polar components(PCs); non-polar components(non-PCs); frying oils
薛斌(1981—),男,贝雷(上海)生物科技有限公司高级工程师,本科。E-mail:xuebin250@163.com
2017—06—03
10.13652/j.issn.1003-5788.2017.09.016
