DSC和同步辐射宽角XRD法研究丹皮酚在脂质体疏水尾链区的包封位置及对膜流动性的影响
2017-11-16魏田田郭皓月周洪伟邬瑞光
魏田田,郭皓月,周洪伟,邬瑞光*
(1.北京中医药大学中药学院,北京 100102;2.清华大学化学系,生命有机磷化学与化学生物学教育部重点实验室,北京 100084;3.中国中医科学院,中医临床基础医学研究所,北京 100700)
中药研究
DSC和同步辐射宽角XRD法研究丹皮酚在脂质体疏水尾链区的包封位置及对膜流动性的影响
魏田田1,郭皓月2,周洪伟3,邬瑞光1*
(1.北京中医药大学中药学院,北京 100102;2.清华大学化学系,生命有机磷化学与化学生物学教育部重点实验室,北京 100084;3.中国中医科学院,中医临床基础医学研究所,北京 100700)
目的:研究丹皮酚在脂质体疏水尾链区的包封位置及对膜流动性的影响,进而探讨其抗氧化作用机制。方法:薄膜分散法制备丹皮酚脂质体,采用差示扫描量热法(DSC)研究丹皮酚对脂质体膜主相变的影响,进而探讨丹皮酚在脂质体疏水尾链的包封位置,采用同步辐射宽角X光衍射法(XRD)研究丹皮酚对液晶态的脂质体膜疏水尾链间距的影响,进而探讨其对膜流动性的影响及与抗氧化作用机制的关联。结果:DSC结果表明,随着丹皮酚浓度的增大,脂质体的主相变温度逐渐降低,半峰宽逐渐增大,同步辐射宽角X光衍射结果表明与液晶态的空白脂质体相比,丹皮酚的包封增大了磷脂分子疏水尾链之间的距离。结论:丹皮酚分子主要作用在磷脂分子疏水尾链的C1~C9的位置;丹皮酚的包封可以增加液晶态膜尾链的无序度,从而提高膜的流动性,这是其发挥抗氧化作用可能的作用机制。
差示扫描量热;同步辐射宽角X光衍射;丹皮酚;脂质体;包封位置;膜流动性;抗氧化
丹皮酚(结构式见图1)又称牡丹酚,是中药牡丹皮和徐长卿的主要活性成分,其药理活性广泛,临床多用于心、脑血管、肿瘤、炎症、变态反应和免疫系统等疾病[1]。但丹皮酚在水中溶解度很低且易挥发,见光易氧化分解,在临床应用中受到制约[2],将其制成脂质体不仅可以提高丹皮酚的生物利用度,还可以提高其靶向性,增强疗效。
脂质体是脂质分子分散在水中自组装形成的囊泡,主要组成成分是磷脂,脂质体膜中常用的磷脂是二棕榈酰磷脂酰胆碱(DPPC,结构式见图1),磷脂双分子层构成了细胞膜的基本支架,因此,脂质体可以用作生物膜的模型膜[3]。Nunes[4]等以脂质体模拟细胞膜研究了五种非甾体抗炎药对细胞膜的扰动作用,揭示了非甾体抗炎药可能的作用机制。脂质体膜随着温度的变化可能呈现晶体相、层状凝胶相、波动凝胶相和液晶相等不同的相态[5],外源物质的加入将影响脂质体的相转变,使膜的流动性发生改变。细胞膜的流动性是细胞膜重要的生物物理特征,膜流动性的改变将影响各种膜功能,如物质转运、信息传递及膜上酶的活性等[6]。
课题组前期已经用差示扫描量热(DSC)法及同步辐射小角X光衍射法研究了丹皮酚和DPPC的相互作用[3]以及丹皮酚、胆固醇与DPPC之间的竞争性相互作用[7]。药物在脂质体中可能包封于DPPC分子的胆碱部位、甘油骨架部位及疏水尾链部位,疏水尾链区又分为C1~C9区和C10~C16区[8]。包封于磷脂分子的不同位置对膜流动性的影响也不同。本文采用差示扫描量热(DSC)法结合同步辐射宽角X光衍射方法研究丹皮酚在脂质体疏水尾链区中的包封部位及对液晶态膜流动性的影响,并探讨其与丹皮酚抗氧化作用的关联性。
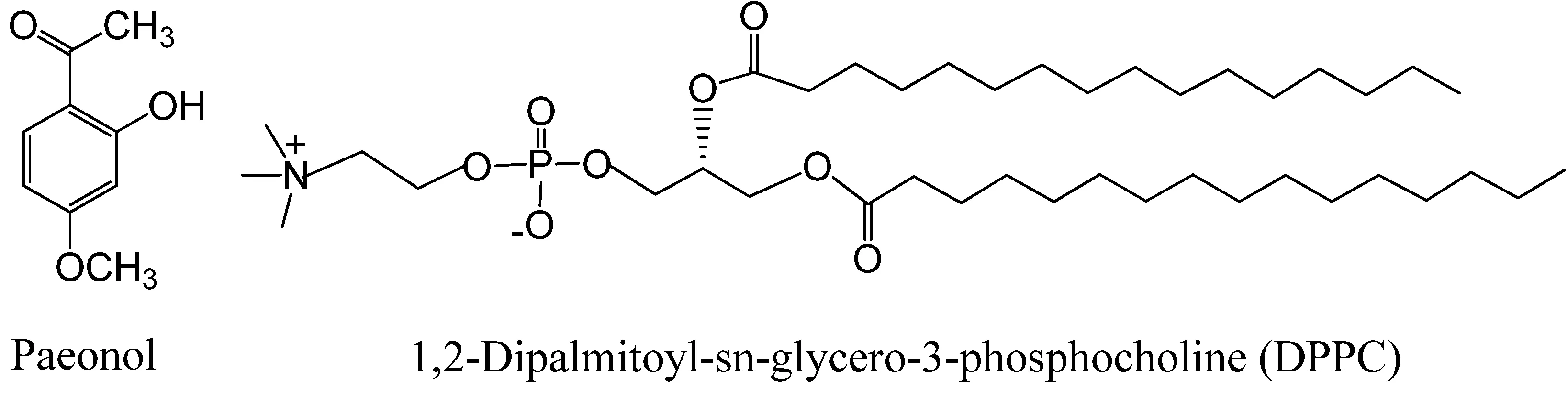
图1 丹皮酚和DPPC的结构式
1 仪器与试药
1.1 仪器
821e型差示扫描量热仪 (瑞士梅特勒-托利多公司);同步辐射X光衍射实验装置(北京同步辐射国家实验室1W2A站);XSE105DU型电子天平(瑞士梅特勒-托利多公司);EHEIM型变温附件(英国Linkam公司);RE-52AA型旋转蒸发仪(上海亚荣);DZF6050型真空干燥设备(上海一恒)。
1.2 试药
二棕榈酰磷脂酰胆碱(DPPC,美国Sigma公司,纯度>99%);丹皮酚(美国Sigma公司,纯度>99%);其他国产试剂均为分析纯。
2 方法与结果
2.1 丹皮酚脂质体的制备
参照文献[9]的方法制备脂质体:按计量比例称取DPPC和丹皮酚,溶解于氯仿中,通过旋转蒸发以除去氯仿至烧瓶内壁形成薄膜,真空干燥箱中过夜以除去残留的有机溶剂;加入过量的Tris-HCl(pH=7.4)缓冲溶液,置于60℃水浴1 h,旋涡混合1 min,室温20 min,旋涡混合1 min,如此反复3次,至体系均匀分散。
2.2 差示扫描量热实验
采用高灵敏度传感器HSS7,实验气氛为 N2,以空白坩埚做参比。为了保证样品在升温过程中处于相平衡的状态,选择较低的升温速率1 ℃/min。实验结果见图2与表1。
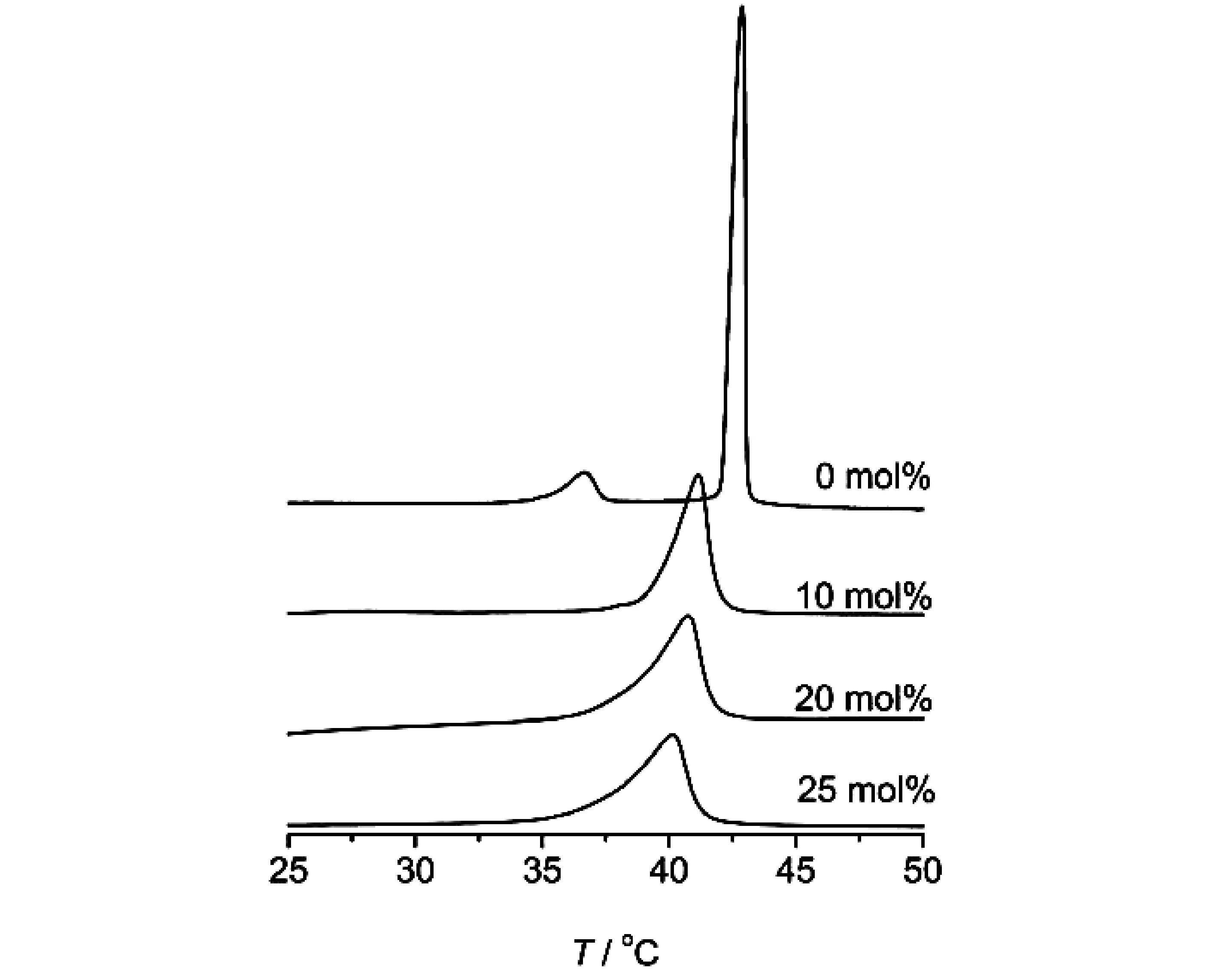
图2 含不同摩尔百分比丹皮酚的脂质体的DSC曲线

丹皮酚摩尔百分比主相变相变温度(℃)半峰宽(℃)相变焓(J/g)042.80.642.181040.71.342.722040.41.945.242539.82.143.90
图2所示为空白DPPC和丹皮酚含量不同的DPPC脂质体膜的DSC曲线。空白DPPC脂质体膜的DSC曲线显示两个峰,第一个峰峰形平缓且峰面积小,相变温度为36.6℃,对应预相变(Lβ′to Pβ′);第二个峰峰形尖锐且峰面积较大,相变温度为42.8℃,对应主相变(Pβ′to Lα)。这一结果与文献报导的空白DPPC脂质体的相变温度一致[10-11]。由表1可知,与空白脂质体相比,随着丹皮酚浓度的增大,含药脂质体主相变温度逐渐减小,半峰宽ΔT1/2逐渐增大,相变焓先增大后减小。
2.3 同步辐射宽角XRD实验
在实验过程中使用可以程序控温的Linkam变温附件(英国Linkam公司)对样品进行温度控制。衍射波长为1.54 Å,样品与检测器的距离为246 mm,曝光时间为120 s。衍射图像用Fit2D软件(http://www.esrf.eu/computing/scientific/FIT2D/)处理以得到衍射强度与倒置距离s之间的二维衍射曲线,由倒置间距s可求得反映磷脂分子尾链有序度的尾链间距d(d=1/s)。
脂质体可以用作细胞膜的模型膜。细胞膜适当的流动性是保证细胞功能的关键。生理温度下的细胞膜是液晶态的,因此在模拟细胞膜时应使脂质体处于液晶态。根据图2和表1所示,空白脂质体和各含药脂质体在45℃时都处于液晶相。因此本实验进行了45℃下各样品的同步辐射宽角X光衍射实验。 结果见图3及表2。

图3 45℃含不同摩尔百分比丹皮酚的脂质体的同步辐射宽角衍射曲线
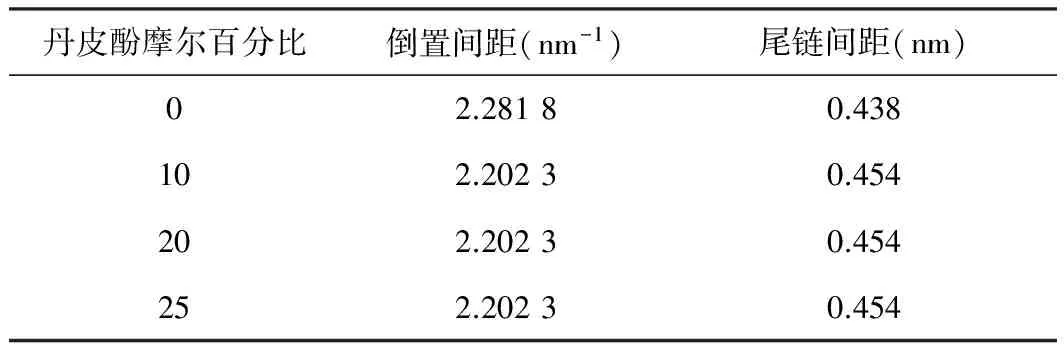
丹皮酚摩尔百分比倒置间距(nm-1)尾链间距(nm)02.28180.438102.20230.454202.20230.454252.20230.454
由表2的数据可知,与空白脂质体相比,各含药脂质体的磷脂分子尾链间距都有明显增加,说明丹皮酚的包封可以增加处于液晶相的脂质体膜中磷脂分子尾链排列的无序度,磷脂分子尾链排列无序度的提高将使其流动性增加。
3 讨论
在空白DPPC脂质体的DSC曲线上通常可以看到两个吸热峰,峰形平缓且峰面积较小的是预相变,反映了层状凝胶相到波动凝胶相(Lβ′to Pβ′)的转变,来源于磷脂分子中极性端的热运动;峰形尖锐且峰面积较大的是主相变,反映了波动凝胶相到液晶相(Pβ′to Lα)的转变,来源于磷脂分子中碳氢链的熔融[12]。DSC曲线的主相变温度、相变焓、半峰宽的增减变化可以用于推测脂质体膜结构性质的改变及药物在脂质体中的包封位置。
同步辐射宽角X光衍射实验可以得到脂质体中磷脂分子疏水尾链之间的距离,而疏水尾链距离的增大可以表征磷脂分子尾链无序度的增大,从而反映脂质体膜流动性的增大。
3.1 丹皮酚对脂质体膜主相变的影响及药物的包封位置
主相变来源于磷脂分子中碳氢链的熔融[12],表1表明丹皮酚脂质体主相变温度随丹皮酚浓度的增大整体呈下降的趋势,说明丹皮酚进入脂质体膜的疏水区。脂质体的DSC曲线是外源物质对磷脂影响的宏观表现,Jain等研究了多种脂溶性添加物对DPPC脂质体的DSC曲线的影响,总结了根据加入添加物后脂质体主相变的DSC吸热峰的变化来推测添加物在脂质体中包封位置的规律[8]:若半峰宽增大,峰尖移动,则添加物主要作用于DPPC分子的C1~C9位置;若峰形上出现小台阶,且小台阶下的面积随添加物浓度的增加而增加(但总面积不变),则添加物主要作用于DPPC分子的甘油骨架位置;若峰尖不发生移动,但峰的起始温度和终止温度发生变化,则添加物主要作用于DPPC分子的C10~C16位置;若加入添加物后DSC曲线出现新的峰,且新峰的面积随添加物浓度的增加而增加,则添加物主要作用于DPPC分子的胆碱位置。在本实验中,随着脂质体中丹皮酚浓度增加,DSC曲线中主相变的峰形变宽,峰尖位置发生了移动,根据Jain探索的规律,丹皮酚应主要作用在DPPC尾链的C1~C9的位置,如图4所示。
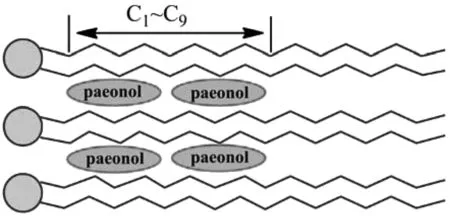
图4 丹皮酚分子在脂质体疏水尾链中的包封位置示意图
3.2 丹皮酚对膜流动性的影响与其抗氧化性的关联
在脂质过氧化过程中,自由基氧化多不饱和脂肪酸为饱和脂肪酸,降低了细胞膜的流动性。Wassall等的研究表明,脂质过氧化作用更容易发生在流动性较低(有序度较大)的模型膜[13]。磷脂膜的流动性的增加将使之不易被氧化[14]。本实验同步辐射宽角X光衍射结果表明丹皮酚的包封可以增加处于液晶相的脂质体膜中磷脂分子尾链的流动性,据此推测丹皮酚可能通过提高细胞膜的流动性发挥抗氧化作用。
包封率是脂质体制剂的关键指标之一。搞清楚药物与脂质分子的相互作用机制及药物在脂质体中的作用位置对于开发具有高包封率的脂质体意义重大。本研究对于进一步深入探索药物在脂质体中与辅料分子的作用位点、对于设计具有高包封率的含药脂质体具有重要的意义。
[1] 郭齐,李贻奎,王志国,等.丹皮酚药理研究进展[J].中医药信息,2009,26(1):20-22.
[2] 闫军,贾献慧,唐文照.丹皮酚脂质体的制备及质量控制方法研究[J].中国药房,2010,21(35):3299-3301.
[3] 邬瑞光,周洪伟,张小华,等.DSC和XRD法研究丹皮酚和脂质体的相互作用[J].中医药信息,2011,28(5):10-13.
[4] Nunes C,Brezesinski G,Lima JLFC,et al.Synchrotron SAXS and WAXS study of the interactions of NSAIDs with lipid membranes[J].J Phys Chem B,2011,115(24):8024-8032.
[5] Koynova R,Caffrey M.Phase and phase transitions of the phosphatidylcholines[J].Biochim Biophys Acta,1998,1376(1):91-145.
[6] 郝艳红,李庆章.细胞膜流动性与药物作用[J].黑龙江畜牧兽医,2001,18(2):26-28.
[7] 邬瑞光,孙海源,周洪伟,等.DSC和XRD法研究丹皮酚与脂质体的相互作用Ⅱ[J].中医药信息,2015,32(3):14-16.
[8] Jain MK,Wu NM.Effect of small molecules on the dipalmitoyl lecithin liposomal bilayer[J].J Membrane Bio,1977,34(1):157-201.
[9] Bakonyi M,Berkó S,Budai-Sz cs M,et al.Differential scanning calorimetry for evaluating the encapsulation efficiency of lidocaine loaded liposomes compared to the ultracentrifugation method[J].J Therm Anal Calorim,2017, doi:10.1007/s10973-017-6394-1.
[10] Goodwin GC,Hammond K,Lyle I,et al.Lectin-mediated agglutination of liposomes containing glycophorin. Effects of acyl chain length[J].Biochim Biophys Acta,1982,689(1): 80-88.
[11] Wu RG,Chen L,Yu ZW,et al.Phase diagram of stigmasterol-dipalmitoylphosphatidylcholine mixtures dispersed in excess water[J].Biochim Biophys Acta,2006,1758(6):764-771.
[12] 宁美英,郭颖志,顾忠伟.差示扫描量热法在脂质体研究中的应用[J].国外医学·药学分册,2005,32(1):56-61.
[13] Wassall SR,Thewalt JL,Wong L,et al.deuterium NMR study of the Interaction of alpha-Tocopherol with a phospholipid model membrane[J].Biochemistry,1986,25(2):319-326.
[14] Nunes C,Brezesinski G,Lima JLFC,et al.Effects of non-steroidal anti-inflammatory drugs on the structure of lipid bilayers:therapeutical aspects[J].Soft Matter,2011,7(6):3002-3010.
EncapsulatingLocationofPaeonolinHydrophobicTailChainofLiposomesandItsEffectontheMembraneFluidity:StudywithDSCandSynchrotronWide-angleXRDMethods
WEI Tian-tian1, GUO Hao-yue2, ZHOU Hong-wei3, WU Rui-guang1*
(1.SchoolofChineseMateriaMedica,BeijingUniversityofChineseMedicine,Beijing100102,China; 2.KeyLaboratoryofBio-organicPhosphorousChemistryandChemicalBiology(MinistryofEducation),TsinghuaUniversity,Beijing100084,China; 3.InstituteofBasicResearchinClinicalMedicine,ChinaAcademyofChineseMedicalSciences,Beijing100700,China)
Objective: To study the encapsulating location of paeonol in hydrophobic tail chain of liposomes and its effect on membrane fluidity to disclose the mechanism of the antioxidant effect of paeonol. Methods: Liposomes were prepared by film dispersion method. Differential scanning calorimetry(DSC) was employed to investigate the effect of paeonol on the main transition of liposomes and to disclose the encapsulating location of paeonol in liposomes. Synchrotron wide-angle X-ray diffraction(XRD) technique was employed to investigate the effect of paeonol on the distance between hydrophobic tail chain and its effect on the membrane fluidity of liposomes existing as liquid-crystalline phase. Furthermore, the relationship between XRD results and the mechanism of the antioxidant effect of paeonol was investigated. Results: The DSC results showed that the temperature of main transition decreases and the half-height width of DSC peaks increased with increased concentration of paeonol. The wide-angle X-ray diffraction results showed that the distance between hydrophobic chains of phospholipid molecules of paeonol encapsulated liposomes was larger than that of blank liposome. Conclusion: The location site of paeonol at the tail chains of DPPC was C1~C9. The incorporation of paeonol into liposomes can increase the disorder of the tail chains of DPPC and improve the fluidity of the membrane, which may be one of the mechanisms of the antioxidant effect of paeonol.
DSC; Synchrotron wide-angle XRD; Paeonol; Liposomes; Encapsulating location; Membrane fluidity; Antioxidant effect
R28
A
1002-2406(2017)06-0001-04
国家自然科学基金项目(No.81773916);北京市自然科学基金项目(No.7153171);北京中医药大学基本科研业务费资助项目(No.2017-JYB-JS-155,2017-JYB-XS-093)
魏田田(1991-),女,北京中医药大学2015级硕士研究生。
邬瑞光*(1975-),男,博士,副教授,硕士研究生导师,主要研究方向:中药制剂新技术与新剂型。
2017-09-13
修回日期:2017-10-01
