日本血吸虫高迁移率族蛋白B1诱导小鼠RAW264.7巨噬细胞M1型极化
2017-11-13史晓娜苑纯秀赵小超李玉梅侯旖旎冯新港
艾 敏,史晓娜,2,苑纯秀,3,赵小超,李玉梅,2,侯旖旎,2,冯新港
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;2.上海师范大学生命与环境科学学院,上海 200234;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
日本血吸虫高迁移率族蛋白B1诱导小鼠RAW264.7巨噬细胞M1型极化
艾 敏1,史晓娜1,2,苑纯秀1,3,赵小超1,李玉梅1,2,侯旖旎1,2,冯新港1
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;2.上海师范大学生命与环境科学学院,上海 200234;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
通过分析日本血吸虫高迁移率族蛋白B1(Schistosoma japonicum high mobility group protein B1,SjHMGB1)刺激的巨噬细胞的表型相关分子的表达情况,研究SjHMGB1诱导巨噬细胞向M1型极化的功能。分别用LPS及IFN-γ和IL-4诱导小鼠RAW264.7巨噬细胞成M1型和M2型作为阳性对照组,以SjHMGB1诱导的巨噬细胞为实验组。分别利用Griess法、FCM、RTPCR和酶活性检测巨噬细胞中iNOS、CD16/32、ArginaseⅠ、CD206等主要标志分子。结果与空白对照组相比,SjHMGB1刺激组和M1型阳性对照组巨噬细胞NO分泌显著增加,精氨酸酶活性变化不显著,M2型巨噬细胞呈现相反的表型。流式结果显示SjHMGB1刺激组和M1型阳性对照组的巨噬细胞诱导型一氧化氮合成酶(iNOS)和CD16/32表达上调,而CD206变化不明显。RT-PCR结果显示SjHMGB1蛋白刺激组和M1型阳性对照组的巨噬细胞iNOS表达上调,而arginaseⅠ和CD206变化不明显;M2型巨噬细胞arginaseⅠ表达水平明显升高,CD206表达上调。结果表明SjHMGB1能够诱导巨噬细胞往M1型巨噬细胞分化。
SjHMGB1蛋白;M1型巨噬细胞;精氨酸酶;诱导型一氧化氮合成酶
日本血吸虫病是一种人畜共患寄生虫病,在我国主要流行于长江流域和洞庭湖、鄱阳湖等湖区,截止2015年底仍有二十多万人受到血吸虫病的困扰[1]。目前吡喹酮化疗在血吸虫病防治中具有重要作用,但长时间使用吡喹酮导致耐药虫株的产生越来越引起人们的关注和忧虑[2]。因此,开发安全高效的抗血吸虫疫苗来控制血吸虫病显得尤为急迫[3]。研究人员基于辐照致弱(radiation-attenuated,RA)疫苗保护性免疫的有效机制,提出了抗血吸虫病分子疫苗的研制思路。RA血吸虫尾蚴免疫小鼠后,在肺部诱导了以CD4+T细胞介导的Th1型为主的高保护性免疫应答,其中来源于T细胞和巨噬细胞的IFN-γ和TNF-ɑ等炎性因子发挥了重要的效应功能[4,5],但是这种免疫微环境的形成和作用机制仍然不清楚。中国农业科学院上海兽医研究所农业部动物寄生虫学重点开放实验室(以下简称“本实验室”)的初步研究表明,日本血吸虫高迁移率族蛋白B1(Schistosoma japonicum high mobility group protein B1,SjHMGB1)作为一类虫源性的应激分子,可能在RA血吸虫童虫诱导的保护性免疫中起到重要作用,其机制可能是通过其刺激宿主免疫细胞,形成Th1型极化的先天免疫微环境,进而参与免疫调节,发挥免疫保护作用[6]。
高迁移率族蛋白B1(high mobility group protein B1,HMGB1)是一种染色质相关的核蛋白,也是细胞外损伤相关分子模式(damage associated molecular patterns,DAMPs)分子,是细胞死亡和存活的关键调节组分[7]。当机体组织损伤时释放内源性危险信号,HMGB1非特异性地与DNA结合,可通过核孔穿梭于胞核和胞浆,遇到危险刺激时释放到细胞外发挥作用[8]。研究表明,HMGB1是一种能够介导感染、损伤和炎症反应的细胞因子[9],可参与炎症反应的全身性应答和局部反应[10]。曼氏血吸虫来源的HMGB1(SmHMGB1)通过诱导宿主巨噬细胞释放大量的TNF-ɑ、IL-6、IL-13等炎性细胞因子,在宿主血吸虫相关炎症反应中起关键作用[11];与此同时,磷酸化的SmHMGB1也可调节细胞运输与分泌[12]。反过来,活化的单核细胞和巨噬细胞能够分泌HMGB1[13],也能通过自身耗竭间接减少炎症,调节趋化因子产物,招募效应T细胞到肺,最终形成肺部炎性反应环境[14]。本实验室李丹丹等[6]发现SjHMGB1能够通过TLR2/TLR4途径活化巨噬细胞,释放TNF-ɑ、IL-1β等炎性细胞因子。
本研究用小鼠RAW264.7巨噬细胞系为模型,通过分析SjHMGB1刺激的巨噬细胞表型相关分子的表达情况,研究SjHMGB1是否具有诱导巨噬细胞向M1型极化的功能,旨在为深入研究RA血吸虫童虫诱导的保护性免疫的细胞核分子机制提供有力的实验数据。
1 材料和方法
1.1 材料
1.1.1 细胞 RAW264.7小鼠巨噬细胞株由中国农业科学院上海兽医研究所农业部动物寄生虫学重点开放实验室保存。
1.1.2 蛋白 SjHMGB1蛋白由中国农业科学院上海兽医研究所农业部动物寄生虫学重点实验室构建保存的杆状病毒昆虫细胞表达系统所表达[15]。
1.1.3 主要试剂 细胞培养基DMEM(Gibco,11995-065)、胎牛血清(Gibco,10099-141)、TRYPSIN 0.25% EDTA(Gibco,25200072)、小鼠重组IFN-γ(Peprotech)、IL-4(Peprotech)等购自上海达科为生物科技有限公司;LPS(Sigma)购自上海少辛生物科技有限公司;TRIZOL REAGENT(Ambion,15596018)购自英潍捷基(上海)贸易有限公司;DEPC水(Solarbio);NO检测试剂盒为碧云天公司产品;QuantiChromTMArginase Assay Kit (BioAssay Systems, DARG-200)试剂盒购自北京兰博利德商贸有限公司;SYBR® Premix ExTaq(TaKaRa,RR420A)、PrimeScript® RT reagent Kit with gDNA Eraser(TaKaRa,RR047A)等购自上海皓嘉科技发展有限公司;FITC标记的大鼠抗小鼠CD206(BD Pharmingen)、PE/Cy7标记的大鼠抗小鼠CD16/32(BD Pharmingen)、PE标记的兔抗小鼠iNOS(CST)等购自上海优宁维生物科技股份有限公司;其他试剂为进口或国产分析纯。
1.1.4 引物 由英潍捷基(上海)贸易有限公司合成,引物序列见表1。
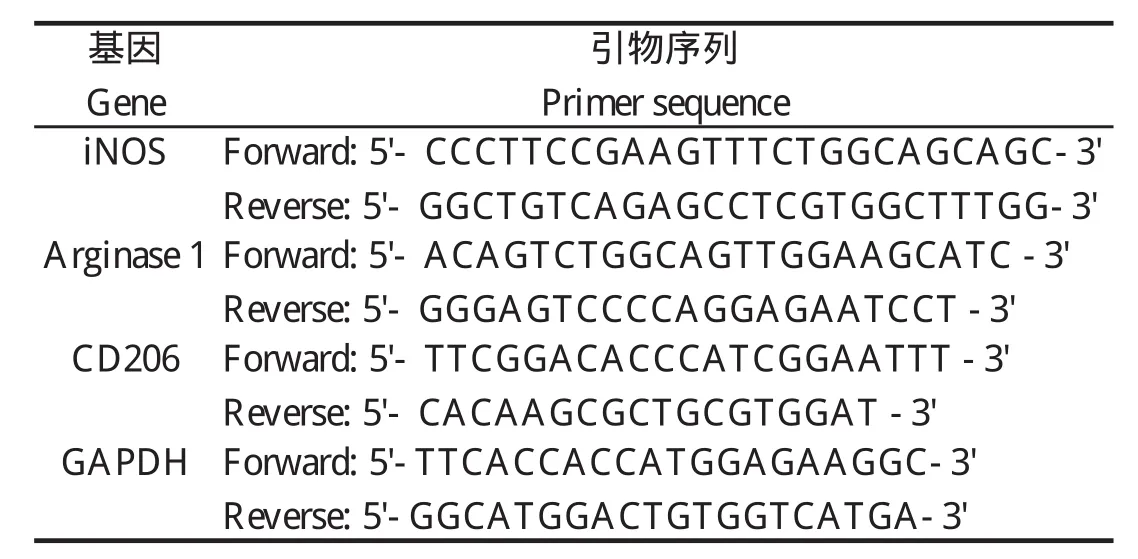
表1 引物序列Table 1 Primer sequence
1.2 方法
1.2.1 RAW264.7巨噬细胞系的传代培养及体外刺激 RAW264.7巨噬细胞系用含10%FBS的DMEM培养基于37℃ 5%CO2的生化培养箱常规培养。该细胞是贴壁细胞,先用PBS洗去培养基,再加入2 mL、TRYPSIN 0.25% EDTA/5 mL DMEM消化25~30 min后,用PBS洗去胰酶,最后用完全培养基脱落细胞,48 h传代1次。收集成熟的巨噬细胞,将细胞浓度调成2×106cells/mL,2×106cells/孔铺于24孔板,以IFN-γ(100 U/mL)和LPS(200 ng/mL)共同刺激培养24~48 h,诱导M1型巨噬细胞;以IL-4(10 ng/mL)刺激培养24~48 h诱导M2型巨噬细胞;SjHMGB1 50 μg/mL刺激培养24~48 h,同时以100 μL PBS为空白对照组。
1.2.2 诱导型一氧化氮合酶(iNOS)活性检测 收集上述培养24 h的细胞上清,按照说明书要求取50 μL标准品和样品加入96孔板中,每孔加入50 μL Griess R1室温避光放置5 min;再每孔加入50 μL的Griess R2室温避光放置5 min;540 nm测定吸光度。制备标准曲线并计算NO的浓度。
1.2.3 精氨酸酶(ArginaseⅠ)活性检测 收集刺激培养48 h的细胞,PBS洗1次,4℃、1000×g离心10 min,使用100 μL 10 mmol/L Tris-HCl(pH7.4)含1μmol/L pepstatin A、1μmol/L leupeptin和0.4%(w/v)TritonX-100裂解10 min,RT;4℃、14 000×g离心10 min,收集上清,用于ArginaseⅠ活性检测。设置1 mmol/L Urea standard和ddH2O组各50 μL/孔,按照试剂盒使用说明书进行检测。样品组(添加arginine底物)和空白对照组(未添加arginine底物)组,37℃孵育2 h,加入200 μL Urea Reagent A和B(1:1,V/V)混合终止反应,空白对照组再加入10 μL arginine底物,RT孵育60 min,430 nm处测定吸光度。
1.2.4 流式细胞术(flow cytometry,FCM)检测细胞膜蛋白CD206、CD16/32和膜内蛋白iNOS的表达 刺激培养巨噬细胞24 h后,收集细胞,4℃、1000×g离心5 min,细胞用200 μL 含2%BSA的PBS悬起,加入FITC-CD206、PE/Cy7-CD16/32,4℃染色30 min;用含2%BSA的PBS洗1次,4%多聚甲醛室温固定20 min;含2%BSA的PBS洗1次,加入100 μL 0.1%皂素(含1%BSA、0.1%NaN3、0.1%saponin的PBS)室温破膜10 min;再加入PE-iNOS染色30 min(4℃);用预冷的PBS洗1次,400 μL PBS悬起细胞转至流式管,流式细胞仪进行检测。
1.2.5 总RNA的抽提及RT-PCR
1.2.5.1 总RNA的抽提 巨噬细胞刺激培养24 h后,将培养上清全部弃去,PBS洗涤细胞1遍,弃去所有液体,每2×106cells加入500 μL TRIzol,脱落细胞收集至无RNase的1.5 mL EP管内,充分震荡裂解细胞,另加200 μL氯仿,混匀成乳状,冰上静置3 min,出现上下分层现象;4℃、12 000×g离心15 min,液体分成3层,从上到下依次是透明澄清液体、白色层、红色层,收集透明液体于新的EP管中,加入600 μL的异丙醇,剧烈混匀,于-80℃放置24 h后取出。冰上溶解后加入DEPC水配制的75%乙醇(V/V)冲洗RNA,轻柔涡旋,4℃、7500×g离心5 min,吸去所有上清,保留沉淀,空气中倾斜干燥5 min,加入10 μL RNase free water 55℃水浴锅溶解1 min,检测RNA浓度,-80℃保存备用。
1.2.5.2 RT-PCR 基因组DNA的去除:将RNA稀释成500 ng/μL,各试剂添加比例及条件如下,5×gDNA Eraser Buffer 2 μL、gDNA Eraser 1 μL、Total RNA 2μL、RNase Free dH2O补足至10 μL,42℃ 2 min,4℃备用;反转录反应体系:5×PrimeScript® Buffer 2(for Real Time) 4 μL、PrimeScript® RT Enzyme MixI 1 μL、RT Primer Mix 1 μL、反应液10 μL、RNase free water 补足至20 μL,轻柔混匀后进行反转录反应;反应条件:37℃15 min;85℃ 5 s,4℃。按照SYBR® Premix Ex Taq说明书使用ABI7500 real-time PCR system进行如下反应:95℃预变性2 min;95℃预变性15 s和60℃退火1 min,40个循环。添加扩增产物的溶解曲线来确定反应的特异性。利用2-△△CT法计算目的基因mRNA的相对表达。
1.2.6 统计学分析 采用GraphPad Prism5.0、ABI7500Software v2.0.1或FlowJo7.6.2软件对数据进行统计分析,两组间差异比较采用Student’s t检验,P<0.05视为差异具有显著性统计学意义,P<0.01视为差异具有极显著性统计学意义。
2 结果
2.1 SjHMGB1蛋白对巨噬细胞分泌NO的影响 以Griess法检测RAW264.7巨噬细胞分泌到上清中的NO含量,由图1可以看出,LPS和SjHMGB1的刺激能够促使巨噬细胞分泌NO,且SjHMGB1刺激组的含量与对照组差异具有极显著统计学意义(P<0.001)。表明SjHMGB1蛋白可以刺激巨噬细胞释放大量NO,说明此时巨噬细胞精氨酸代谢主要是iNOS途径。
2.2 巨噬细胞精氨酸酶(ArginaseⅠ)活性的变化 在体外培养条件下,参照经典方法以IFN-γ及LPS将RAW264.7巨噬细胞诱导成M1型巨噬细胞,以IL-4将其诱导成M2型巨噬细胞。结果发现,SjHMGB1蛋白刺激组的巨噬细胞精氨酸酶活性较空白对照组稍有上升,对比LPS+IFN-γ组几乎没有变化,对比IL-4组明显降低,说明SjHMGB1蛋白不能诱导M2型巨噬细胞合成量增加,此时精氨酸酶途径不占主导地位(图2)。

图1 重组SjHMGB1蛋白刺激巨噬细胞NO释放Fig.1 The release of NO from Macrophage stimulated by rSjHMGB1
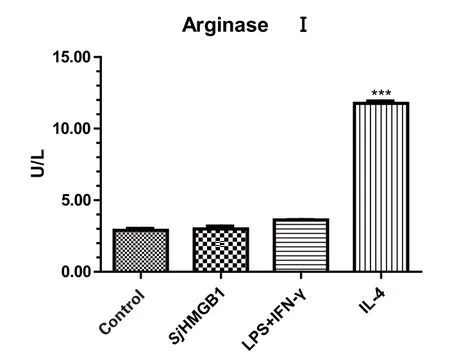
图2 重组SjHMGB1蛋白刺激巨噬细胞的精氨酸酶活性Fig.2 ArginaseⅠ activity of macrophage stimulated by rSjHMGB1
2.3 流式细胞术(FCM)检测细胞膜蛋白CD206、CD16/32和膜内蛋白iNOS 的表达 巨噬细胞膜蛋白表达的差异是鉴定不同类型巨噬细胞的重要方法。应用FCM对M1型巨噬细胞的标志CD16/32(FcγIII/FcγII receptor)、iNOS(inducible nitric oxide synthase)和M2型巨噬细胞的标志CD206(mannose receptor)的表达进行检测。结果表明,SjHMGB1和LPS刺激组CD16/32、iNOS较对照组有明显上升,而CD206没有明显变化(图3)。说明SjHMGB1蛋白可诱导膜表面分子CD16/32和膜内分子iNOS表达量上升,而不能诱导CD206表达增加,该蛋白刺激可使巨噬细胞向M1型分化。

图3 流式细胞术检测巨噬细胞CD16/32、iNOS和CD206的表达Fig. 3 The expression of CD16 / 32, iNOS and CD206 in macrophages detected by fl ow cytometry
2.4 巨噬细胞表面标志及细胞因子的相对表达 为检测在LPS+IFN-γ、IL-4以及SjHMGB1蛋白刺激下,巨噬细胞表达标志分子iNOS、CD206和ArginaseⅠ的情况。利用RT-PCR技术检测3种刺激物及空白对照组处理下,3种标志分子的mRNA的转录水平如图4所示。结果表明,与空白对照组相比,SjHMGB1蛋白刺激组和LPS刺激组的巨噬细胞iNOS的mRNA转录水平显著提高,而CD206和ArginaseⅠ的mRNA水平没有明显提高,进一步说明了SjHMGB1可能诱导巨噬细胞向M1型分化。
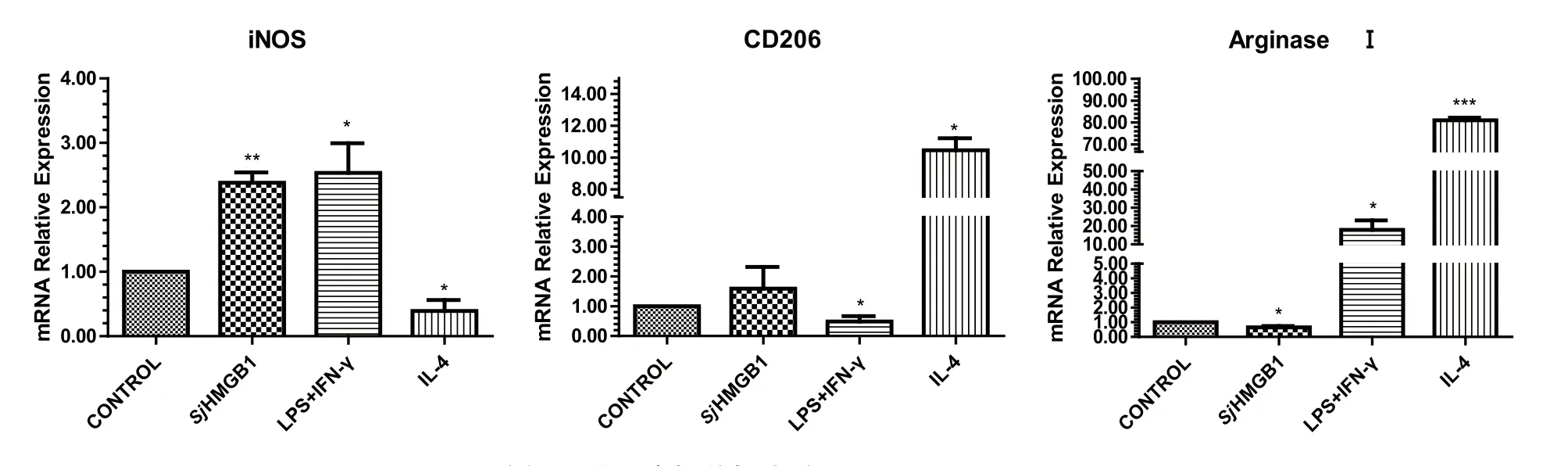
图4 RT-PCR分析巨噬细胞相关标志分子iNOS、CD206 和ArginaseⅠFig. 4 Analysis of macrophage - associated markers including iNOS, CD206 and ArginaseⅠby RT – PCR
3 讨论
近年来的研究表明,辐照和某些药物可以使肿瘤细胞产生免疫原性细胞死亡(immunogenic cell death,ICD),与此同时这些细胞会分泌或释放一些损伤相关分子模式(DAMPs),如HMGB1、热休克蛋白( heat shock proteins,HSPs)和ATP等,这些DAMPs分子具有免疫刺激功能,从而可以激活宿主的抗肿瘤免疫应答[16]。本课题组前期研究也提示,辐照血吸虫来源的细胞也可能具有ICD的特征,能够分泌或释放DAMPs分子,如SjHMGB1和SjHSP70等可分泌至细胞表面或胞外,活化小鼠巨噬细胞或树突状细胞[17]。因此,研究RA血吸虫尾蚴或童虫来源的SjHMGB1和SjHSP70等分子诱导巨噬细胞向致炎性的M1型方向极化的分子机理,可阐明辐照血吸虫尾蚴或童虫诱生的Th1极化的微环境的形成机制。
小鼠RAW264.7巨噬细胞系是用于研究固有免疫的常用细胞模型,在不同抗原的刺激下巨噬细胞可以分化为不同的表型(M1型和M2型)[6]。M1型主要被LPS、TNF-α、IFN-γ等细胞因子激活,表现为促进炎症反应;而M2型分别由IL-4或IL-13诱导成M2a型表现为损伤修复,由TLRs和免疫复合物诱导成M2b型表现免疫调节功能,由IL-10诱导成M2c表现免疫抑制效应。M1型主要标志分子及细胞因子有iNOS、CD16/32、TNF-ɑ、IL-6、IL-1β等,IL-12表达上调,IL-10表达下调;M2型主要标志分子及细胞因子有Arg-1、CD206、CD163、VEGF、TGF-β等,IL-12表达下调,IL-10表达上调[18]。因此,本文通过测定SjHMGB1刺激的巨噬细胞表型标志分子,初步提示该蛋白能够诱导巨噬细胞M1极化。本实验室李丹丹等[6]发现SjHMGB1蛋白刺激后,巨噬细胞表面趋化因子受体CCR7表达明显上调,具有致炎性M1型巨噬细胞的功能。至于巨噬细胞M1极化后,微环境中细胞因子变化,还需要进一步验证。
正常情况下,iNOS与ArginaseⅠ的表达和活性在巨噬细胞中受到严格调控,两者的动态平衡在维持巨噬细胞的功能稳定中发挥重要作用[19]。ArginaseⅠ能够代谢精氨酸,产生鸟氨酸、尿素等;而一氧化氮合酶(iNOS或NOS)则将其代谢产生瓜氨酸和NO,瓜氨酸再为精氨酸的合成所利用,NO作为第二信使利用或释放[20]。有研究显示,巨噬细胞产生的NO可以参与杀灭肺期血吸虫童虫[21,22];ArginaseⅠ高表达的M2型巨噬细胞可导致小鼠发生肺实变和纤维化[23]。本研究通过检测NO含量来代表相关酶的活性,可进一步分析巨噬细胞分化方向。本研究中我们主要采用测定巨噬细胞的表型标志分子的方法,来初步鉴定小鼠巨噬细胞在SjHMGB1刺激下是否会向M1型方向极化,为深入研究RA血吸虫尾蚴或童虫保护性免疫的分子机制提供资料。至于RA SjHMGB1是否也通过刺激巨噬细胞产生NO参与杀灭肺期血吸虫童虫,还需要进一步验证。
本文检测到小鼠巨噬细胞在经过SjHMGB1刺激后,与M1型相关的表型标志分子的表达都明显上调,这与用IFN-γ及脂多糖(LPS)诱导产生的M1型巨噬细胞的相应的表型标准分子的表达图谱类似。实验数据充分表明SjHMGB1具有类似于致炎性细胞因子的功能,能够诱导巨噬细胞往M1型巨噬细胞分化,这一结果很可能与辐照血吸虫诱生的Th1极化的微环境的形成密切相关。因此,SjHMGB1很可能是一个重要的免疫刺激分子,在RA血吸虫尾蚴或童虫诱导的高保护性免疫中发挥重要的作用。
[1] 张利娟, 徐志敏, 钱颖骏, 等. 2015年全国血吸虫病疫情通报[J]. 中国血吸虫病防治杂志, 2016, 28(6): 611-617.
[2] Ismail M, Metwally A, Farghaly A, et al. Characterization of isolates of Schistosoma mansoni from Egyptian villagers that tolerate high doses of praziquantel[J]. Am J Trop Med Hyg, 1996, 55(2): 214-218.
[3] McManus D P, Loukas A. Current status of vaccines for schistosomiasis[J]. Clin Microbiol Rev, 2008, 21(1): 225-242.
[4] Wilson R A, Coulson P S. Immune effector mechanisms against schistosomiasis: looking for a chink in the parasite’s armour[J]. Trends Parasitol, 2009, 25(9): 423-431.
[5] Bickle Q D. Radiation-attenuated schistosome vaccination- a brief historical perspective[J]. Parasitology, 2009,136(12): 1621-1632.
[6] 李丹丹. 日本血吸虫高迁移率族蛋白活化小鼠巨噬细胞和树突状细胞的功能研究[D]. 上海: 上海师范大学,2016.
[7] Tang D, Kang R, Zeh H J 3rd, et al. High-mobility group box 1 [HMGB1] and cancer[J]. Biochim Biophys Acta,2010, 1799(1-2):131-140.
[8] 龚非力. HMGB1——一种重要的报警素[J]. 现代免疫学,2009, 29(3): 179-184.
[9] Lotze M T, Tracey K J. High-mobility group box 1 protein (HMGB1): nuclear weapon in the immune arsenal[J]. Nat Rev Immunol, 2005, 5(4): 331-342.
[10] Kono K, Mimura K, Kiessling R. Immunogenic tumor cell death induced by chemoradiotherapy: molecular mechanisms and a clinical translation[J]. Cell Death Dis,2013, 4: e688.
[11] Gnanasekar M, Velusamy R, He Y X, et al. Cloning and characterization of a high mobility group box 1 (HMGB1)homologue protein from Schistosoma mansoni[J]. Mol Biochem Parasitol, 2006, 145(2): 137-146.
[12] de Abreu da Silva IC1, Carneiro V C, Maciel Rde M.CK2 phosphorylation of schistosoma mansoni hmgb1 protein regulates its cellular traffic and secretion but not its DNA transactions[J]. PLoS One, 2011, 6(8): e23572.
[13] Wang H, Bloom O, Zhang M, et al. HMG-1 as a late mediator of endotoxin lethality in mice[J]. Science, 1999,285(5425): 248-251.
[14] Borthwick L A, Barron L, Hart K M, et al. Macrophages are critical to the maintenance of IL-13-dependent lung inflammation and fibrosis[J]. Mucosal Immunol,2016,9(1): 38-55.
[15] 刘群. 日本血吸虫高迁移率族蛋白 B1(SjHMGB1)免疫生物学功能的初步研究[D]. 上海:上海师范大学, 2015.
[16] Vandenabeele P, Vandecasteele K, Bachert C, et al.Immunogenic apoptotic cell death and anticancer immunity[J]. Adv Exp Med Biol, 2016, 930: 133-149.
[17] Duan M M, Xu R M, Yuan C X, et al. SjHSP70, a recombinant Schistosoma japonicum heat shock protein 70, is immunostimulatory and induces protective immunity against cercarial challenge in mice[J]. Parasitol Res, 2015, 114(9): 3415-3429.
[18] Gensel J C, Zhang B. Macrophage activation and its role in repair and pathology after spinal cord injury[J]. Brain Res, 2015, 1619: 1-11.
[19] Raynaud Simon A, Belabed L , Le Naour G, et al.Arginine plus proline supplementation elicits metabolic adaptation that favors wound healing in diabetic rats[J].Am J Physiol Regul Integr Comp Physiol, 2012, 303(10):R1053-1061.
[20] Li Z, Zhao Z J, Zhu X Q, et al. Differences in iNOS and arginase expression and activity in the macrophages of rats are responsible for the resistance against T. gondii infection[J]. PLoS One, 2012, 7(4): e35834.
[21] Oswald I P, Eltoum I, Wynn T A, et al. Endothelial cells are activated by cytokine treatment to kill an intravascular parasite, Schistosoma mansoni, through the production of nitric oxide[J]. Proc Natl Acad Sci USA, 1994, 87(91):999-1003.
[22] Wynn T A, Oswald I P, Eltoum I A, et al. Elevated expression of Th1 cytokines and nitric oxide synthase in the lungs of vaccinated mice after challenge infection with Schistosoma mansoni[J]. J Immunol, 1994, 6(153):5200-5209.
[23] Rauh M J, Ho V, Pereira C, et al. SHIP represses the generation of alternatively activated macrophages[ J].Immunity, 2005, 23(4): 361-374.
M1 TYPE POLARIZATION OF MURINE RAW264.7 MACROPHAGES INDUCED BY HIGH MOBILITY GROUP PROTEIN B1 OF SCHISTOSOMA JAPONICUM
AI Min1, SHI Xiao-na1,2, YUAN Chun-xiu1,3, ZHAO Xiao-chao1, LI Yu-mei1,2, HOU Yi-ni1,2,FENG Xin-gang1
(1. Key Laboratory of Animal Parasitology of Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241,China; 2. College of Life and Environment Sciences, Shanghai Normal University, Shanghai 200234, China; 3. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
The role of Schistosoma japonicum high mobility group protein B1 (SjHMGB1) in the induction of macrophages to M1 type polarization was investigated through the analysis of expression of phenotype-related molecules on stimulated macrophages. The mouse RAW264.7 macrophages induced by LPS and IFN-γ or IL-4 respectively to M1 or M2 type were set as positive control groups. Griess,FCM, RT-PCR and enzyme activities were analyzed to detect the expression of major marker molecules including iNOS, CD16/32,arginaseⅠand CD206 in macrophages. As compared with the positive control groups, a few changes were observed, including signi fi cant increase of the NO secretion of macrophages in SjHMGB1 treatment group and M1 group, slight increase in the activity of arginaseⅠand opposite phenotype of M2 type macrophages. In addition, fl ow cytometry analysis showed signi fi cant up-regulation of the expression of iNOS and CD16/32 of macrophages in SjHMGB1 group and M1 group except CD206. RT-PCR results also indicated up-regulated expression of iNOS in SjHMGB1 group and M1 group as well as CD206 and enzyme activities of M2 macrophages. However, the expression level and arginase I did not change signi fi cantly. In conclusion, SjHMGB1 induced the differentiation of macrophages into M1 type polarization.
Schistosoma japonicum high mobility group protein B1; M1 type macrophage; arginaseⅠ; iNOS
S852.735
A
1674-6422(2017)05-0053-07
2017-03-02
国家重点基础研究发展计划(2015CB150303)
艾敏,女,硕士研究生,预防兽医学专业
冯新港,E-mail:fengxingang@shuri.ac.cn
