新孢子虫NcSRS2和NcSAG1重组蛋白免疫小鼠诱导的免疫应答
2017-11-13刘梦丽许正茂吉尔格勒巴音查汗
刘梦丽,许正茂,吉尔格勒,张 杨,巴音查汗
(1.新疆农业大学动物医学学院,乌鲁木齐830052;2.巴音郭楞职业技术学院,库尔勒841000)
新孢子虫NcSRS2和NcSAG1重组蛋白免疫小鼠诱导的免疫应答
刘梦丽1,许正茂1,吉尔格勒2,张 杨1,巴音查汗1
(1.新疆农业大学动物医学学院,乌鲁木齐830052;2.巴音郭楞职业技术学院,库尔勒841000)
为了研究新孢子虫NcSRS2和NcSAG1重组蛋白对动物的免疫效果,利用重组表达的NcSRS2和NcSAG1蛋白与弗氏佐剂混匀后免疫BALB/c小鼠,检测小鼠抗新孢子虫抗体水平和血清中IL-4和IFN-γ含量。结果表明,免疫后的BALB/c小鼠IgG、IgG2a和IFN-γ抗体表达水平升高,IgG1抗体和IL-4表达水平也升高,表明NcSRS2和NcSAG1重组蛋白可激发机体产生Th1型和Th2型免疫反应,且NcSRS2重组蛋白的免疫增强效果与NcSAG1重组蛋白免疫组的差异具有显著统计学意义(P<0.05)。本研究结果为研制高效安全的抗新孢子虫的新型疫苗提供了参考。
新孢子虫;重组蛋白;NcSRS2;NcSAG1
新孢子虫病是由犬新孢子虫寄生于多种动物共患的一种胞内寄生性原虫病。犬既是它的中间宿主也是终末宿主。新孢子虫可感染牛等多种动物,造成母畜流产、产出木乃伊胎、死胎、繁殖障碍等经济损失[1-4]。还能使患病动物体重减轻、营养不良,造成产奶量下降和饲养费用的浪费,以及产生对奶牛的扑杀、更换、对环境造成污染所带来间接的费用和损失[5-7]。目前还没有能够预防新孢子虫病的疫苗投入市场的有关报道。新孢子虫重组蛋白因具有较强免疫作用,能够诱导动物机体产生有效的体液免疫和细胞免疫,所以成为新孢子虫病疫苗研究的热点[8]。为此,本文对新孢子虫的重组蛋白疫苗展开研究,旨在为抗新孢子虫感染的新型疫苗研发及进一步筛选研究提供基础信息。
在疫苗的研究方面,抗原的获得是重要途径之一。新孢子虫表面抗原是新孢子虫粘附和侵入宿主细胞的重要抗原,也是新孢子虫疫苗最有希望的候选抗原[9]。已有研究结果证明,表面抗原NcSAG1可激发机体的体液免疫和细胞免疫反应,并且可产生IFN-γ和IL-4,宿主感染新孢子虫后脑内新孢子虫的数量显著降低[10-12]。Nishikwa等[13]分别用携带有NcSRS2和NcSAG1基因的重组痘苗病毒免疫BALB/c小鼠后,发现小鼠产生了保护性免疫力,且NcSRS2的免疫效果较NcSAG1好,表明融合疫苗的效果可以更好的预防新孢子虫对宿主动物的感染。
新孢子虫可感染多种中间宿主动物,其中危害最大的是奶牛,但奶牛成本高,体格硕大,因此研究有一定的局限。由于小鼠感染模型较为常见[14]。且近交系小鼠更易感新孢子虫[15],如C57BL/6和BALB/c小鼠。因此本实验利用新孢子虫重组蛋白苗对BALB/c小鼠的体液免疫反应和细胞免疫反应水平进行评估,从而检验重组蛋白苗的免疫效果。
1 材料与方法
1.1 材料与主要试剂 HRP-山羊抗小鼠抗体、山羊抗小鼠IgG1抗体和山羊抗小鼠IgG2a抗体购自北京鼎国昌盛生物技术有限责任公司;弗氏佐剂购自Sigma生物公司;玻璃毛细管、山羊抗小鼠IgG抗体、小鼠IL-4检测试剂盒和小鼠IFN-γ检测试剂盒购自北京鼎国昌盛生物技术有限责任公司。
1.2 试验动物 50只 6~8 周龄BALB/c小鼠购自于新疆医科大学,由新疆农业大学动物实验室饲养。
1.3 主要仪器 JY92-IIN超声波细胞粉碎机购自宁波新芝生物科技股份有限公司;5452EH981575低温水平离心机购自Eppendorf公司;SPX-70L生化培养箱购自北京中仪国科科技有限公司;SYNERGY酶标仪购自美国伯腾仪器有限公司;SW-CJ-1D型单人净化工作台购自苏州净化设备有限公司;YXQLS-50A立式压力蒸汽灭菌器购自上海博迅实业有限公司;BCD-196F 低温冰箱购自青岛海尔股份有限公司。
1.4 实验方法
1.4.1 试验动物分组 将50 只6~8 周龄的BALB/c小鼠随机分为5组:对照组、弗氏佐剂组、NcSRS2重组蛋白苗组(NcSRS2+弗氏佐剂)、NcSAG1重组蛋白苗组(NcSAG1+弗氏佐剂)、联合组(NcSRS2+NcSAG1+佐剂),每组10只小鼠。
1.4.2 重组蛋白疫苗的制备 NcSRS2重组蛋白疫苗组,蛋白浓度为1 mg/mL,50 μL/只,弗氏佐剂50 μL/只;NcSAG1重组蛋白疫苗组,蛋白浓度为1 mg/mL,50 μL/只,弗氏佐剂50 μL/只;联合组,NcSRS2蛋白 25 μL/只,NcSAG1蛋白 25 μL/只,蛋白浓度均为1 mg/mL,弗氏佐剂50 μL/只。
1.4.3 重组蛋白疫苗的无菌试验 将制备好的三种重组蛋白疫苗,分别接种于普通琼脂营养培养基中,37℃培养48 h,观察有无细菌长出。无菌长出方可继续进行实验。
1.4.4 实验动物的免疫 分别用相应的重组蛋白疫苗对3组小鼠进行免疫,共免疫3 次。第1次用弗氏不完全佐剂配制成相应疫苗,第2次和第3次用弗氏完全佐剂配制成相应疫苗。对照组免疫同体积的无菌PBS;佐剂组免疫同体积的佐剂;其余3组,佐剂体积与重组蛋白体积相同,所用重组蛋白为50 μL/只,免疫途径均为腹腔注射,每只小鼠免疫量为100 μL/只。每次免疫间隔10 d,免疫结束后,对小鼠进行尾尖采血,5165×g离心10 min,在冰上析出血清,运用间接ELISA方法检测血清中IgG、IgG1及IgG2a的抗体水平。3免后1周,对各组小鼠进行眼龇静脉采血,用小鼠酶联免疫分析试剂盒按照操作说明对血清内的细胞因子IL-4和IFN-γ的表达水平进行测定。
1.4.5 重组蛋白苗安全性检验 分别对NcSRS2重组蛋白苗组、NcSAG1重组蛋白苗组、NcSRS2+NcSAG1联合蛋白苗组进行安全性检验和效力检验,观察各组小鼠觅食、精神状态有无异常,注射部位有无病变坏死。
1.4.6 检测血清中IgG、IgG1及IgG2a的抗体 用已纯化的重组NcSRS2蛋白和NcSAG1蛋白和包被酶标板,每孔100 μL(含重组蛋白0.5 μg),4℃过夜,用PBST清洗3 次后拍干;加入5%的脱脂乳200 μL/孔,37℃孵育2 h,PBST清洗3次后拍干;加入血清样品(1:200),37℃孵育2 h,PBST清洗3 次后拍干;加入IgG、IgG1或IgG2a抗体(1:2000)稀释,37℃孵育2 h,PBST 清洗3次后拍干;加入 HRP标记的羊抗鼠二抗,37℃孵育1 h,PBST 清洗3 次后拍干;加入底物溶液(0.75% H2O2),37℃孵育10 min,在加入终止液(2 mol/L H2SO4),用酶标仪测OD490处的吸光度值。每次每板同时设立阴性血清对照组和空白组,采用SPSS22.0软件进行统计学分析。
1.4.7 检测免疫血清中IL-4和IFN-γ的表达水平 将小鼠酶联免疫分析试剂盒室温放置30 min,取出酶标板,先将标准品按比例进行稀释,在酶标包被板上加入标准品50 μL,待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL。用封板膜封板后置37 ℃温育30 min. 用清洗液(浓缩洗涤液用ddH2O按1:30 稀释)清洗酶标板5次拍干;在每孔中加入酶标试剂50 μL,(空白对照孔中不加),用封板膜封板后,置37℃温育30 min;再次洗板重复5次后,每孔依次加入50 μL显色剂A、50 μL显色剂B,混匀后37℃下避光显色10 min,每孔加终止液50 μL,终止反应,并用酶标仪测OD450处的吸光度值。用SPSS22.0软件进行统计学分析。
2 结果
2.1 无菌试验结果 将三组重组蛋白苗分别接种于普通琼脂培养基中,在37℃条件下培养48 h,观察得出三组重组蛋白苗均无细菌长出。
2.2 安全性试验结果 观察三次注射疫苗后的实验小鼠,发现觅食正常,精神状态良好,无任何异常反应,注射部位无病变坏死。三免后10 d将小鼠处死解剖,取其疫苗注射部位组织,将组织制成悬液后接种于普通琼脂营养培养基中,37℃培养48 h,均无发现细菌生长,结果表明重组蛋白苗安全性较好。
2.3 免疫小鼠后IgG、IgG1、IgG2a抗体水平的测定 每次免疫1周测血清中IgG、IgG1、IgG2a抗体效价(OD490)。结果表明,血清中的抗体效价随着免疫次数的增加而增高,IgG和IgG1抗体在一免后与对照组和佐剂组差异具有显著统计学意义(P<0.05),在二免后差异具有极显著统计学意义(P<0.01)(图1和图2)。IgG2a抗体在三免后与对照组和佐剂组差异具有极显著统计学意义(P<0.01)(图3)。
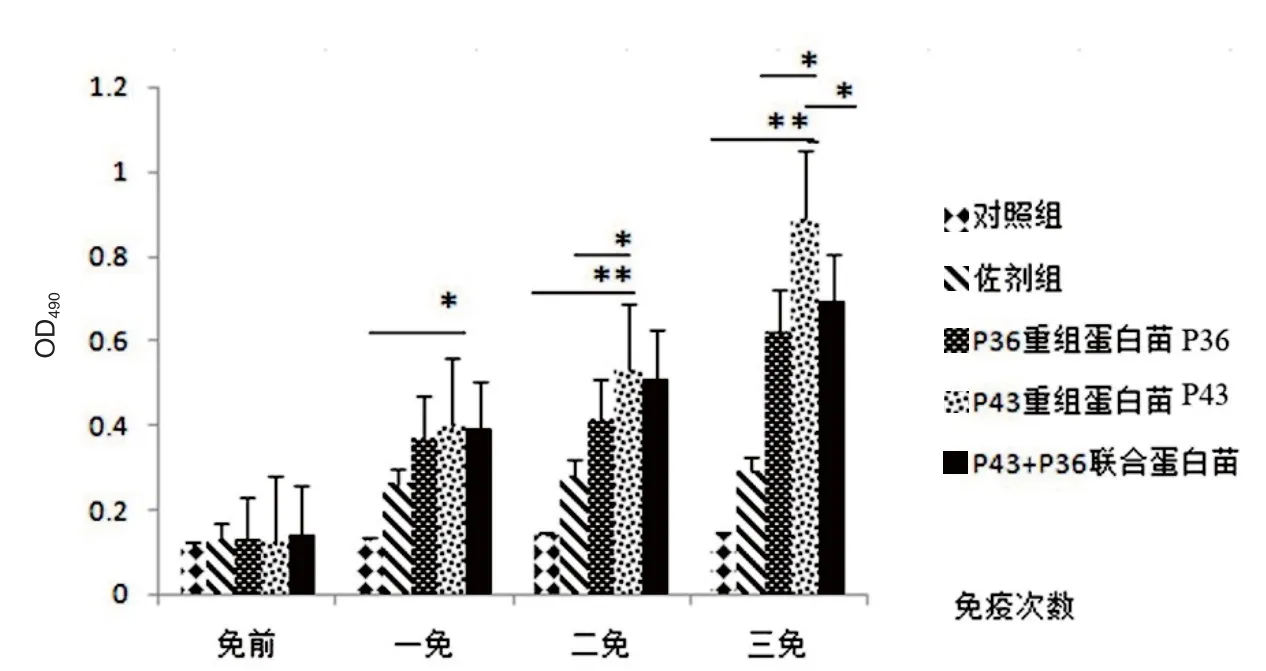
图1 IgG抗体效价测定结果Fig.1 IgG antibody titer determination
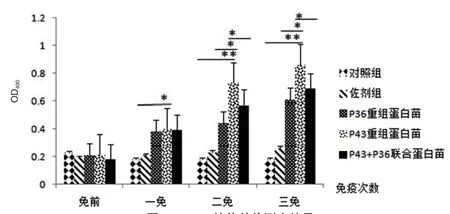
图2 IgG1抗体效价测定结果Fig.2 IgG1 antibody titer determination

图3 IgG2a抗体效价测定结果Fig.3 IgG2a antibody titer determination
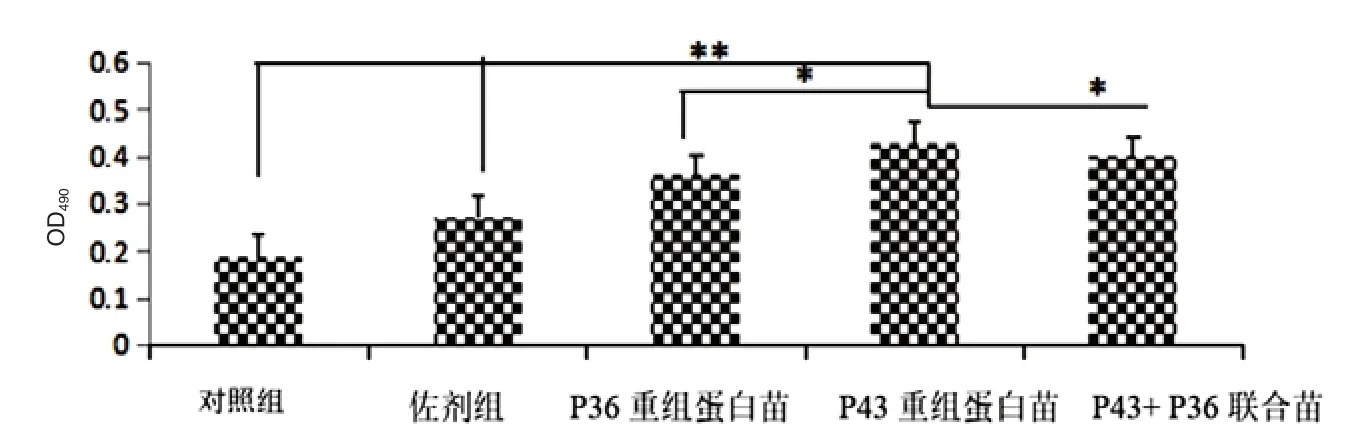
图4 血清内 IL-4的测定结果Fig.4 The levels of IL-4 determination

图5 血清内IFN-γ的测定结果Fig.5 The levels of IFN-γ determination
2.4 细胞因子IL-4和IFN-γ的测定结果 三免后的1周,对小鼠进行眼龇静脉采血并制备血清,利用小鼠酶联免疫分析试剂盒对血清内的细胞因子IL-4和IFN-γ进行测定。结果表明,NcSRS2重组蛋白苗组免疫血清中IL-4和IFN-γ水平极显著高于对照组和弗氏佐剂组(P<0.01),显著高于NcSAG1重组蛋白苗组和NcSRS2+NcSAG1联合组(P<0.05)(图4和图5)。
3 讨论
新孢子虫是一种寄生于有核细胞内的原虫,在其感染宿主过程中可以激发宿主体内的Th1、Th2型免疫应答,尤其在研究重组蛋白苗的过程中,评定疫苗效果的一个重要指标往往就是看血清中抗体以及细胞因子水平的变化[16,17],之所以重组蛋白抗原能大量的用于疫苗领域,除考虑重组抗原的天然结构之外,佐剂的选择也是制备重组蛋白苗最关键的步骤之一,目前制备疫苗应用最为广泛的佐剂是弗氏佐剂,它能够对机体可产生程度不同的免疫增强作用[18]。本试验对照组的小鼠抗体产生缓慢,且效价低,加入佐剂后小鼠抗体的产生较快,由此可知在提高疫苗的免疫效果方面佐剂起着至关重要的作用。
新孢子虫的体液免疫研究主要体现在对IgG抗体的研究上,IgG亚群抗体的研究集中在IgG1、IgG2a上。当Th1型细胞因子IFN-γ激发IgG2a的抗体水平,Th2型细胞因子IL-4水平可上调B细胞分泌的IgG1抗体水平。结合IgG、IgG1、IgG2a效价结果,由于Th1型免疫反应的主要指标是IgG2a抗体和IFN-γ,Th2型免疫反应的主要指标是IgG1和IL-4[19],抗体和细胞因子的升高表明NcSRS2和NcSAG1都可激发机体的Th1和Th2型免疫反应。
本研究在小鼠体内探讨了该疫苗诱导的体液免疫和细胞免疫应答,基于小鼠模型的研究,下一步的工作是测定小鼠的保护性效果,为后期将新孢子虫重组蛋白苗应用到本体动物牛身上,看是否该疫苗在本体动物上也同样能够诱导产生较好的免疫效果,更有力地验证疫苗的免疫效力奠定基础,为开发新型疫苗提供新思路。
[1] Zhang W, Deng C, Liu Q, et al. First identification of Neospora caninum, infection in aborted bovine foetuses in China[J]. Vet Parasitol, 2007, 149(1-2):72-76.
[2] Sinnott F A, Monte L G, Collares T F, et al. Blocking ELISA Using Recombinant NcSRS2 Protein for Diagnosing Bovine Neosporosis[J]. Curr Microbiol, 2015,70(3): 429-432.
[3] 余劲术. 新孢子虫NcSRS2和NcSAG1基因及重组蛋白免疫原性的研究[D]. 北京: 中国农业大学, 2005.
[4] Ocal N, Atmaca H T, Albay M K, et al. A new approach to Neospora caninum infection epidemiology: neosporosis in integrated and rural dairy farms in Turkey[J]. Turk J Vet Anim Sci, 2014, 38(2): 161-168.
[5] Canada N, Meireles C S, Ferreira P, et al. Artificial insemination of cows with semen in vitro contaminated with Neospora caninum, tachyzoites failed to induce neosporosis[J]. Vet Parasitol, 2006, 139(1-3):109-114.
[6] Donahoe S L, Lindsay S A, Krockenberger M, et al.A review of neosporosis and pathologic findings of Neospora caninum infection in wildlife[J]. Int J Parasitol,2015, 4(2): 216-223.
[7] Khodakaram-Tafti A, Mansourian M, Namavari M, et al. Immunohistochemical and polymerase chain reaction studies in Neospora caninum, experimentally infected broiler chicken embryonated eggs[J]. Vet Parasitol, 2012,188(1-2): 10-13.
[8] Dubey J P, Buxton D, Wouda W. Pathogenesis of Bovine Neosporosis[J]. J Comp Pathol, 2006, 134(4): 267-289.
[9] Nishikawa Y, Inoue N, Xuan X, et al. Protective efficacy of vaccination by recombinant vaccinia virus against Neospora caninum, infection[J]. Vaccine, 2001, 19(11-12): 1381-1390.
[10] Pinitkiatisakul S, Friedman M, Wikman M, et al.Immunogenicity and protective effect against murine cerebral neosporasis of recombinant NcSRS2 in different iscom formulations[J]. Vaccine, 2007, 25(18): 3658-3668.
[11] Pinitkiatisakul S, Mattsson J G, Wikman M, et al.Immunisation of mice against neosporosis with recombinant NcSRS2 iscoms[J]. Vet Parasitol, 2005,129(1-2): 25-34.
[12] Haldorson G J, Mathison B A, Wenberg K, et al.Immunization with native surface protein NcSRS2 induces a Th2 immune response and reduces congenital Neospora caninum transmission in mice[J]. Int J Parasitol,2005, 35(13):1407-1415.
[13] Nishikawa Y, Inoue N, Xuan X, et al. Protective efficacy of vaccination by recombinant vaccinia virus against Neospora caninum infection[J]. Vaccine, 2001, 19(11-12): 1381-1390.
[14] Dubey J P. Recent advances in Neospora and neosporosis[J]. Vet Parasitol, 1999, 84(3-4): 349-367.
[15] 殷铭阳, 周东辉, 刘建枝, 等. 中国牦牛主要寄生虫病流行现状及防控策略[J]. 中国畜牧兽医, 2014, 41(5): 227-230.
[16] 杨东升. 新孢子虫 NcMIC2-like1 重组蛋白对小鼠新孢子虫感染的免疫保护作用[D]. 吉林: 吉林大学, 2016.
[17] Jenkins M, Parker C, Tuo W, et al. Inclusion of CpG adjuvant with plasmid DNA coding for NcGRA7 improves protection against congenital neosporosis[J].Infect Immun, 2004, 72(3): 1817-1819.
[18] 张慧贤, 魏林, 李娜, 等. 细胞因子IL-27 和CpG ODN佐剂对呼吸道合胞病毒重组蛋白疫苗免疫效果的影响[J].免疫学杂志, 2016, 32(6): 474-479.
[19] López-Pérez I C, Collantes-Fernández E, Aguado-Martínez A, et al. Influence of Neospora caninum,infection in BALB/c mice during pregnancy in post-natal development[J]. Vet Parasitol, 2008, 155(3-4): 175-183.
IMMUNE RESPONSES OF RECOMBINANT NCSRS2 AND NCSAG1 PROTEINS OF NEOSPORA CANINUM IN MICE
LIU Meng-li1, XU Zheng-mao1, JI Ergele2, ZHANG Yang1, BA Yinchahan1
(1.Veterinary Medicine College of Xinjiang Agricultural University, Urumqi 830052, China; 2. BaYin Guoleng Technology College, Korla 841000, China)
The objective of the present study was to investigate immune responses of recombinant proteins NcSRS2 and NcSAG1 of Neospora caninum in mice. BALB/c mice were immunized with recombinant NcSRS2 and NcSAG1 proteins emulsified in Freund's adjuvant and blood samples were collected for detection of IgG, IgG1, IgG2a, IL-4 and IFN–γ expression levels using ELISA methods.The results indicated that both proteins elicited Th1 immune response with elevated IgG2a and IFN-γ levels and Th2 immune response with elevated IgG1 and IL-4 levels. In addition, NcSRS2 induced signi fi cantly higher (P<0.05) immune response than NcSAG1. This study provided a reference for the study of NcSRS2 and NcSAG1 recombinant protein vaccine against N.caninum.
Neospora caninum; recombinant protein; NcSRS2; NcSAG1
S852.72
A
1674-6422(2017)05-0047-06
2017-01-14
新疆维吾尔自治区科技成果转化专项资金项目(201454129)
刘梦丽,女,硕士,主要从事动物寄生虫学及免疫学的研究
巴音查汗,E-mail:2514062881@qq.com
